非小细胞肺癌
靶向治疗
EGFR突变
1. BBT-207(四代):临床前研究,打破奥希替尼耐药困境
EGFR 20ins
2. 一项研究:I期,PLB1004,ORR为57.7%、DCR为100%
ALK融合
3. NVL-655(四代):临床前研究,可解决劳拉替尼耐药,特别是G1202R突变或复合突变
HER2突变
4. 一项研究:I期,SHR-A1811,数据惊艳,ORR为40.0%、PFS为10.8个月
RET融合
5. 一项研究:I期,HS-10365,初治ORR为83.3%,经治ORR为66.7%
免疫治疗
新辅助/辅助免疫治疗
6. AEGEAN研究:III期(纳入患者多为3期),I药+化疗 vs 化疗,EFS分别为NR vs 25.9个月
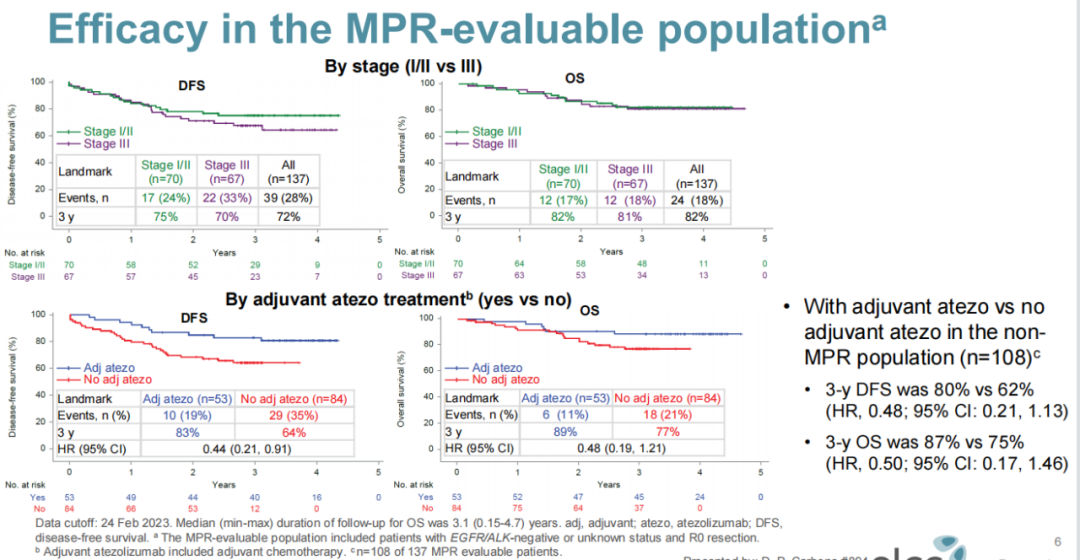
7. LCMC3研究:II期,阿替利珠单抗新辅助/选择性辅助治疗,DFS有更好的获益趋势
非小细胞肺癌-靶向治疗部分
EGFR是非小细胞肺癌(NSCLC)最常见的治疗靶点之一,EGFR-TKI治疗已经在这类患者中显示出很好的临床效益。但不幸的是,大多数患者在接受一二三代EGFR-TKI治疗一段时间后都不可避免地出现进展。最常见的靶向耐药突变是T790M和C797S。为了防止耐药继发性突变对治疗效果的影响,下一代EGFR-TKI必须同时对治疗继发突发和原突变体具有活性。在这项进一步的临床前研究中,评估了四代EGFR-TKI BBT-207在EGFR T790M和C797S突变驱动的NSCLC肿瘤模型中延缓肿瘤再生或延长生存期的活性。
一项评估PLB1004治疗晚期非小细胞肺癌(NSCLC)的安全性、耐受性、药代动力学与抗肿瘤作用的I期多中心、开放、剂量递增与剂量扩展研究(方案编号:PLB1004-I-01)已完成受试者招募。截至2022年7月31日,共65例受试者接受PLB1004治疗(剂量递增组32例,剂量扩展组33例)。【PLB1004是北京鞍石生物科技有限责任公司自主研发的新型小分子酪氨酸激酶不可逆抑制剂,具有高选择性,可以透过血脑屏障。非临床药效实验表明该化合物对EGFR 20号外显子插入(ex20 ins)突变、HER2 20号外显子插入(ex20 ins)突变、EGFR敏感突变、EGFR耐药突变和EGFR罕见突变均有效。】
NVL-655(Nuvalent公司开发)一种新型脑部渗透性、ALK选择性抑制剂,旨在维持对ALK和ALK突变的活性,并避免产生与TRK抑制相关的神经不良事件和剂量限制毒性。脑转移在ALK阳性NSCLC中很常见,诊断时的发病率为40%,由于第一代ALK-TKI克唑替尼的脑穿透有限,疾病进展后的发病率为60%。第二代(色瑞替尼、阿来替尼、布加替尼、恩沙替尼)和第三代(洛拉替尼)ALK-TKIs比克唑替尼有更高的颅内反应,但仍然受到耐药突变出现的限制,最常见的是含有G1202R的单一和复合突变。此前,已有报道证明,在Ba/F3 EML4-ALK v1 G1202R/L1196M临床前模型中,NVL-655具有颅内活性。而此次的研究结果,进一步证明了在含有EML4-ALK v3 G1202R的临床前患者衍生模型中NVL-655的颅内活性。

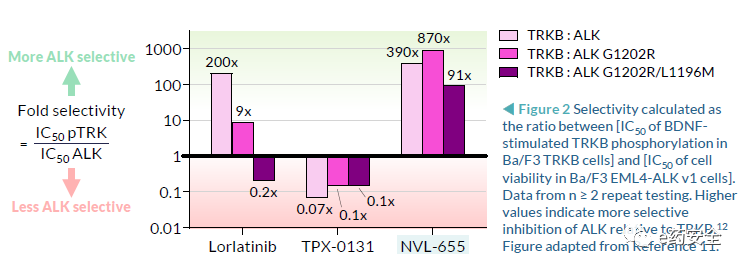
对TRK靶点活性弱
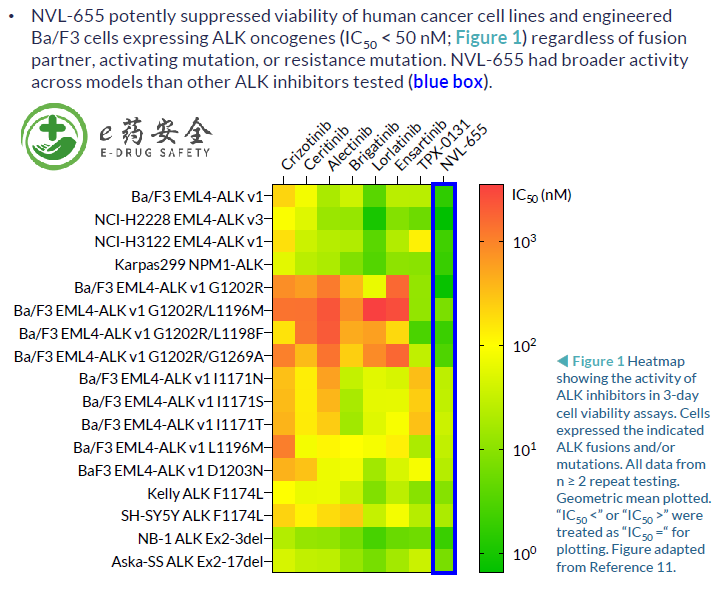 抑瘤效力比较
抑瘤效力比较
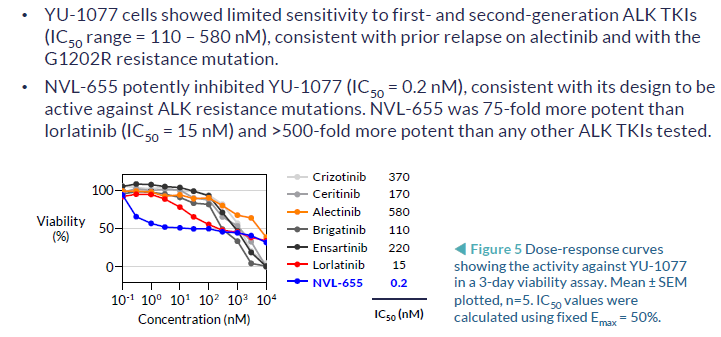
抑制细胞活力对比
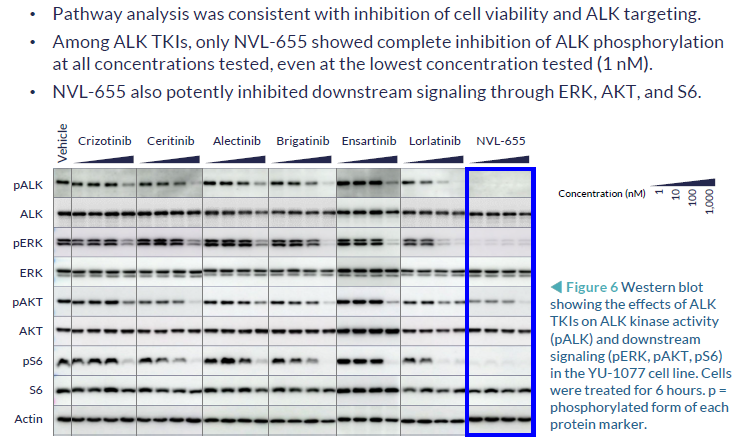
细胞信号通路抑制能力
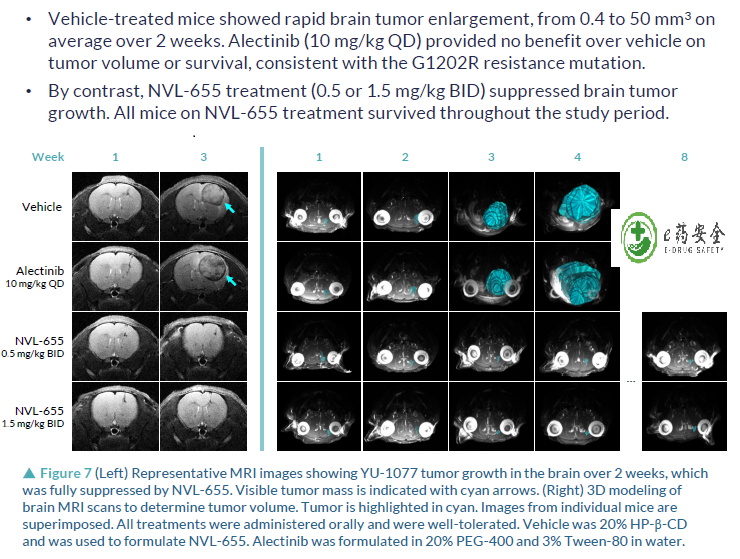
抑制颅内肿瘤能力
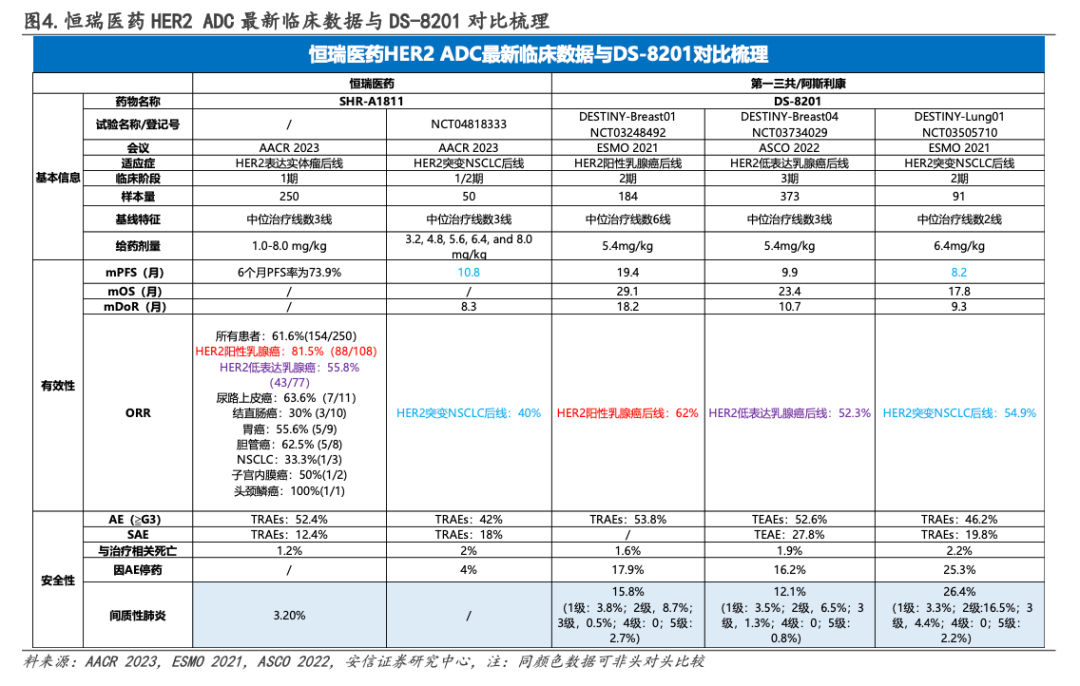
SHR-A1811 vs DS-8201
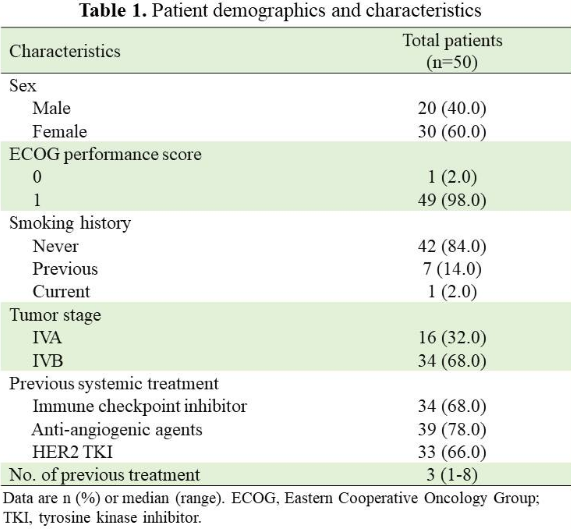
研究结果:截止数据(2022年11月8日),有50名患者入组,均为IV期,既往全身治疗中位数为3(范围1-8),包括HER2-TKI(66%)、免疫检查点抑制剂(68%)和抗血管生成药物(78%)。96%的患者具有HER2激酶结构域突变。
剂量递增 ↑
基线特征 →
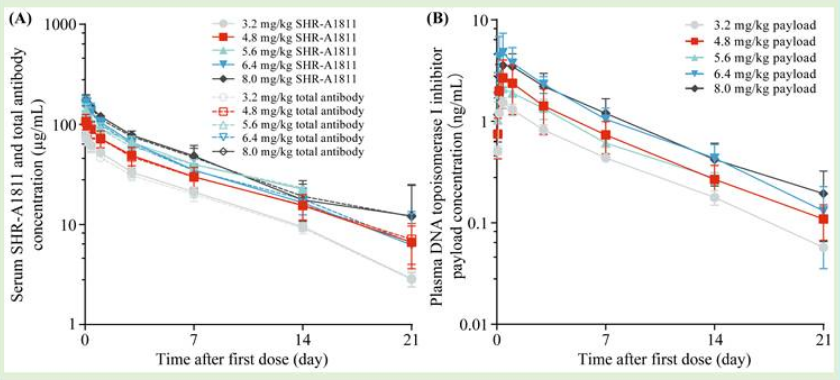
1)单次给药后,SHR-A1811的剂量暴露量(Cmax和AUClast)呈现剂量相关性。SHR-A1811和总抗体的PK参数在所有剂量水平下都相似,观察到游离拓扑异构酶I抑制剂的低血浆暴露。
2)8.0 mg/kg剂量队列中有一名患者发生剂量限制性毒性(4级发热性中性粒细胞减少症和4级血小板减少症)。4.8 mg/kg剂量扩展组共纳入38名患者,中位随访时间为5.6个月(95%CI 4.2-7.0),62%的患者仍在接受治疗。所有患者ORR为40.0%(95%CI 26.4-54.8);中位DOR为8.3个月(95%CI 5.4-13.7);DCR为86.0%(95%CI 73.3-94.2);中位PFS为10.8个月(95%可信区间6.7-15.0)。目前该研究中SHR-A1811的4.8 mg/kg和5.6 mg/kg剂量扩展正在进行,以进一步确认RP2D。
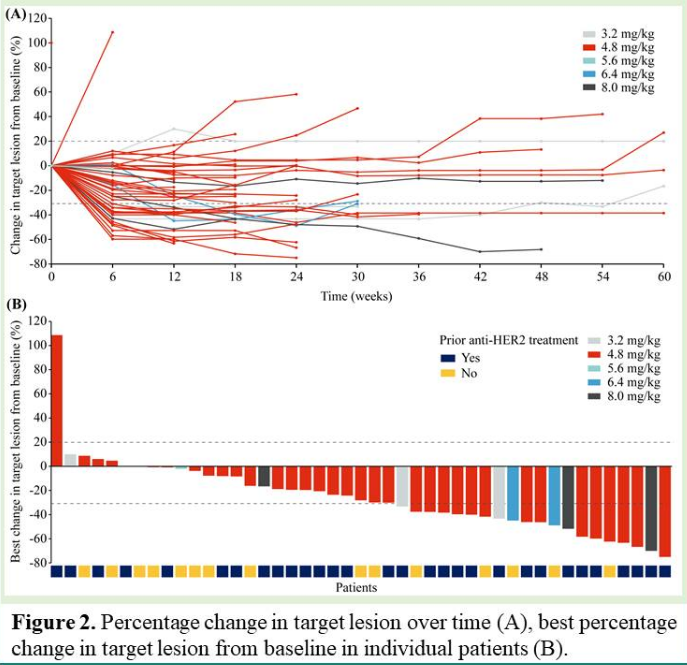
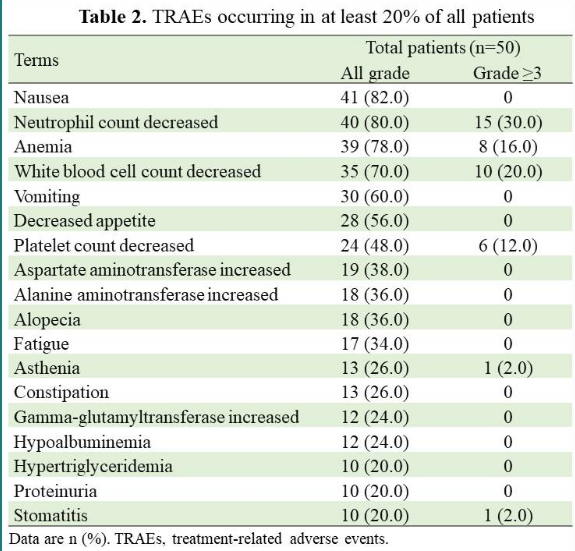
安全性方面,所有患者均发生治疗相关不良事件(TRAE)。42%的患者经历了≥3级TRAE,最常见的是中性粒细胞计数下降(30%)、白细胞计数降低(20%)、贫血(16%)和血小板减少症(12%)。9名患者(18%)出现与SHR-A1811相关的严重不良事件,两名患者因AE而停止治疗,一例死亡与治疗有关(间质性肺病)。
HS-10365是一种高效选择性酪氨酸激酶抑制剂,临床前研究表明其在RET改变的肿瘤模型中具有良好的安全性和抗肿瘤活性。研究者进行了一项I期研究,以评估HS-10365在RET改变的实体瘤中的安全性、耐受性、药代动力学(PK)和抗肿瘤活性。
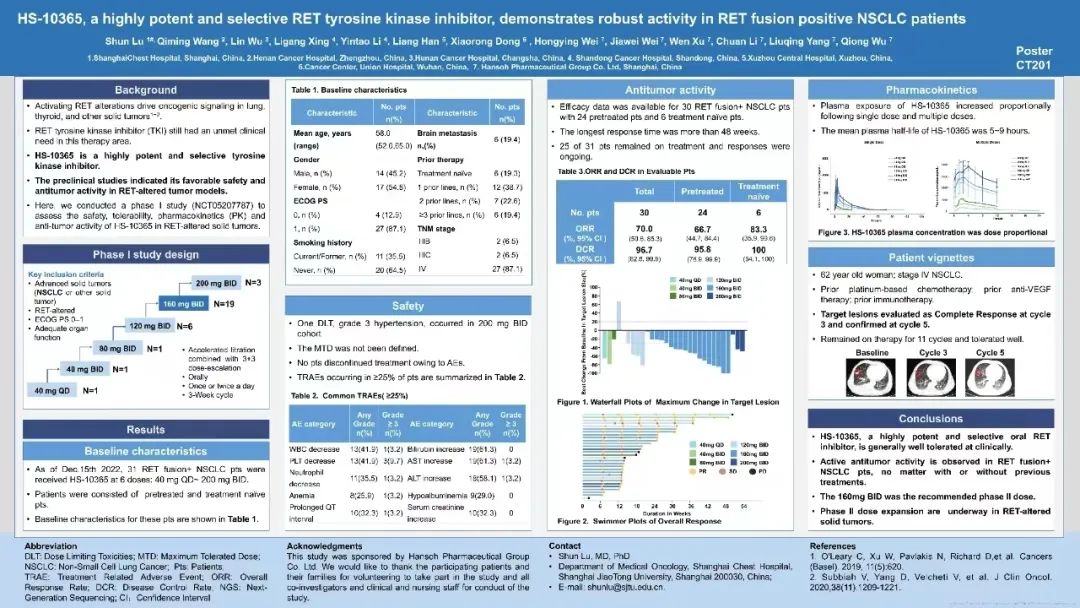
研究结果显示,HS-10365在无标准治疗方案或无法获得或不能耐受标准治疗的RET融合阳性的晚期NSCLC患者中具有良好的安全性、耐受性和药代动力学特征,并显示出良好的抗肿瘤活性。HS-10365对初治NSCLC患者的ORR为83.3%,对经治NSCLC患者的ORR为66.7%,其中2例受试者靶病灶获得完全缓解,最长缓解时间已超过48周。
目前,翰森制药已在国内启动并加速推进HS-10365针对晚期NSCLC患者的关键注册临床试验,同时评估HS-10365在RET异常的多种晚期实体瘤患者中的疗效和安全性。
非小细胞肺癌-免疫治疗部分
新辅助/辅助免疫治疗
AEGEAN(NCT03800134):是一项随机、双盲、安慰剂对照III试验,旨在评估新辅助度伐利尤单抗+化疗序贯手术治疗,及后续辅助度伐利尤单抗治疗可切除NSCLC患者的疗效和安全性。研究纳入未经治疗的ⅡA-ⅢB(N2)期可切除NSCLC患者,1:1随机接受术前度伐利尤单抗1500mg或安慰剂+含铂化疗(Q3W 4周期),后续度伐利尤单抗 1500mg或安慰剂(Q4W至12周期)。分层因素包括疾病分期(Ⅱ期 vs Ⅲ期)、PD-L1表达水平(<1% vs ≥1%,Ventana SP263检测)。疗效分析时,改良意向治疗人群(mITT)排除具有EGFR/ALK异常的患者。主要终点是中心实验室评估的pCR,BICR评估的EFS;次要终点包括主要病理缓解(MPR),BICR评估的无病生存期(DFS)和OS。
2019年1月2日~2022年4月19日,799例患者接受治疗(D组400例,单纯化疗组399例),其中740例为mITT人群(注:mITT是指排除存在EGFR或ALK突变的ITT人群)。mITT人群的基线特征基本均衡。70%以上的患者接受以卡铂为主的新辅助双药化疗方案,此外,研究纳入的Ⅲ期患者更多,达到70%以上。进行本次pCR期中分析(IA)的条件是~400例mITT患者有机会接受手术治疗(实际n=402)。最终分析的条件是所有mITT人群有机会接受手术治疗(实际n=740)。
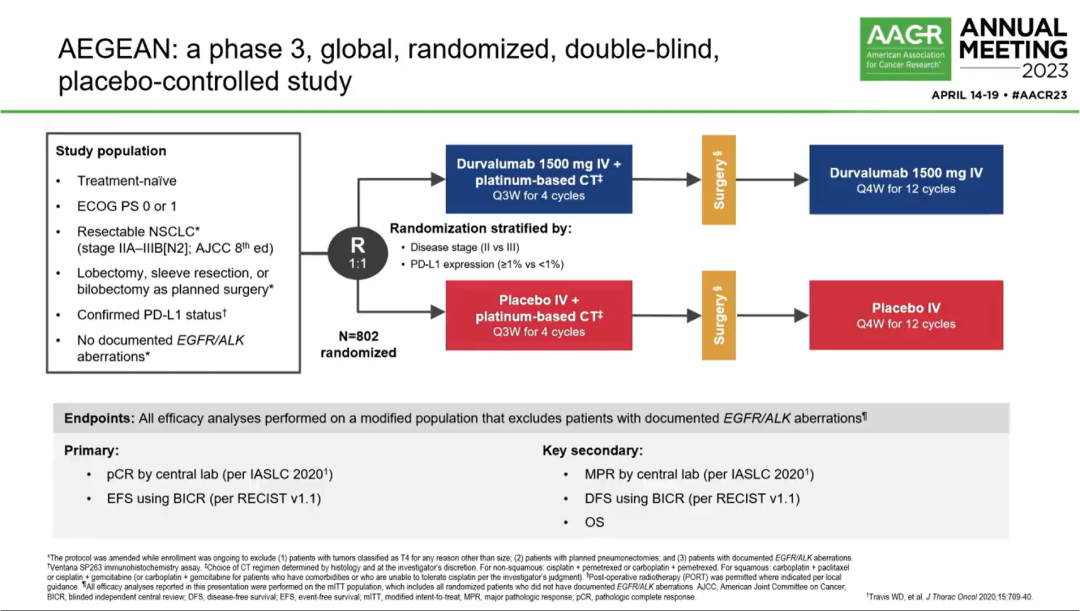
研究设计
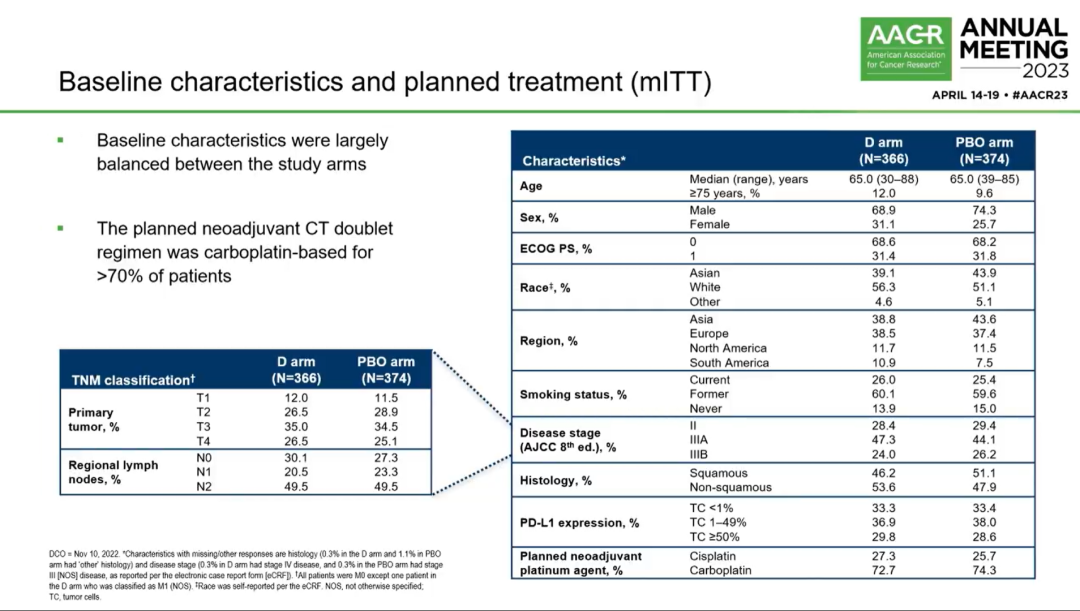
mITT人群基线特征
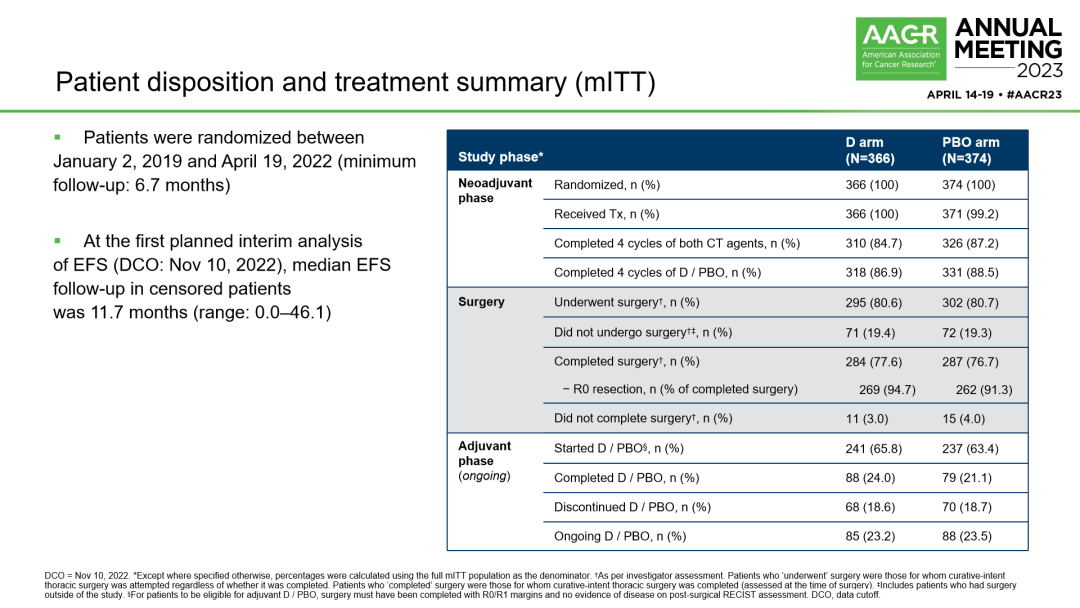
治疗情况
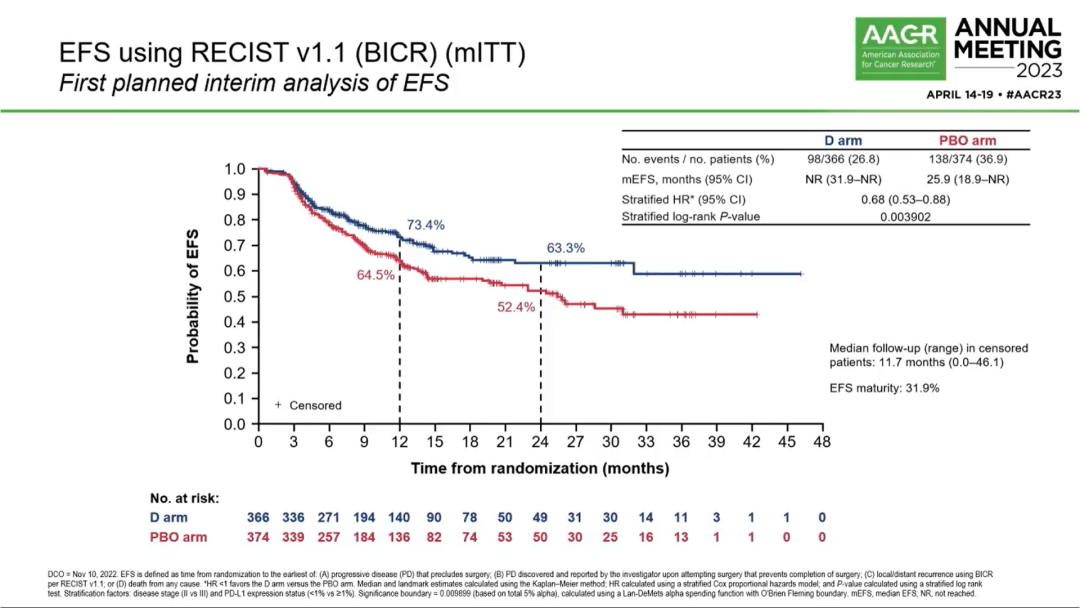
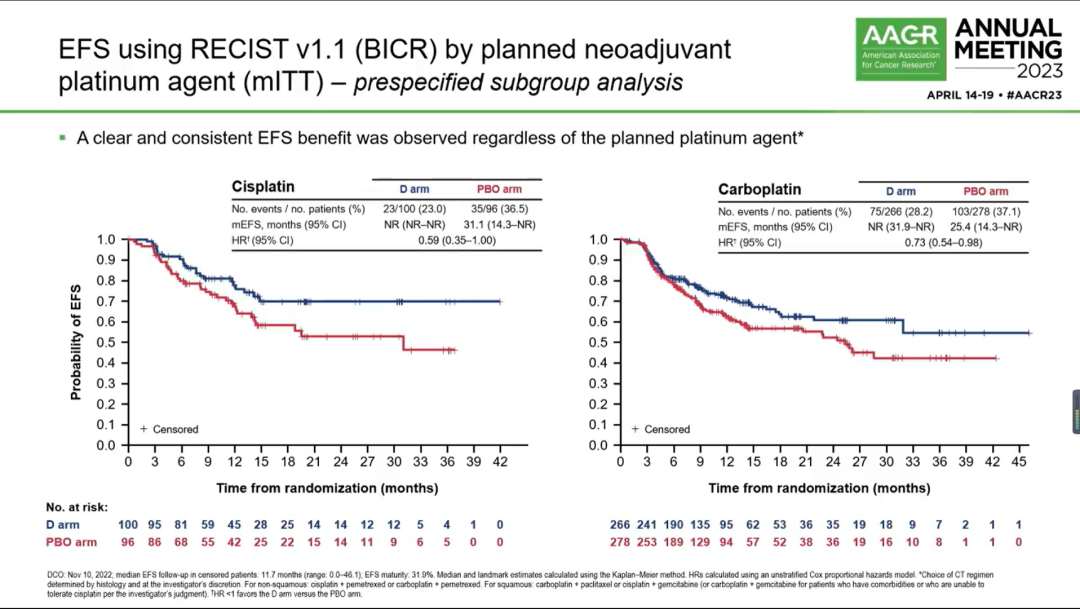
1)EFS:实验组和对照组的EFS分别为NR vs 25.9个月(HR 0.68; 95%CI 0.53-0.88; P=0.0039)。此外,各亚组EFS结果也均显示出试验组的治疗获益趋势。值得注意的是,不论基线PD-L1表达水平如何,均能观察到EFS获益。新辅助不同铂类(顺铂/卡铂)化疗并不影响EFS获益(下图3)。

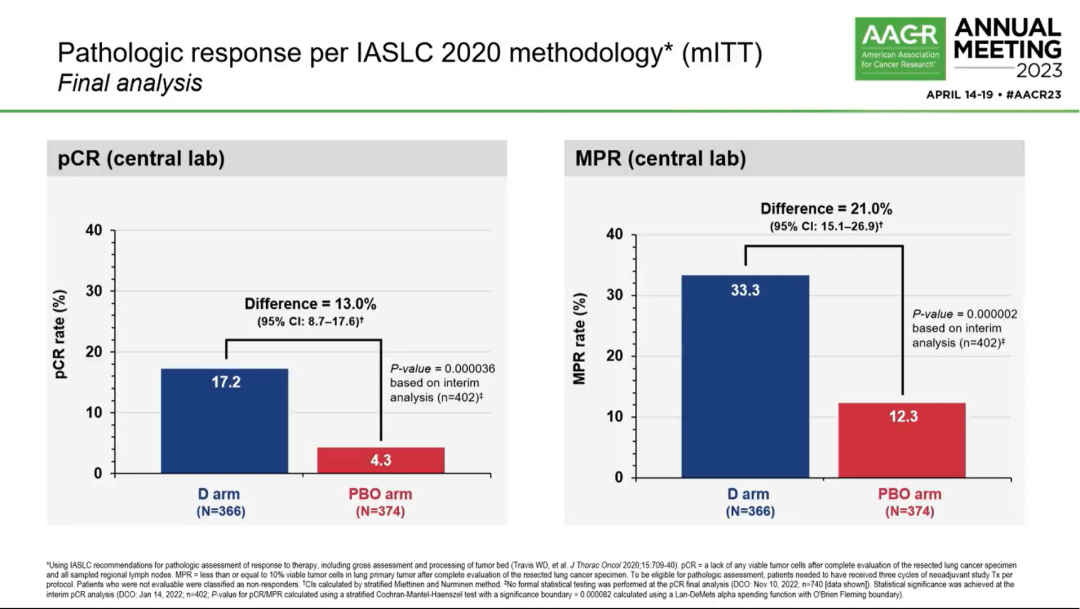
病理缓解情况
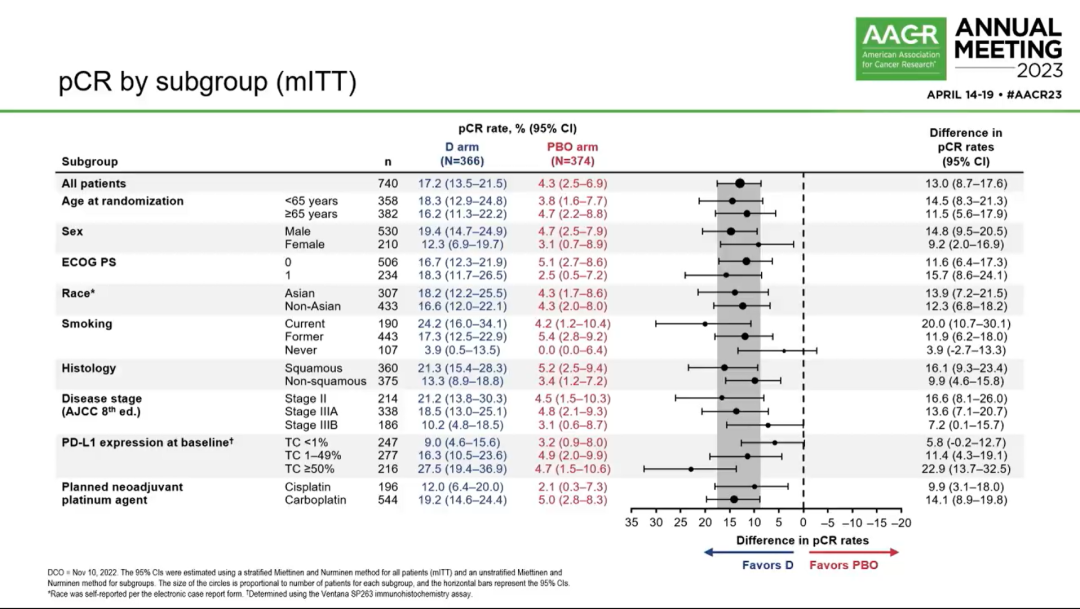
各亚组pCR情况
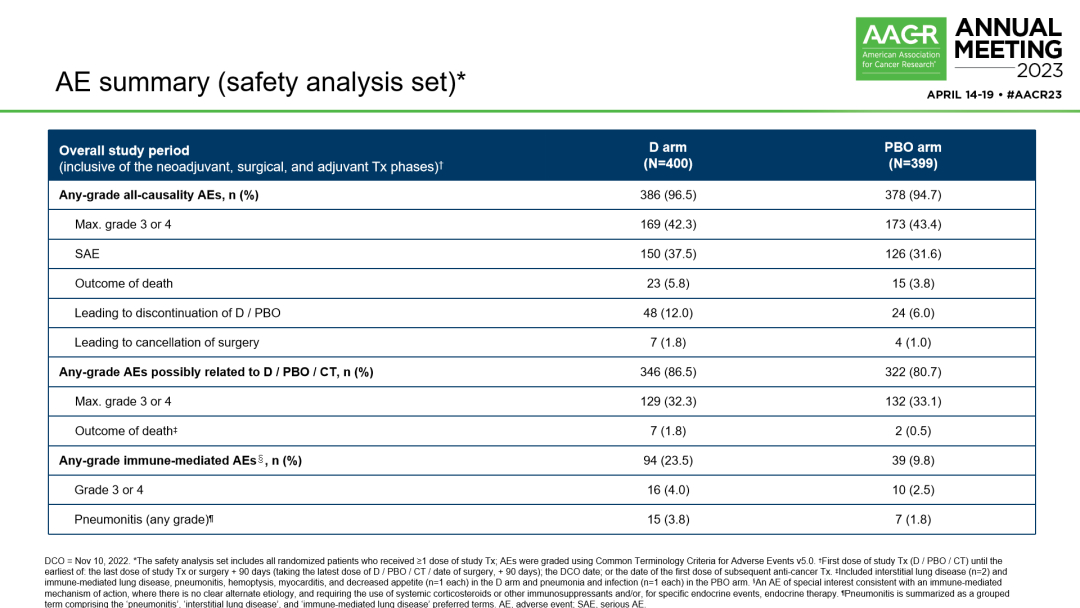
不良反应汇总
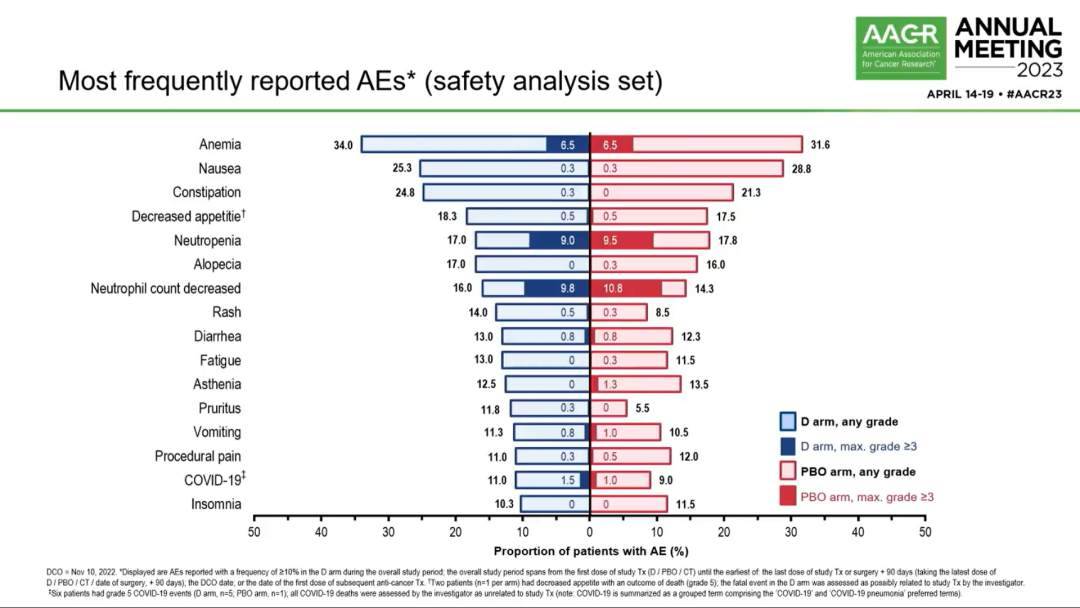
常见的AE
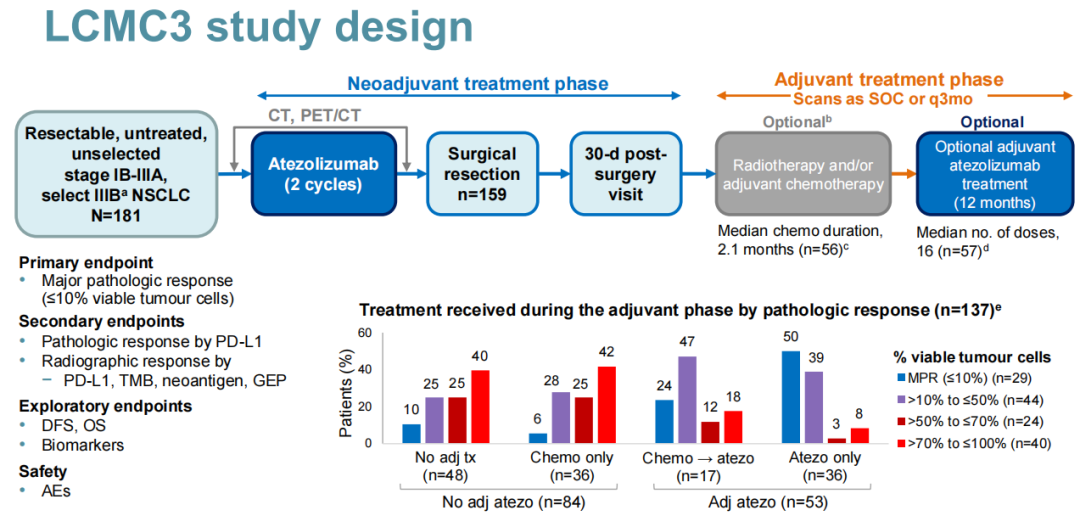
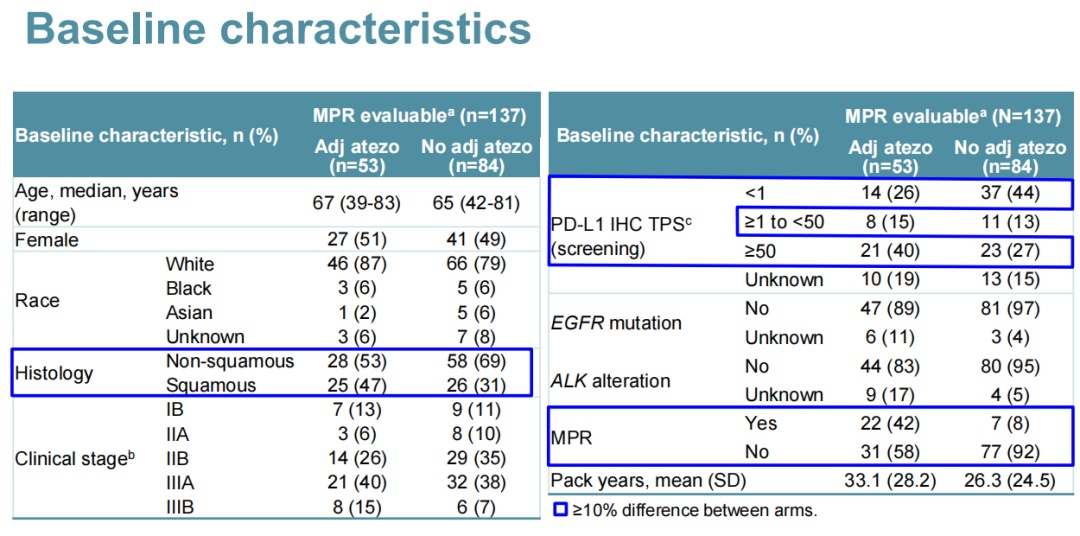
LCMC3研究:一项开放标签、单臂、2期研究,旨在评估可切除的ⅠB~ⅢA期或部分经选择的ⅢB期NSCLC患者接受2个周期阿替利珠单抗单药新辅助治疗,术后选择性应用阿替利珠单抗辅助治疗的疗效及安全性。主要研究终点为MPR(定义为手术切除标本中存活肿瘤细胞≤10%);次要终点包括根据PD-L1表达进行分层的病理学缓解和根据PD-L1、TMB、新抗原和基因表达谱(GEP)进行分层的影像学缓解;探索性终点为DFS、OS和生物标志物。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言