FDA 关闭 PI3K 抑制剂单臂试验的大门,会给中国新药研发带来哪些启示?
2022-04-29 MedSci原创 MedSci原创
PI3K抑制剂可调节多个细胞过程,包括细胞生长、增值、分化和新陈代谢等。血癌中可见其信号通路的激活——失调的PI3K信号传导促进了恶性淋巴细胞的存活和增殖。目前,PI3K抑制剂
PI3K抑制剂可调节多个细胞过程,包括细胞生长、增值、分化和新陈代谢等。血癌中可见其信号通路的激活——失调的PI3K信号传导促进了恶性淋巴细胞的存活和增殖。目前,PI3K抑制剂在血癌领域已获批的适应症,包括慢性淋巴细胞白血病 (CLL)、小淋巴细胞淋巴瘤(SLL)、滤泡性淋巴瘤(FL)和边缘区淋巴瘤 (MZL),非霍奇金淋巴瘤(NHL)适应症正在开发中。
目前美国FDA共批准5款产品上市。2022年,3 月 18 日,NMPA 官网最新批件显示,石药集团的 PI3Kδ/γ 抑制剂「度维利塞胶囊」(曾用名:度恩西布)获批上市,用于滤泡性淋巴瘤。这是国内首款获批的 PI3K 抑制剂。
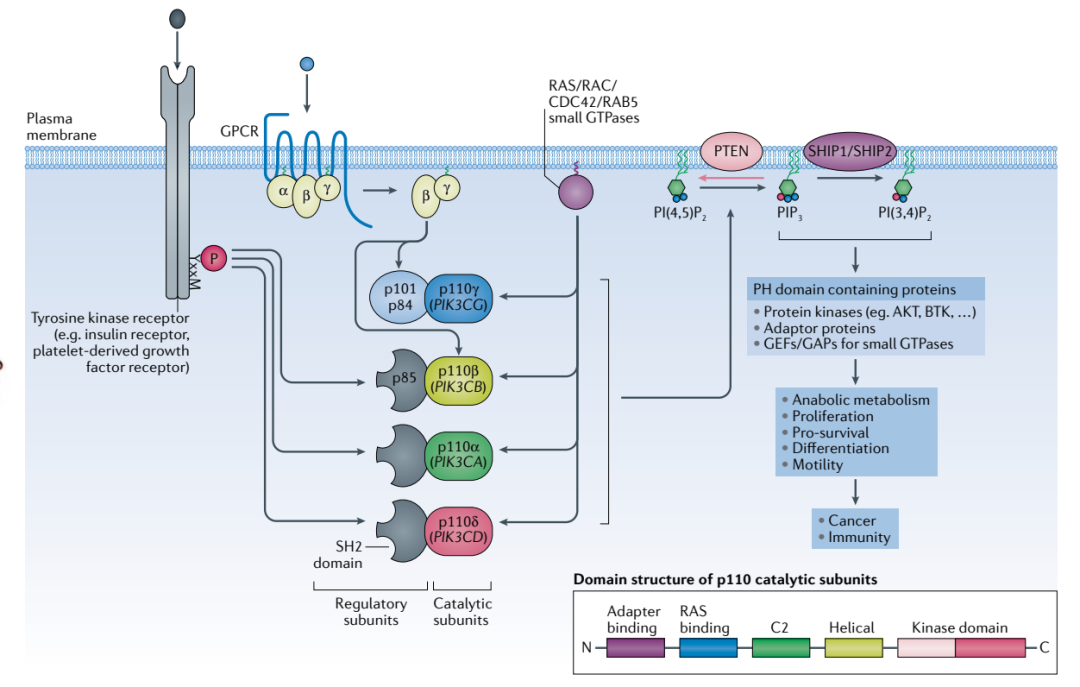
I类PI3K信号传导
已上市PI3K抑制剂仅为五款
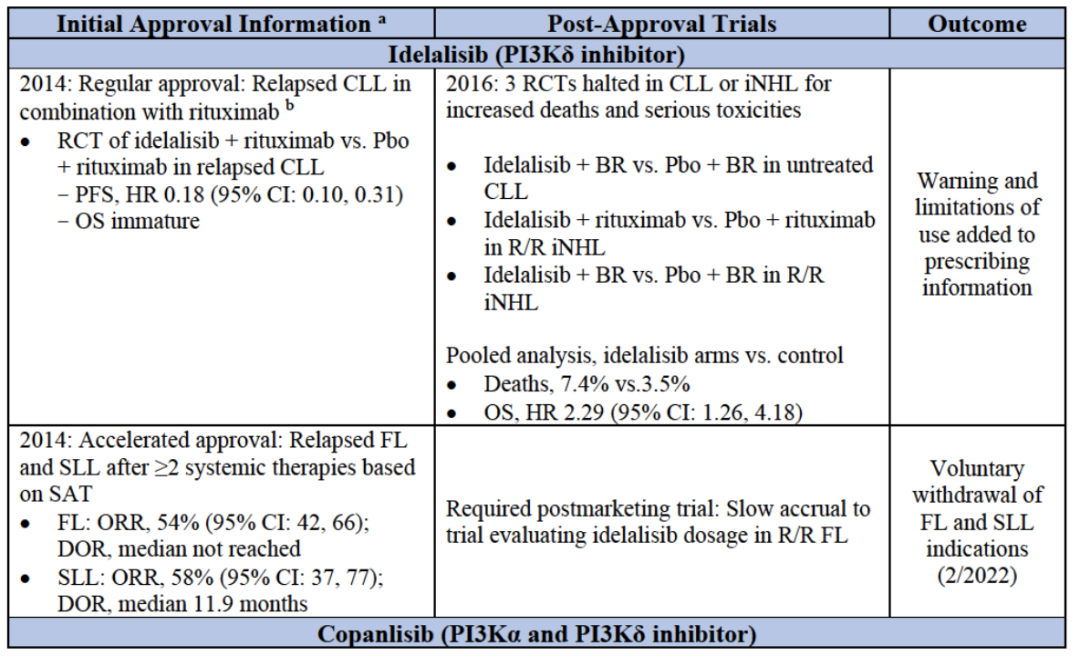
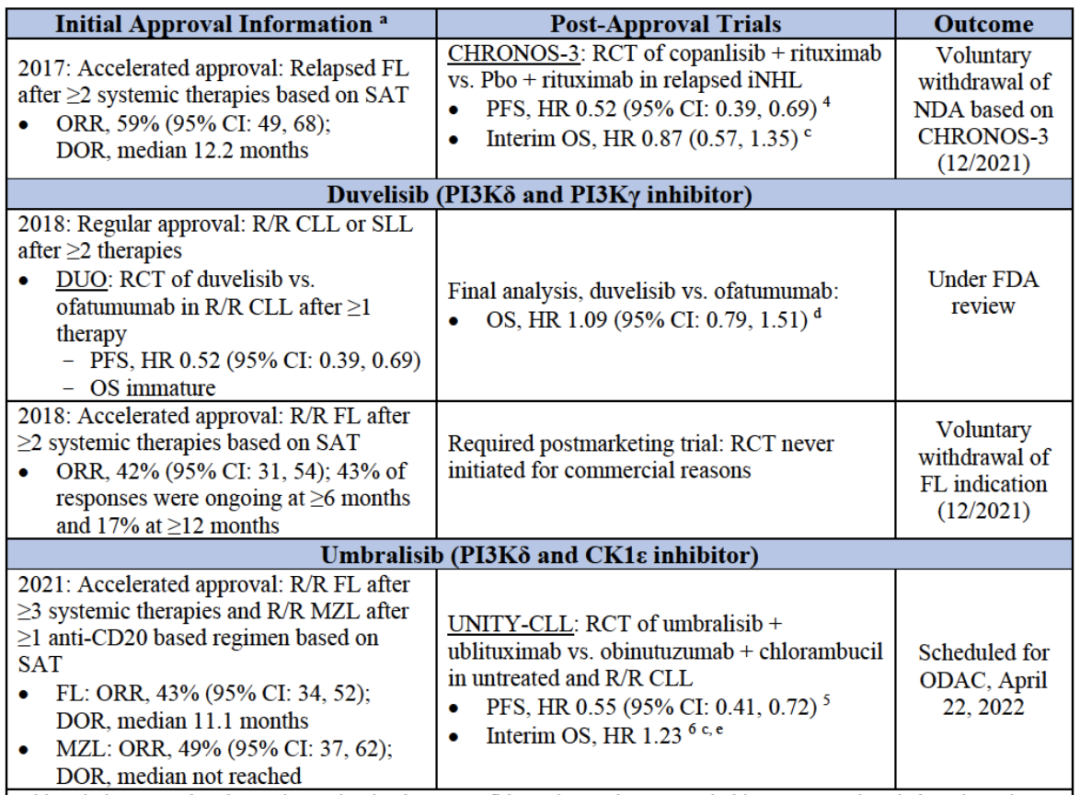 血癌:PI3K抑制剂批准信息
血癌:PI3K抑制剂批准信息
PI3K抑制剂近期面临的挑战
吉利德的Idelalisib在获批2年后,临床试验中出现严重不良事件,包括肝脏毒性、严重腹泻或肠炎、以及肺炎和肠穿孔等副作用,临床使用中治疗中止率高达50%,被FDA和EMA给予警告和调查,随后吉利德宣布终止后续开发计划,并在今年1月14日自愿撤回治疗FL和SLL的适应症,基本等于撤市;拜耳今年也撤回了其PI3K产品Copanlisib在欧盟用于治疗MZL的上市申请;Verastem的Duvelisib也具有与Idelalisib类似的副作用,曾经也收到FDA的黑框警告;同样,TG Therapetics 的Umbralisib也曾受到FDA调查,质疑其是否会增加患者死亡的风险,公司随后也停止了针对CLL和SLL的临床试验开发。
2022年1月,上市六年的PI3Kδ抑制剂idelalisib被吉利德撤出某些适应症市场;紧跟着,Incyte宣布撤回PI3Kδ抑制剂Parsaclisib的IND;再到3月,FDA打回MEI Pharma的zandelisib上市申请。
与前三个月的萧条相比,4月初,诺华宣布其PI3Kα抑制剂alpelisib(Piqray)因对PIK3CA相关的过度生长谱(PROS)的治疗有明显的益处而获得FDA加速批准,提振市场对PI3K抑制剂的信心。但是,Alpelisib,Copanlisib等对野生型PI3Kα没有选择性,导致葡萄糖代谢异常,存在严重高血压、高血糖等不良反应,患者剂量耐受性差,因此降低脱靶毒性将是下一代PI3Kα药物开发的关键,目前已有研发转向亚型特异性的PI3K抑制剂。前不久AACR上,礼来、Relay Therapeutics披露了其选择性PI3Kα H1047X抑制剂的临床前研究数据,发现其对野生型PI3Kα没有活性。
FDA专家咨询委员会投票
行业似乎要重新审视PI3K领域的机会与挑战。4月21-22日,FDA召开肿瘤药物专家咨询委员会(Oncologic Drugs Advisory Committee,ODAC)会议,就PI3K抑制剂在血癌领域未来的临床试验设计进行讨论投票,以讨论 PI3K 抑制剂的毒性问题,以及是否需要随机对照试验来支持该类药物在血液恶性肿瘤领域的批准。
结果是专家们以16票赞同vs0票反对,1票弃权,压倒性支持了随机对照试验的必要性,PI3K 抑制剂基于单臂试验获得加速批准的大门被关上。ODAC几乎是全员赞同,PI3K抑制剂的批准需要基于随机数据而不是单臂临床试验。此前已上市的四款PI3K抑制剂——吉利德的Zydelig、拜耳的 Aliqopa、Secura Bio的Copiktra和TG的Ukoniq——的血癌适应症均是基于单臂批准。诺华的Piqray用于乳腺癌和PROS治疗,暂不在讨论范围内。
投票是在对 PI3K 抑制剂生存和毒性问题进行了长达三个小时的激烈讨论之后进行的。FDA 列出了四种不同药物相关的批准历史,包括 Gilead Sciences 的 Zydelig (idelalisib),Bayer 的 copanlisib,Secura Bio 的 develisib 和 TG Therapeutics' Ukoniq (umbralisib),以及患者在临床试验期间经历的安全问题。
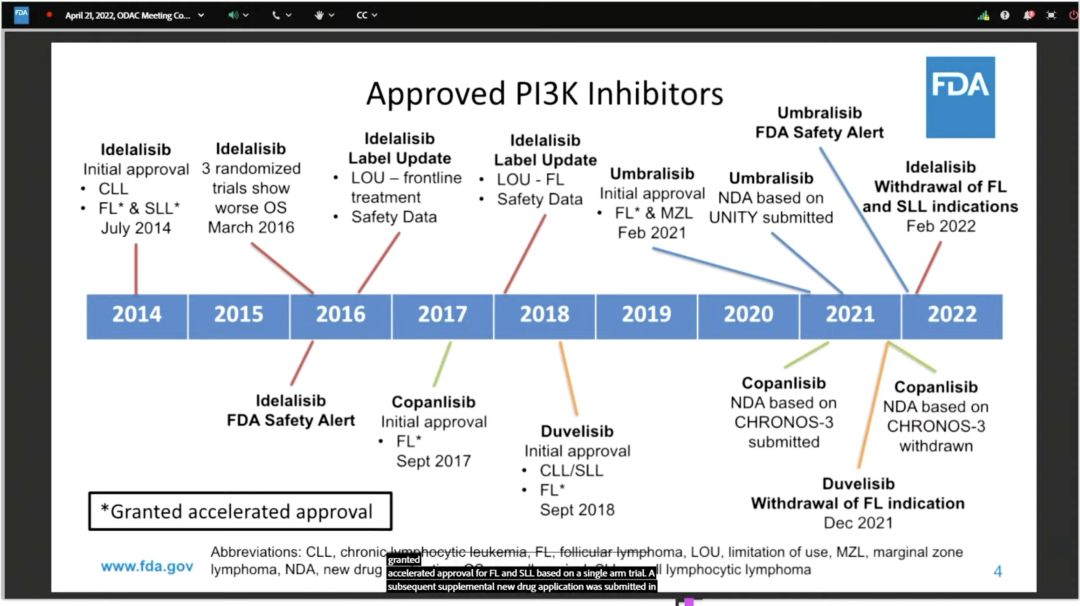
PI3Ks 调节多种细胞过程,包括细胞生长、增殖、分化、存活、迁移和代谢。然而,FDA 对此类药物更多地依赖单臂试验表示担忧。在这类药物的整个开发历史中,由于毒性问题,一些临床研究被终止,PI3K 抑制剂对接受治疗的血液瘤患者整体生存能力的影响值得思考。
PI3K抑制剂治疗时患者总体生存率(OS)
OS被认为是临床获益的客观衡量标准,是临床试验的最终终点。当研究可充分评估生存率时,OS通常为首选终点。然而在实际临床试验中,OS的评估限制颇多,试验人员不得不退而求其次,选择ORR和PFS等其它作为终点。
在上图列举出的PI3K抑制剂的随机试验中,表现出了较高的死亡率,或者OS结果表示,药物对患者存有潜在危害作用。而ORR和PFS数据,却展现药物的获益。
以Zydelig为例,其在2014年进行了一项双盲、安慰剂对照的随机试验,该试验对比了Zydelig+rituximab和安慰剂+rituximab的疗效。因为达到了PFS终点,Zydelig获得复发CLL适应症的批准。但随后,由于Zydelig组出现严重毒性增加和死亡率上升,三项评估Zydelig联合疗法的随机试验被叫停。
在PI3K抑制剂试验中,与安全性相关的OS分析通常都是描述性表述,只有1/6的PI3K抑制剂包括对OS的正式假设试验(Copiktra)。无论如何,对于以PFS为终点的随机对照试验,FDA现在要求提交OS数据。
PI3K抑制剂毒性问题
在多项评估PI3K抑制剂作为单药或与CD20抗体、化疗等联合使用的随机试验中,PI3K抑制剂表现出的毒性无法令人忽视。
在几乎所有的随机对照试验中,PI3K抑制剂组的致命不良事件(AEs)、严重不良事件(SAEs)、3级或更高级别的AE以及因AE而不得不调整试验或者中断试验的比率都显著增加。
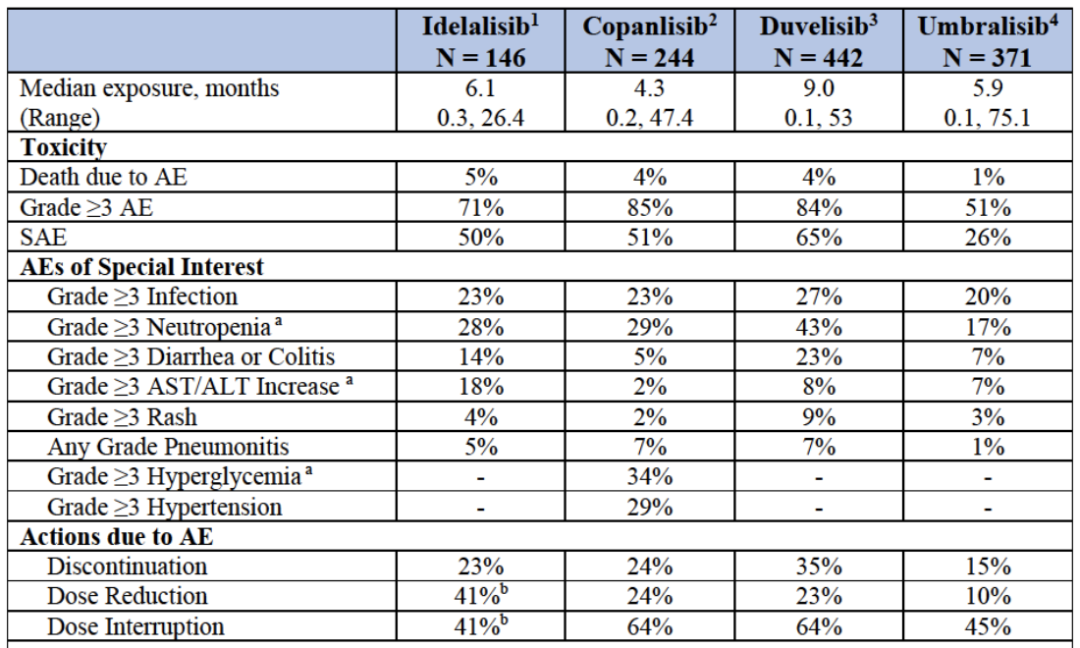
PI3K抑制剂作为单一疗法的毒性
尽管如此,在PI3K抑制剂的开发过程中,仍然未对患者报告的症状进行早期且全面的测量。为了降低风险,保证PI3K抑制剂在预期患者身上可以安全有效使用,PI3K抑制剂的获批通常伴随着一系列的黑框警告、注意事项和风险评估。
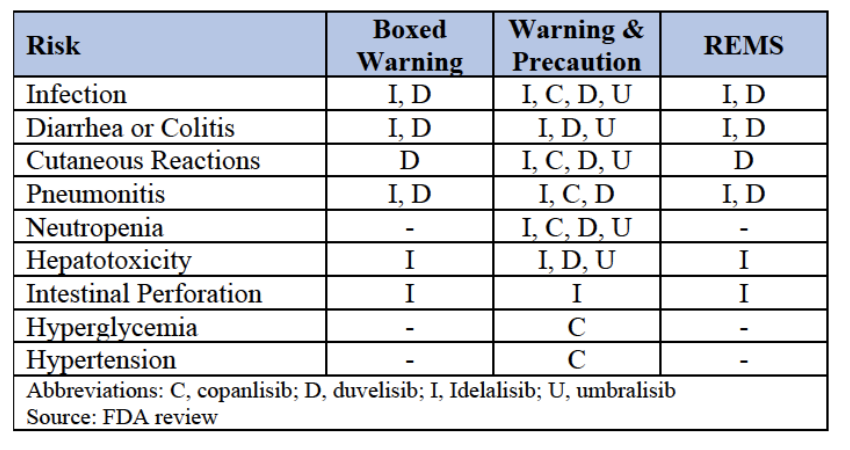 PI3K抑制剂的风险警告
PI3K抑制剂的风险警告
PI3K 抑制剂剂量问题
药物开发的早期就应该确定药物剂量。理想情况下,应当收集足够的信息来平衡最大功效和最小毒性,对于像PI3K抑制剂这种毒性和有效剂量分界线不明显的药物来说,这点尤为重要。
剂量优化需要收集到足够的药代动力学、药效学、安全性和活性数据等信息,PI3K抑制剂难以进行剂量优化的原因在于不容易确定最大耐受剂量(MTD)。MTD的确认是基于假设——能达到最大疗效的患者所能接受的最高剂量。
但是这种方法可能会错过对较低剂量的探索,不排除低剂量药物可带来疗效和低毒性的可能性。
除单臂试验外,FDA 还指出了有关已获批 PI3K 抑制剂的高剂量问题。他们认为,在药物开发中,研究者们没有有效地探索较低剂量水平下的疗效和安全性,以判断能否在保持疗效的同时降低毒性。
单臂试验对安全性评估,是否具有足够可信度?
FDA 血液系统恶性肿瘤部门主任 Nicole Gormley 表示,目前的安全性数据以及生存数据呈现出史无前例的一致性。所有药物确实在血液肿瘤患者中表现出了有效活性,但安全性问题为患者最终获益打上了问号。
Gormley 指出,在 PI3K 药物的单臂研究中收集的安全数据显示了不同类型的毒性和安全问题。PI3Kδ 和 PI3Kγ 选择性抑制剂与肺炎和免疫介导的毒性问题的增加有关,包括肝炎、肺炎、结肠炎和皮疹;而 PI3Kα 选择性抑制剂可导致高血糖和高血压。
单臂试验的局限性与改进策略
最初,FDA考虑来自单臂试验的数据,是为了支持患有严重和危及生命的疾病,同时有强烈未满足临床需求的患者的治疗。但单臂数据存在明显的固有局限性。
安全性评估问题是首要考虑的因素。在没有比较臂的情况下,观察到的副作用可归因于药物或潜在疾病,难以确定究竟是哪方因素导致。与此同时,单臂试验的随访期相对较短,因此评估长期安全性可信度有限。
其次,在于疗效评估。单臂数据的疗效评估是基于历史对照,或者是在一些不甚健康且具有已知局限性的人群中进行,反应率可能无法准确预测真实的临床获益率。FDA在简报中强调,单臂试验无法准确解释PFS和OS等与时间相关的临床终点数据。
对效益风险评估方面,在单臂试验中,难以平衡在目标人群中观察到的功效与毒性,难以真实评估风险-收益。
来自单臂试验的临床数据限制了对疗效和安全性的解释。而随机试验是控制混杂因素的最有效方法,因此是研究风险-收益的最佳方法。FDA认为,对治疗和对照的随机分配将为已知和未知因素提供公正的比较。
科罗拉多大学胃肠内科肿瘤学项目主任Christopher Lieu在ODAC会议中投了赞同票,他认为,如果治疗让患者暴露在毒性之下,在没有延长患者的生命长度基础上,反而降低患者的生活质量,这并不是真的帮助患者。
ODAC此次会议讨论的问题,仅限于PI3K抑制剂在血液系统恶性肿瘤方面的未来发展,同时,讨论的结果可以为PI3K抑制剂在其他领域的发展,提供思考的可能性。
唯一投弃权票的ODAC成员是杜克大学医学院副教授Anthony Sung,他认为未来无法预测,因此对可能会影响未来临床发展的事情保持沉默。
“如果未来开发的PI3K抑制剂拥有惊人的单臂数据,在那种情况下,我们还需要进行随机试验吗?”Sung问道。
FDA血癌部门主任Gormley回应说,加速药物开发,为患者提供新疗法是共有期盼,前提是,必须保证产品的安全性和有效性。单臂试验并不是获批的唯一途径。
在强调监管机构担忧的演讲中,FDA 血液学家和肿瘤学家 Nicholas Richardson 指出了单臂试验的局限性。他表示在单臂试验中很难平衡药物的功效和安全性,而随机试验才是首选方案,总体生存率是临床获益的客观衡量标准,只能在随机试验中进行评估。
唯一投出弃权票的是杜克大学医学院副教授 Anthony Sung。他同意 FDA 指出的 PI3K 抑制剂安全性确实存在问题,但他对决议的语言表示了担忧,认为有可能遏制未来该类药物加速批准治疗血液肿瘤的潜力,尤其如果将来诞生在单臂试验中表现出惊人数据的突破性药物,是否还需要随机试验?
对此,Gormley 表示,加速批准途径并不等同于单臂试验。随机试验可以为早期疗效终点和后期无进展生存期终点提供动力,从而加速批准。她强调,FDA 并不要求将 OS 作为主要终点,加速批准途径仍然可以基于随机对照试验进行。尽管 FDA 希望能够加快药物的开发,以尽快为患者提供新疗法,但前提是必须保证这些新药安全有效。
这次会议对中国研发和审批的影响
本次会议讨论的结果一定程度上折射出 FDA 的审评策略方向。目前国内 PI3K 抑制剂在研企业众多,34 个项目正在火热开发中。2021年2月,恒瑞医药与上海璎黎签订合作协议,以2000万美金的股权投资,引入上海璎黎的PI3K抑制剂Linperlisib(YY-20394),用于治疗所有人类与动物疾病,包括但不限于血液瘤和实体瘤。信达生物的从Incyte引进了IBI376(parsaclisib),正大天晴的TQ-B3525和和记黄埔的HMPL-689正在做关于FL的II期临床,此外,圣和药业的SHC014748M也在开展多项临床试验。总体来看,我国的PI3K市场竞争还不是很激烈,市场发挥空间还是很大的。
对于国内相关药企而言,FDA 此次会议的讨论和结果,一方面为后续的新药开发提供了参考和借鉴,另一方面在如今国内创新药出海大势之下,也可以使企业更敏锐、更全面地窥见 FDA 的审评考量。
梅斯医学小编相信,随着FDA越来越对单臂试验的收紧,中国CDE在相关临床试验方面,也会逐步趋紧。仅仅靠单臂临床试验获批上市,尤其是非first-in-class的产品,将越来越难。虽然,单臂临床试验在一定程度上加速了药品研发上市的进度,促进中国创新药的发展。短期内,在国内仍然可以用单臂试验,但是,随着时间推移,单臂临床试验会越来越被限制在一些罕见靶点,或罕见病的临床试验中。对于常规的靶点,或常规的肿瘤临床试验,单臂试验的空间会越来越小。
因此,相比PD-1这种热门产品,药企对于PI3K的态度表现谨慎。不过,鉴于其在疾病进展过程的重要性,无论是泛型的PI3K抑制剂还是各种亚型的PI3K抑制剂,都值得行业进一步探索。另外,在产品评估时,疗效固然重要,但是,安全性同样是需要全面考量的重要的方面。
内容来自网上多篇文章综合而成
参考资料:
https://mp.weixin.qq.com/s/_9-a0V2fH7kbArkWz1GqRQ
https://mp.weixin.qq.com/s/cBuQHL5YhlrJGuraJFDFfw
https://mp.weixin.qq.com/s/bglPlZ0yz4aTO6etokJKJg
Nat Rev Drug Discov:PI3K抑制剂即将迎来大爆发
Clin Cancer Res:PI3K/mTORC1/2双重抑制剂Gedatolisib联合卡铂和紫杉醇治疗晚期实体肿瘤
信达生物PI3Kδ抑制剂parsaclisib拟纳入突破性治疗品种
J Clin Oncol:PI3Kδ/CK1ε双重抑制剂Umbralisib用于治疗复发性/难治性惰性淋巴瘤
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#抑制剂#
118
#研发#
138
#PI3K#
0
学习了
154