Nature子刊:上海药物研究所徐华强等多团队合作揭示促卵泡激素及小分子激动剂识别和激活卵泡刺激素受体的药理学研究
2023-02-08 iNature iNature 发表于上海
研究人员通过对处于激活态和抑制态FSHR的结构解析,以及大量的细胞水平的突变实验,系统地揭示了FSHR有关激素激活、小分子结合的分子基础,并确定了FSHR差异性识别不同小分子的关键氨基酸位点。
促卵泡激素(follicle-stimulating hormone,FSH)是由垂体分泌的一种糖蛋白激素,能够作用于性腺(睾丸或卵巢)组织特定靶细胞上的卵泡刺激素受体(FSHR),从而调控卵泡的成熟和排卵,以及诱导精子的发生。FSH-FSHR信号稳态是人体生殖系统最重要的调控枢纽。此外,越来越多的证据表明,分布于性腺之外的FSHR的功能异常与阿尔茨海默症、骨质疏松症、肥胖症和癌症等密切相关。
在人体内,FSH与其他三种糖蛋白激素,包括促黄体生成素(luteinizing hormone,LH),绒毛膜促性腺激素(chorionic gonadotropin,CG),以及促甲状腺激素(thyroid-stimulating hormone, TSH),共同构成了糖蛋白激素亚家族并参与维持内分泌稳态。四种糖蛋白激素可作用于三种糖蛋白激素受体,除FSH作用于FSHR外,CG和LH可以共同作用于LHCGR,TSH则作用于TSHR。LHCGR和FSHR类似,主要在性腺高表达,共同参与调控人体性别发育、第二性征的维持以及生殖等。而TSHR则主要在甲状腺高表达,调控甲状腺的功能及人体代谢等。
临床上,FSH作为治疗药物广泛用于女性无排卵性不孕和体外辅助生殖技术以及男性性腺功能减退症等生殖系统疾病的治疗,但目前有关FSH是如何作用于FSHR从而激活受体的分子机制尚不清楚。FSHR作为研究治疗不孕症最重要的药物靶点之一,靶向该受体的小分子激动剂能够用于替代激素治疗,小分子拮抗剂则可能用于开发口服避孕药,然而,由于FSHR结构信息的缺乏、三种糖蛋白激素受体序列同源性高等原因,使得大部分现有小分子化合物的选择性较差,难以进入临床研究。因此,解析全长FSHR结构,并确定决定三种糖蛋白激素受体小分子特异性的关键氨基酸位点对于指导靶向FSHR以及其他两种糖蛋白激素受体的小分子药物研发意义重大。
2023年1月31日,中国科学院上海药物研究所徐华强研究员联合浙江大学张岩教授、北京协和医院张抒扬教授共同通讯在Nature Communications 杂志上发表了最新研究成果“Mechanism of hormone and allosteric agonist mediated activation of follicle stimulating hormone receptor”,首次解析了全长FSHR分别处于激素FSH和小分子激动剂Compound21f结合的激活状态结构以及小分子抑制剂结合下的抑制态结构。该项工作的主要亮点有:①首次揭示了FSH激活FSHR的分子机制,并证实了三种糖蛋白激素激活对应受体的通用保守激活机制;②揭示了小分子激动剂Compound21f与受体FSHR相互作用细节模式;③确定了决定FSHR受体差异性识别不同小分子化合物的关键氨基酸位点;④分析了FSHR天然点突变引发受体结构变化进而导致受体功能变化的可能原因。这些结果为临床靶向FSHR乃至整个糖蛋白激素受体家族开发用于治疗相关疾病的小分子药物提供了重要的结构依据。

研究人员通过加入外源激素FSH和小分子激动剂Compound21f使FSHR处于稳定的激活状态,通过加入小分子抑制剂Compound24使FSHR处于稳定的失活状态,从而利用单颗粒冷冻电镜技术进行结构重塑(图1a)。通过对获得的结构进行分析比较,发现处于失活态和激活态受体的胞外结构域构象变化最为显著,受体从失活态到激活态,其胞外结构域向上偏转了48˚,这表明FSH的结合主要通过引起受体胞外域的构象变化从而使受体激活(图1b)。进一步,研究人员分别比较了FSH与FSHR、TSH与TSHR以及CG与LHCGR结合的结构,以及三种受体处于失活状态的结构,发现三种受体均处于激活时的构象,或均处于失活时的构象十分相似,证实了糖蛋白激素激活对应受体时均遵循相同的激活机制。进一步,研究人员还发现三种受体激活信号从胞外向胞内传递的结构基础也是保守的。
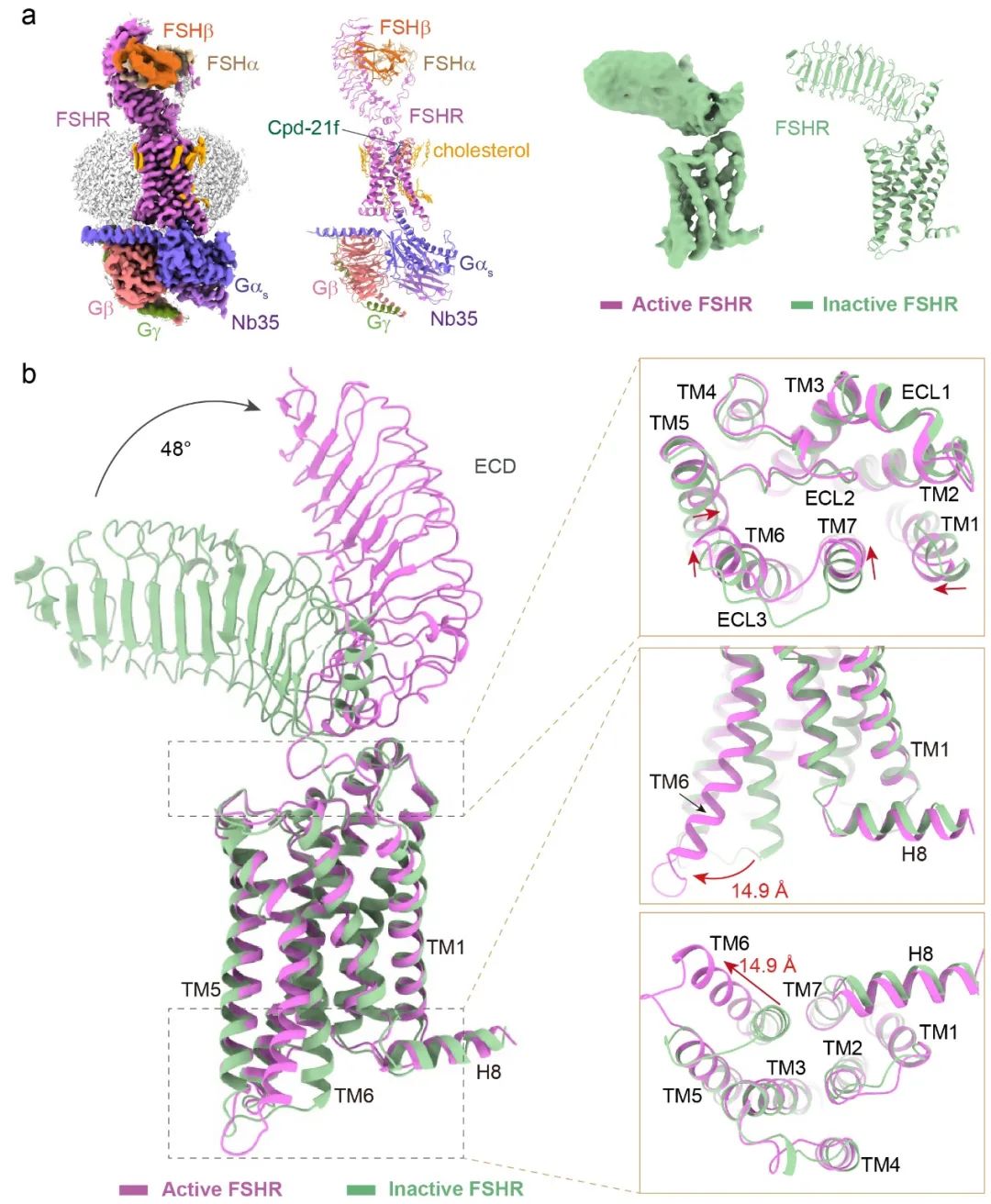
图1-FSHR冷冻电镜结构及失活态与激活态结构比较
分析小分子的结合口袋,研究人员发现三种受体的小分子结合口袋高度重叠,受体与小分子之间主要是疏水相互作用。通过对FSHR的小分子结合口袋的氨基酸位点进行分析,研究人员发现FSHR跨膜区(TMD)的TM5以及TM6上端与TSHR构象存在差异,且FSHR的小分子结合口袋上端为丙氨酸(A352),TM7上的组氨酸(H6157.42)和TM2上的异亮氨酸(I4112.53)与LHCGR和TSHR对应位置的氨基酸种类不同。进一步的突变实验发现,将FSHR的TM5/TM6上端突变为TSHR的氨基酸序列以及将FSHR的A352突变成TSHR的谷氨酸(Glu)并不能使特异性激活TSHR的小分子ML-109激活FSHR(图2a),而如果将FSHR的H6157.42 和I4112.53突变为TSHR上对应位置的氨基酸Y6677.42和 M4632.53,则会使ML-109也能够激活FSHR(图2b-c),与此一致的是,Compound21f对携带H6157.42Y突变的FSHR亲和力降低了大约4倍(图2d)。通过结合进一步的分子对接实验和结合能的计算,研究人员证实了FSHR的小分子结合口袋中的H6157.42决定了FSHR对不同小分子亲和力的差异性。
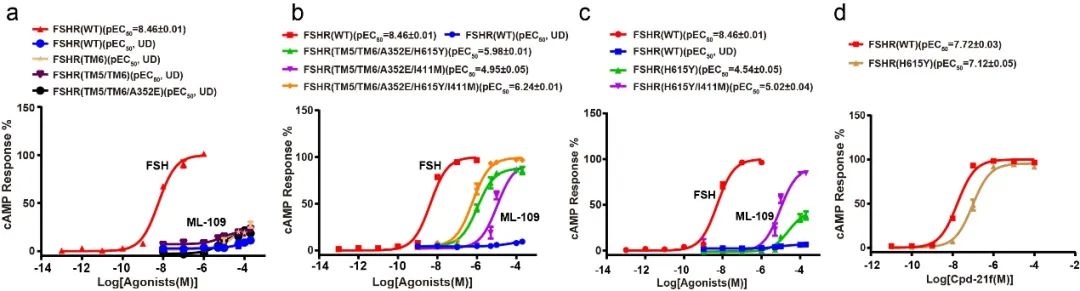
图2-激素FSH及小分子激动剂对野生型及突变体FSHR的浓度
综上,研究人员通过对处于激活态和抑制态FSHR的结构解析,以及大量的细胞水平的突变实验,系统地揭示了FSHR有关激素激活、小分子结合的分子基础,并确定了FSHR差异性识别不同小分子的关键氨基酸位点,为临床靶向FSHR乃至整个糖蛋白激素受体家族开发用于治疗相关疾病的小分子药物提供了重要的结构依据。
上海药物研究所段佳博士、徐沛雨博士(现为MIT博士后)、浙江大学张会冰博士以及清华大学栾晓东博士为本文共同第一作者。徐华强研究员、张岩教授、张抒扬教授为本文共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-023-36170-3
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









