PNAS:喧嚣背后,“逆天好病毒”离临床应用还有多远?
2014-10-20 佚名 果壳网
提起病毒,人们想到的可能是肆虐非洲的埃博拉、品种繁多的禽流感、久攻不克的艾滋病;除了传染病,病毒在一些肿瘤发生中也助纣为虐,例如乙肝病毒之于肝癌、HPV之于宫颈癌、EBV之于鼻咽癌。不过,病毒家族里也不全是“捣蛋分子”,有些科学家就琢磨着,能不能利用病毒来对付肿瘤?中山大学中山医学院颜光美团队在蚊子里分离出的一种病毒M1,就显示了出抑制肿瘤的潜力。论文10月6号发表在《美国国家科学院院刊》(P
提起病毒,人们想到的可能是肆虐非洲的埃博拉、品种繁多的禽流感、久攻不克的艾滋病;除了传染病,病毒在一些肿瘤发生中也助纣为虐,例如乙肝病毒之于肝癌、HPV之于宫颈癌、EBV之于鼻咽癌。不过,病毒家族里也不全是“捣蛋分子”,有些科学家就琢磨着,能不能利用病毒来对付肿瘤?中山大学中山医学院颜光美团队在蚊子里分离出的一种病毒M1,就显示了出抑制肿瘤的潜力。论文10月6号发表在《美国国家科学院院刊》(PNAS)上。
肿瘤是一群失控的细胞,分裂不受限制,生长迅速;而病毒又有快速复制的能力,用病毒对付肿瘤,可谓“以毒攻毒”。不过,要成为一枚成功的溶瘤病毒(oncolytic virus)可不简单:不仅要对肿瘤组织有杀伤能力,同时也不能对健康组织有毒副作用。溶瘤病毒在20世纪初已有报道,到20世纪60年代,溶瘤病毒的研究开始兴起,目前已有数十个临床试验进行当中。
M1病毒的抑瘤证据
新发现的M1病毒的表现如何呢?研究人员分别用体外培养细胞系、小鼠肿瘤模型以及肝癌和结肠癌的离体活组织培养进行了实验。
体外培养细胞系
研究人员检查了66种癌细胞系(下图中标记为T),发现在暴露于M1病毒48小时后,其中29种的存活率(viability)降低了至少30%。而正常细胞系(下图中标记为N)的存活率,在暴露于M1病毒96小时后也没什么变化——即使加大病毒量、延长暴露时间也影响不大。
 细胞存活率实验。一系列癌细胞系(T)暴露于M1病毒48小时,和正常细胞系(N)暴露于M1病毒96小时后,细胞的存活率情况。图片来源:研究论文
细胞存活率实验。一系列癌细胞系(T)暴露于M1病毒48小时,和正常细胞系(N)暴露于M1病毒96小时后,细胞的存活率情况。图片来源:研究论文
小鼠肿瘤模型
研究人员使用了三种小鼠肿瘤模型。在小鼠长出肿瘤后,研究人员分别向其注射病毒和空载体,观察肿瘤体积(下方深色曲线)和体重(上方浅色曲线)随时间的变化。图为其中一个小鼠肿瘤模型的结果:相比起注射空载体的对照组(黑色曲线),注射M1病毒的小鼠(红色曲线)的肿瘤体积增长较慢,说明M1 病毒对肿瘤生长有一定的抑制作用。与此同时,病毒组和对照组的小鼠的体重没有表现出明显差异。
 在一个小鼠肿瘤模型中,注射入M1病毒的小鼠与注射入空载体(Vehicle)的小鼠,肿瘤的生长情况(左纵轴)与体重情况(右纵轴)随时间的变化图。横轴,肿瘤接种后经历的天数。图片来源:研究论文
在一个小鼠肿瘤模型中,注射入M1病毒的小鼠与注射入空载体(Vehicle)的小鼠,肿瘤的生长情况(左纵轴)与体重情况(右纵轴)随时间的变化图。横轴,肿瘤接种后经历的天数。图片来源:研究论文
为了验证M1病毒对肿瘤细胞选择性的抑制作用,研究人员构建了带有两种异种移植肿瘤的小鼠,一种肿瘤细胞对M1敏感(Tumor_S),另一种(Tumor_R)则不受M1影响。在向这些小鼠注射M1病毒后,研究人员发现,在对M1敏感的肿瘤细胞所形成的肿瘤内,M1病毒的RNA水平很高,而另外一种对M1不敏感的肿瘤细胞里,病毒的RNA则很少,水平和脑、心脏、肾、肝等器官里差不多。这暗示着M1病毒只在对其敏感肿瘤细胞内活跃复制。
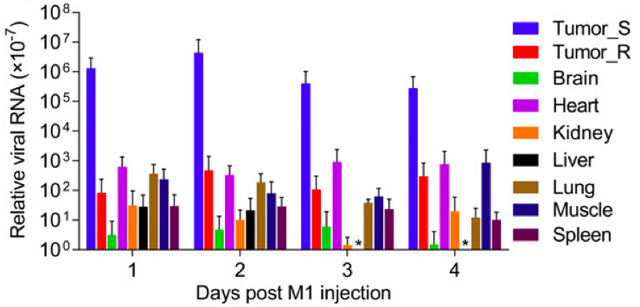 注射M1病毒后1至4天内病毒RNA在不同组织内的相对丰度。Tumor_S:对M1敏感的肿瘤细胞;Tumor_R:对M1不敏感的肿瘤细胞;Brain:脑;Heart:心脏;Kidney:肾脏;Liver:肝脏;Lung:肺;Muscle:肌肉;Spleen:脾脏。图片来源:研究论文
注射M1病毒后1至4天内病毒RNA在不同组织内的相对丰度。Tumor_S:对M1敏感的肿瘤细胞;Tumor_R:对M1不敏感的肿瘤细胞;Brain:脑;Heart:心脏;Kidney:肾脏;Liver:肝脏;Lung:肺;Muscle:肌肉;Spleen:脾脏。图片来源:研究论文
肝癌和结肠癌的离体活组织培养
随后,研究人员使用了离体的人体肝癌和结肠癌组织。研究结果显示,这些细胞在进行组织培养时一旦暴露于M1病毒,其存活率会降低。
M1病毒的抑瘤机制
那么,M1病毒是如何做到选择性地抑制肿瘤细胞的呢?研究人员发现,这和细胞内一种叫做ZAP的基因有关系。ZAP表达的蛋白质可以抑制M1病毒的复制,在健康细胞内ZAP高表达,病毒无从作乱;而在低表达ZAP的细胞里,病毒便大肆复制,造成内质网应激,细胞不堪重负,最终凋亡。
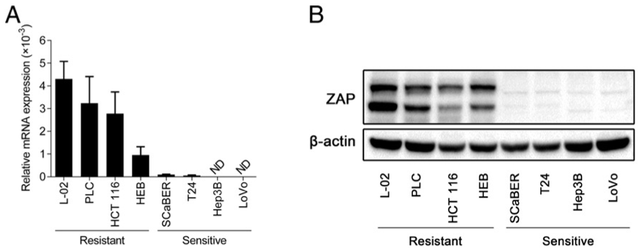 研究人员在RNA(图A)和蛋白质(图B)水平检查了8种癌细胞系里ZAP的表达情况,发现在其中4种对M1病毒敏感(Sensitive)的细胞系里ZAP都不被表达,而4种对M1不敏感(Resistant)的细胞系里,ZAP都表达。图片来源:研究论文
研究人员在RNA(图A)和蛋白质(图B)水平检查了8种癌细胞系里ZAP的表达情况,发现在其中4种对M1病毒敏感(Sensitive)的细胞系里ZAP都不被表达,而4种对M1不敏感(Resistant)的细胞系里,ZAP都表达。图片来源:研究论文
当然,只是表达水平的差异说明不了问题,为了证明M1病毒的抑瘤作用和ZAP表达的关系,基因的敲低(knock-down)和过表达(over expression)实验必不可少:研究人员发现,将那些对M1病毒不敏感的细胞系里的ZAP基因敲除掉,这些细胞就会变得对M1病毒敏感,病毒得以顺利复制,引发细胞凋亡;反之亦然,在本来对M1病毒敏感的细胞系里植入正常表达的ZAP基因,细胞会获得对M1病毒的抵抗力。
在体外细胞实验中,M1病毒对肿瘤细胞选择性的抑制作用依赖于细胞内ZAP的低表达,那么人类癌症里,ZAP的表达情况如何呢?研究人员检查了506例病人的肿瘤组织,发现69%的肝癌、52%的结肠癌、61%的膀胱癌的癌组织里ZAP的表达都低于癌旁组织,这暗示ZAP表达缺陷在人类癌症里可能较普遍,为M1病毒用于人体癌症的治疗提供了理论基础。
“逆天病毒”,离临床有多远?
颜光美团队在三种体系上进行的实验,都表明M1病毒具有抑制肿瘤的潜力。不过一些媒体的报道则过于夸张、缺乏严谨:“M1病毒能选择性地感染并杀死包括肝癌、结直肠癌、膀胱癌、黑色素瘤在内的多种癌细胞,而对正常细胞无毒副作用。整体动物模型证明, M1病毒‘像长了眼睛一样准确找到肿瘤组织并将其杀灭’,正常器官则不受影响。除细胞水平及动物实验之外,课题组还使用大量临床标本进一步证实了上述新型溶瘤病毒的有效性和特异性。”
其实,这里的“癌细胞”是指体外培养的细胞系,与人体内的癌细胞相差甚远;在癌细胞系里M1病毒会使细胞的存活率下降,并非完全“杀死”;而在小鼠的肿瘤模型里,M1病毒也并未将肿瘤组织“杀灭”,而只是减缓了里肿瘤体积的增长速度。这些结果表明,M1病毒在体外细胞系和动物模型上的确有一定的肿瘤抑制作用,但要证明其对人体内的肿瘤有效,以及改造病毒使其对肿瘤有更强的抑制作用,尚有很长的路要走。
一些报道中所谓的“使用大量临床标本”,其实是研究人员检查了506例病人的癌症组织里ZAP的表达情况,并未对人体直接进行M1病毒相关操作,也就无从谈“证实了上述新型溶瘤病毒的有效性和特异性”。M1病毒也不是对所有类型的癌症都起作用:研究者在文章里很清楚地表明,只有低表达ZAP基因的细胞才能被M1病毒抑制,研究人员检查了肝癌、结肠癌和膀胱癌等组织,发现多数ZAP基因低表达,不过也有相当一部分癌症组织里该基因未表现出低表达,更别提研究人员尚未检查过的其他种类的癌症了。鉴于现在的研究结果,这些媒体用“专杀癌细胞” 、“癌症克星”来形容M1,不免过分乐观和夸大。
不可否认的是,M1病毒具有重要的潜在价值,为癌症治疗领域带来了曙光。不过该研究尚处于基础科研阶段,转化到临床应用的道路艰辛漫长。在申请临床实验之前,还要完成大量临床前研究,例如对人体的安全性、改造病毒以及药物联用来增强溶瘤效应等。
在接下来的研究中,颜光美教授的团队会关注通过病毒改造以及药物联用的方式增强溶瘤效应,从而降低用药剂量,最大限度减少潜在的风险并降低用药成本。同时,他们也会加强选择性的机制研究,为未来的个体化治疗提供理论依据。
但目前,媒体的高度关注已影响到研究人员的正常科研秩序。面对公众过高的期望,“一是部分公众觉得‘溶瘤病毒’的概念闻所未闻,二是某些新媒体的夸张和断章取义的做法起到了推波助澜的作用。”研究者说,“我们所能保证的,是实验数据的真实和科研论文的严谨。但毕竟公众可能看不懂专业论文,科普的重任还有赖果壳网等科普网站。”媒体应该客观冷静地报导事实。
对于媒体上断章取义的报道,我们要甄别思考,不要盲信,就如研究者所说,“我们要有希望,但不可浮躁。所以恳请大家务必以客观严谨的态度对待这一发现,不要捧杀了一个有前景的课题和团队。”
原始出处
Lin Y1, Zhang H1, Liang J1, Li K1, Zhu W1, Fu L2, Wang F2, Zheng X3, Shi H3, Wu S1, Xiao X1, Chen L1, Tang L1, Yan M1, Yang X1, Tan Y1, Qiu P1, Huang Y1, Yin W4, Su X1, Hu H5, Hu J6, Yan G7.Identification and characterization of alphavirus M1 as a selective oncolytic virus targeting ZAP-defective human cancers.Proc Natl Acad Sci U S A. 2014 Oct 6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#临床应用#
52
#PNAS#
46
不错,科学严谨的态度就应该这样,
129