几种常见细胞治疗肿瘤技术:CART和NK细胞技术,其中taNK闪耀前景
2015-11-29 MedSci MedSci原创
免疫疗法是利用免疫系统来治疗疾病的一种概念:包括基于T细胞、B细胞及自然杀伤细胞(NK)等免疫细胞疗法。目前在CAR-T免疫疗法领域,除诺华及Juno外,其他跟进者包括Kite、基因治疗先驱蓝鸟生物(Bluebird bio)、生物技术巨头新基(Celgene),这些公司的细胞治疗技术皆是以T细胞为核心。一、CAR-T细胞CAR-T,全称是Chimeric Antigen Receptor T
免疫疗法是利用免疫系统来治疗疾病的一种概念:包括基于T细胞、B细胞及自然杀伤细胞(NK)等免疫细胞疗法。目前在CAR-T免疫疗法领域,除诺华及Juno外,其他跟进者包括Kite、基因治疗先驱蓝鸟生物(Bluebird bio)、生物技术巨头新基(Celgene),这些公司的细胞治疗技术皆是以T细胞为核心。
一、CAR-T细胞
CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。这是一个出现了很多年,但是近几年才被改良使用到临床上的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
第一代CAR介导的T细胞激活是通过CD3z链或FceRIg上的酪氨酸激活基序完成的。CD3z链能够提供T细胞激活、裂解靶细胞、调节IL-2分泌以及体内发挥抗肿瘤活性所需的信号。但第一代CAR改造T细胞的抗肿瘤活性在体内受到了限制,T细胞增殖减少最终导致T细胞的凋亡。第二代CAR在胞内增加了一个新的共刺激信号,实验证明,这使得原有的使源自TCR/CD3复合体的“信号1”扩大,许多研究都表明,搭载了“信号2”的第二代CAR与第一代CAR相比,抗原特异性不变,T细胞增殖、细胞因子分泌增加,抗细胞凋亡蛋白分泌增加,细胞死亡延迟。常用的共刺激分子为CD28, 但之后有研究将CD28用CD137(4-1BB)进行替换,除此之外,一种使用NK细胞受体CD244的思路也被提出来。虽然不同的第二代CAR究竟孰优孰劣,不同的研究者用不同的肿瘤在体内和体外的研究中得到的结果不尽相同;但与第一代CAR相比,这种设计能够增加对肿瘤细胞裂解的记忆效应以及CAR介导的杀伤效应。
为了进一步改良CAR的设计,许多研究组开始着眼于发展第三代CAR,不仅包括“信号1”、“信号2”,还包括了额外的共刺激信号。不同研究者们用不同的靶点和共刺激信号开展的研究所得到的第二代CAR和第三代CAR的比较结果存在一定的差异性。一些研究报道表达第三代CAR的重组T细胞在抗肿瘤活性、存活周期及细胞因子释放方面均显著提高;Wilkie等的研究结果显示靶向MUC1的第二代CAR与第三代CAR重组T细胞在抗肿瘤细胞毒性方面并无明显差异,虽然表达第三代CAR的T细胞能够分泌更大量的IFN-γ(Wilkie S, Picco G, Foster J, et al. Retargeting of human T cells to tumorassociated MUC1: the evolution of a chimeric antigen receptor. J Immunol 2008; 180: 4901–4909.)。值得注意的是,上述区别仅仅是体外实验中获得的结论,目前尚未在体内比较第二代和第三代CAR的报道。这两代CAR之间的差异可能不止来自于信号传导域,胞外的抗原结合域(scFv)、重组T细胞的转染方法(慢病毒VS逆转录病毒)、重组T细胞的回输方式(静脉回输VS腹膜VS瘤体)等均可能影响CAR-T细胞的最终抗肿瘤效果。
最近一例采用通用的CAR技术制备的CART成功救治一例复发性白血病成功,标志着CART技术由个性化制备向通用CART细胞治疗迈进。

二、NK细胞
全球知名医生陈颂雄创办的NantKwest也在今年上市。根据该公司官网的介绍:其主要以自然杀伤细胞(natural killer cell,NK)治疗为核心,拥有三大技术平台——aNK、haNK和taNK。众所周知,NK细胞不仅是机体重要的免疫细胞,不仅与抗肿瘤、 抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生。
aNK、haNK和taNK三大技术平台与当前备受追捧的CAR-T技术平台有何异同呢?
1、Activated Natural Killer "Off-The-Shelf" Cell:The aNK Cell

第一步:将aNK细胞绑定受体;第二步:激活颗粒酶;第三步:释放颗粒酶。
The aNK Cell是NantKwest的当家平台,也是后面两种平台的基础,,aNK(Activated Natural Killer)包括重要的“A-A-A”步骤,即Adhesion(粘附)——Activation(活化)——Apoptosis(凋亡)。
杀伤细胞抑制性受体在功能上类似于T细胞表面的程序性死亡受体1(PD-1),都可以抑制细胞信号通路,PD-1通路的配体为PD-L1,后者是肿瘤细胞的防身利器,CAR-T对实体瘤效果不佳,很大程度上就因为肿瘤细胞高表达的PD-L1抑制了T细胞活性。aNK不表达杀伤细胞抑制性受体( Killer Inhibitory Receptors,KIR),进而避免自己被靶细胞表面的主要组织相容性复合体(MHC)抑制活性。
aNK Cell经过敲除KIR的改造后,犹如多了一层“防护罩”,即使它进入了肿瘤浸润区域,也可以很轻松躲避肿瘤的抑制信号,保持满满的能量去消灭肿瘤细胞;而Juno、Bluebird的CAR-T倘若没有如此防护罩直接裸奔到肿瘤浸润区域,或将因PD-L1的存在而失去作战力。
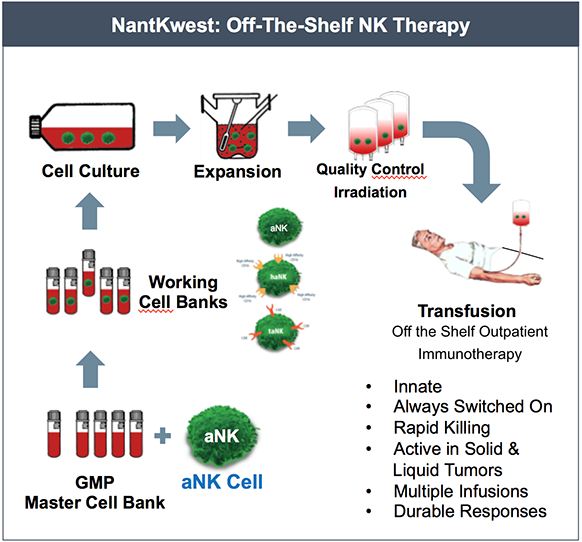
off-and-shelf 治疗标准操作流程
技术点评:由上图可见,独特的aNK 细胞平台(off-and-shelf 治疗)不同于一般的NK 细胞的独特之处在于不表达杀伤抑制受体(KIR)。而KIR恰恰是癌细胞经常利用用以逃避NK 细胞杀伤的受体;同时,aNK细胞还携带颗粒酶和含有穿孔颗粒的较大有效负载,从而使其能针对多靶点提供致死酶有效负荷。另外,公司的生产专利、递药系统保证了aNK细胞可以按需要商业化生长,就像“在袋子里的活药”。aNK细胞的安全性已经在几十个I期临床(针对恶黑和实体瘤)中得到验证,其安全性、活性和对生存期的延长已经证实。
2、Antibody Mediated Cell Killing by high-affinity Natural Killer cells:The haNK Cell
被高亲和性自然杀伤细胞杀死的抗体介导细胞(haNK)可以扩大aNK的应用范围,对接并提高那些对抗体依赖性的细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)发挥功能的抗体的疗效。
HaNK如何发挥自己作用的?

抗体发挥作用的一个重要机理是ADCC,即抗体依赖Fc(对免疫球蛋白Fc部分c末端的受体)同NK细胞的CD16结合招募并激活NK到肿瘤靶细胞处对肿瘤细胞进行清除,例如我们熟悉的重磅单抗药物——赫赛汀、美罗华都依靠ADCC发挥作用。
抗体就是士兵,而自然杀伤细胞(natural killer cell,NK)是武器(军火),赤手空拳的士兵很难在同肿瘤对抗中获胜。haNK cell通过改造表现的CD16,直接提升了对Fc的亲和力,即为赫赛汀、美罗华类的抗体打造了拿手武器。
因此haNK细胞是一种对抗肿瘤的通用“武器”,相同的haNK cell配合已上市的不同抗体药物联合使用,用于治疗不同的疾病。所以未来使用赫赛汀、美罗华时,医生或许会建议你带上haNK细胞,杀伤力更强。
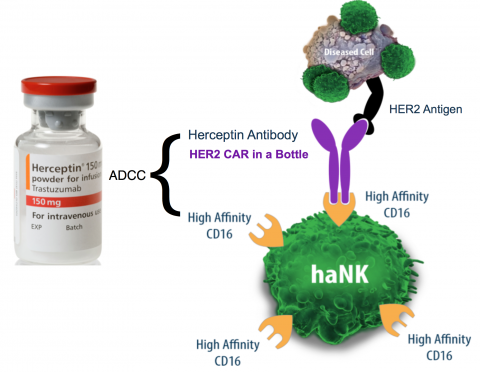
技术点评:haNK可提高CD16亲和力,若依赖T细胞的CAR-T若是对CD3进行改造,毅然也可增强自身对抗肿瘤的能力。
3、Target-Activated Natural Killer Cell:The taNK Cell

靶向活化自然杀伤细胞(taNK Cell)近乎模仿CAR-T的嵌合抗原受体(CAR)技术:通过嵌合在NK细胞表面的肿瘤特异性抗体,靶向识别并摧毁肿瘤细胞;不同的是,taNK敲除了KIR相当于拥有“防护罩”,CAR-T是“裸奔”。

taNK细胞在3秒内攻击HER2过度表达的转移性乳腺癌细胞
技术点评:aNK、haNK和taNK技术平台具有敲除抑制信号通路的概念,概念上较为领先CAR-T;不过相对于众多CAR-T来说,NK细胞治疗相对还是稀缺资源。由于传统的非特异性免疫治疗(NK、DC、CIK、DC-CIK)没有足够的临床数据证明其在延长癌症患者五年生存率方面有显著的改善,全球的研发基本也抛弃了这项起源于上世纪90年代的技术,转而侧重特异性免疫治疗(以T 细胞为核心,包括ACT、CAR-T、TCR 等)。但是随着基因编辑技术的发展和成熟,人类对NK细胞的改造或将在对抗癌细胞上具有更强的摧毁力。
当然,最近还在体内发现一种同时具有NK细胞和T细胞双重特性的细胞NKT,它对肿瘤具有更高特异性杀伤作用,在体内分布极少。不过未来有望也可以被改造成为重要的免疫治疗细胞之一。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#ART#
71
#cART#
91
比较好
153
马克
139
太新的技术了
188