上海交大章雪晴《ACS Nano》:靶向激活肝星状细胞的核酸纳米药物治疗非酒精性脂肪肝炎及相关肝纤维化
2023-08-01 BioMed科技 BioMed科技 发表于上海
该研究开发了一种基于脂质的靶向型核酸纳米递送载体,可以将小干扰RNA(siRNA)高效递送至激活的肝星状细胞中;所开发的核酸纳米药物在两种NASH小鼠模型中均可实现NASH及相关纤维化的有效改善。
随着肥胖症和2型糖尿病的流行,非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)的患病率逐年攀升,影响着全球约25%的人口。非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是NAFLD进展的关键步骤,以肝细胞脂肪变性和肝小叶炎症为病理特征,通常伴有肝纤维化,严重时可进展为肝硬化和肝细胞癌。尽管NASH已成为慢性肝病防治的重点领域,但目前还没有治疗NASH及相关肝纤维化的药物获批,存在巨大未被满足的临床和研究需求。
2023年7月25日,上海交通大学药学院章雪晴团队在ACS NANO上发表了题为“Nanoparticle-Mediated RNA Therapy Attenuates Nonalcoholic Steatohepatitis and Related Fibrosis by Targeting Activated Hepatic Stellate Cells”的研究论文。该研究开发了一种基于脂质的靶向型核酸纳米递送载体,可以将小干扰RNA(siRNA)高效递送至激活的肝星状细胞(activated hepatic stellate cells,aHSCs)中;所开发的核酸纳米药物在两种NASH小鼠模型中均可实现NASH及相关纤维化的有效改善。

NASH的病理机制十分复杂,肝星状细胞从静息态激活并转化为肌成纤维细胞是NASH及相关纤维化发生发展的核心环节。aHSCs主要介导细胞外基质中胶原的合成和促纤维化因子的分泌,驱动着NASH的许多关键病理,即肝纤维化、炎症和肝实质功能障碍。研究表明,白介素11(IL-11)是多种NASH刺激因子的共同下游细胞因子,与其受体(IL11ra1)结合后,通过ERK信号通路促进成肝星状细胞的激活和NASH的进展。
在该研究中,作者在HFCMCD和HFHC饲料诱导的两种NASH小鼠模型中均观察到肝星状细胞中IL-11和IL11ra1显著上调。免疫组化染色结果也显示出IL-11的表达与ACTA2(aHSCs的关键标记物)的表达存在高度相关性。这些结果与前期研究高度契合,均表明aHSCs中高表达的IL-11和IL11ra1为NASH治疗的潜在靶点。
包括siRNA在内的核酸疗法在各种疾病的治疗中具有巨大的潜能。目前,由于缺乏靶向肝外器官或特定细胞的核酸载体,siRNA药物的开发仍局限于基于GalNAc修饰介导的肝实质细胞靶向递送;而将siRNA安全有效地递送到体内的肝非实质细胞,尤其是aHSCs,仍存在着很大挑战。在这项工作中,研究团队研发的核酸纳米载体通过氨乙基茴香酰胺(AEAA)特异性结合aHSCs表面高表达的sigma-1受体,向aHSCs传递靶向IL11或IL11ra1的siRNA(siIL11@NP-AEAA或siIL11ra1@NP-AEAA),通过阻断IL-11信号通路抑制NASH的进程,从而修复受损的肝组织,进而恢复肝功能。
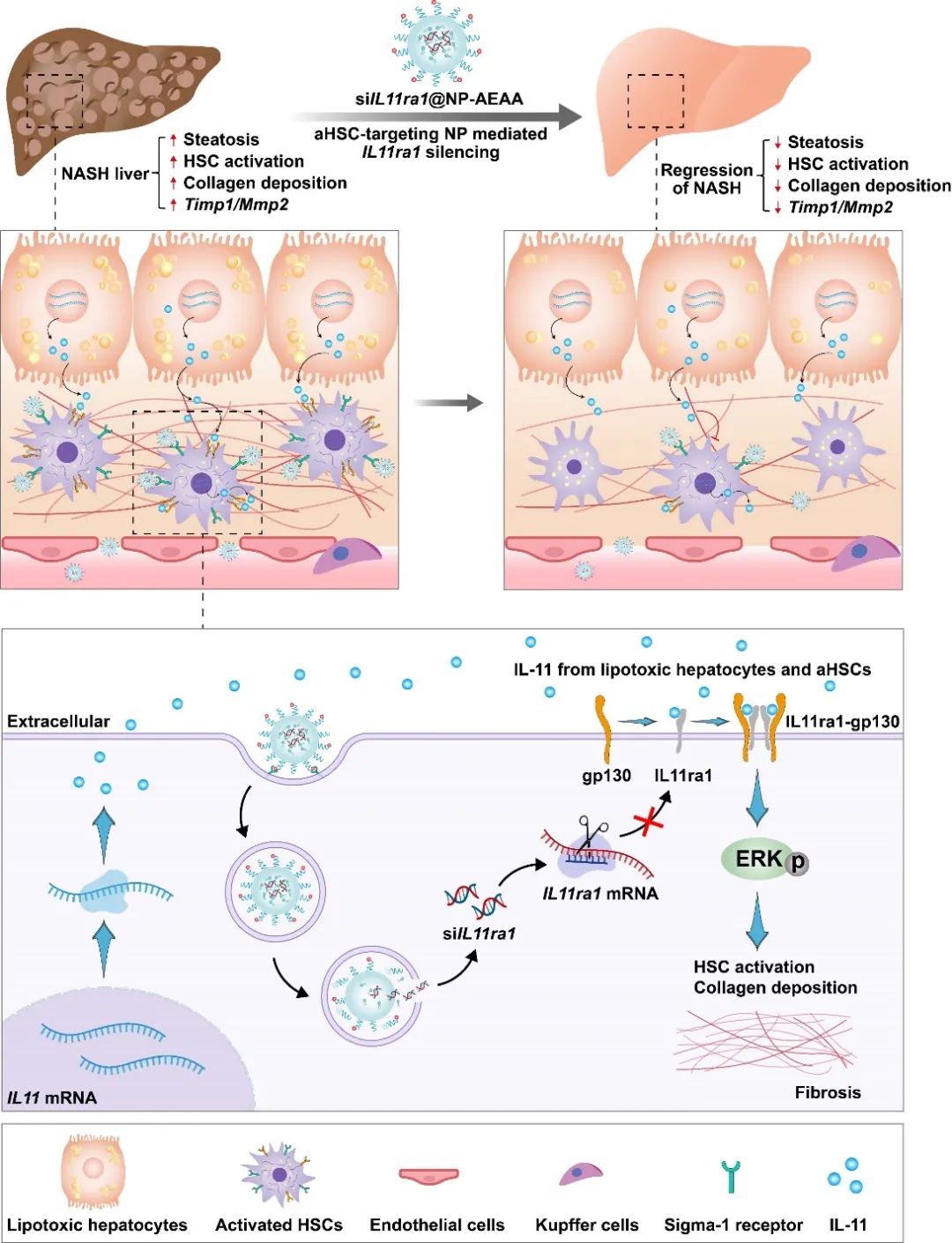
将siIL11ra1靶向递送到aHSCs治疗NASH及相关肝纤维化的示意图
在HFCMCD饲料诱导的小鼠NASH模型中,aHSCs靶向型核酸纳米药物主要富集于纤维化的肝脏组织,且与肝星状细胞共定位,递送效率明显优于非靶向纳米药物。在HFHC饲料诱导的小鼠NASH模型中,siIL11@NP-AEAA和siIL11ra1@NP-AEAA均能有效抑制肝星状细胞的激活和炎症因子的表达,显著降低肝内胶原纤维沉积和脂肪沉积。其中,siIL11ra1@NP-AEAA表现出更优异的NASH疗效,能够有效缓解肝脏脂肪变、逆转肝纤维化、并恢复肝功能至正常水平。该工作研发的aHSCs靶向型核酸纳米药物为NASH及多种诱因引起的肝纤维化的治疗提供了新的选择,具有临床转化潜能。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c03217
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言