Nature子刊:单细胞多组学揭示肝母细胞瘤的细胞可塑性和克隆进化
2024-06-08 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
这项研究结合了全基因组测序(WGS)和单细胞核多组学(RNA-seq和ATAC-seq)数据,旨在构建HB细胞群的遗传、转录及表观遗传演化进程。
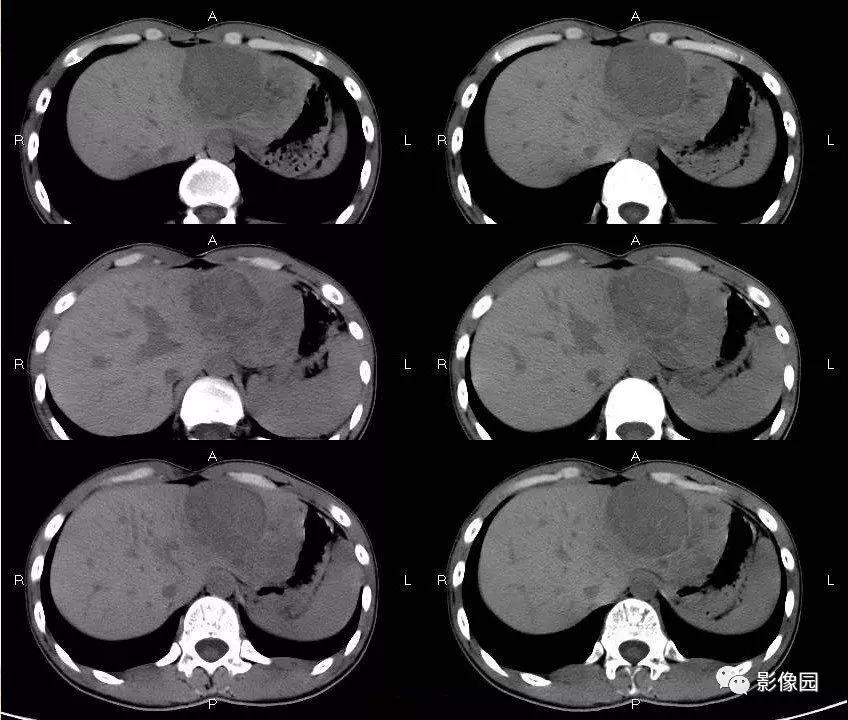
肝母细胞瘤(HB)是最常见的儿童肝脏肿瘤,约占儿童癌症的1%。在化疗和手术切除后,HB的五年生存率能接近80%。然而对化疗耐药的患者来说,由于没有其他有效的治疗手段,这些患者的预后非常不理想。HB可以大致被划分成三种常共存在同一肿瘤中的组织学亚型——胎儿型、胚胎型和间叶型,之前的转录组研究则确定了与这些组织学亚型相关的细胞群——高度分化的肝细胞(H)型,低分化高增殖的肝前体细胞(LP)型,和未分化的间叶(M)型。
过往研究结果显示这几种细胞亚群展示了显著的空间和纵向异质性,远超出在组织学水平上的异质性。这反映了肿瘤细胞改变其表型的能力,但HB细胞这种可塑性背后的分子机制还未可知。
近日,法国INSERM机构 Jessica Zucman-Rossi 和 Eric Letouzé 研究组在 Nature Communications 上发表了题为 Single-cell multiomics reveals the interplay of clonal evolution and cellular plasticity in hepatoblastoma 的文章,这项研究结合了全基因组测序(WGS)和单细胞核多组学(RNA-seq和ATAC-seq)数据,旨在构建HB细胞群的遗传、转录及表观遗传演化进程。

作者从Hirst等人在2021年发表的研究中选用了6份HB全转录组样本进行全基因组和单细胞核多组学测序分析,这6份样本涵盖了H、LP和M这三种已知的HB细胞亚型。作者首先用PCA对14448个肿瘤细胞的单细胞转录组进行降维分析,发现这些细胞间最大的差异在于三种细胞亚型的标记物表达。作者随后根据PCA结果,将HB肿瘤细胞划分为四种单细胞态——scH、scLP、scM和scH/LP,其中scH/LP表达H和LP亚型的标记物,提示了HB肿瘤细胞在LP和H两极中存在一系列中间状态。
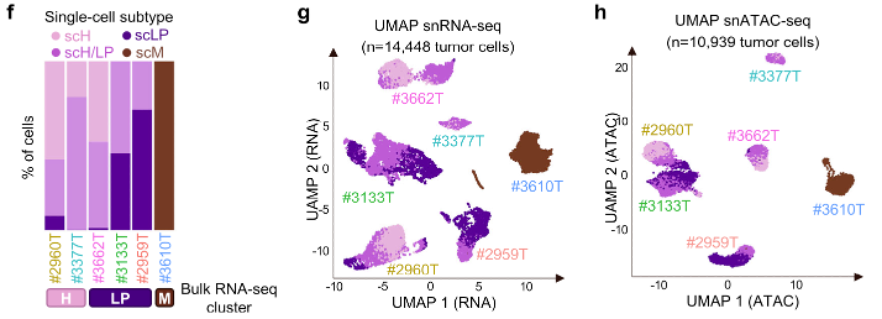
图1:肿瘤的细胞状态组成,以及单细胞核RNA-seq和ATAC-seq的UMAP分布图
作者接着用单细胞核ATAC-seq数据来探索HB细胞的染色质可及性,发现肿瘤细胞在11p15和14q32区域存在可及性增强峰,这些峰值具体定位在IGF2和DLK/MEG3等致癌基因附近。此外,共有57324个峰值在scH、scLP和scM几个细胞态之间显示染色质可及性差异,反映了每种细胞状态的多能性和向肝细胞分化倾向的不同水平。Motif富集分析表明,scM细胞中富集各种转录因子位点,包括核受体NR5A1、 ESR1,参与Wnt信号通路的LEF1,以及涉及胚胎发育的多个转录因子如TWIST1或ZIC2。相比之下,上皮HB细胞则富集肝脏分化转录因子HNF1A/4A的位点。
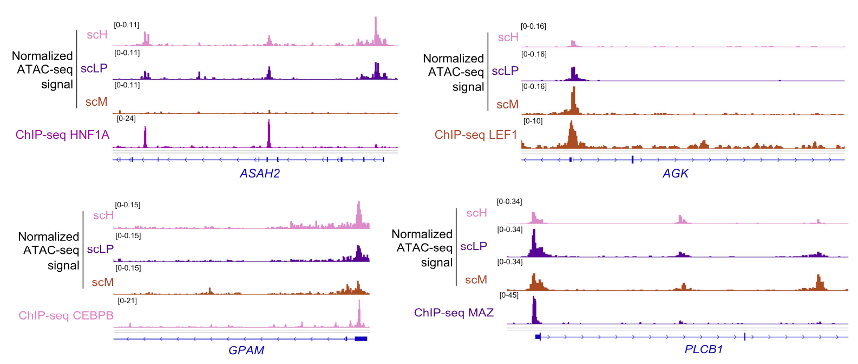
图2:ATAC-seq峰和ReMAP数据库中转录因子ChIP-seq峰的重叠
作者还分析了同时具有RNA-seq和ATAC-seq数据的共14448个HB细胞核,再加上100个HB样本的全转录组数据和ReMAP数据库中的ChIP-seq结果,总结出与HB细胞状态相关的四个关键转录因子-靶基因模块,即基因调控网络(GRN)。这四个GRN模块分别是scM模块(22个转录因子,2244个靶基因)、sc-epi模块(14个转录因子,2690个靶基因)、scH模块(14个转录因子,1647个靶基因)和scLP模块(11个转录因子,2038个靶基因),这些模块的命名都取决于其活跃转录因子和相关靶基因在四种HB细胞状态中的表达模式。此外,作者发现许多转录因子,像LHX1(scLP)、CEBPB/D(scH)会在LP- H分化谱的两端激活,而sc-epi模块的转录因子(HNF1A、GATA4、FOXA3、ONECUT1/2)在scH/LP细胞,即LP和H两极中间态的表达量达到最大化,说明GRN的逐步激活使得HB细胞在scLP和scH表型之间得以进行切换。
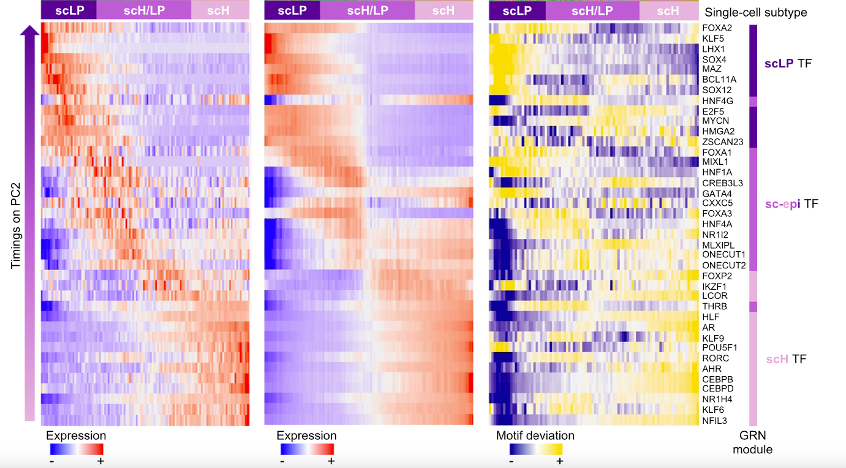
图3:单细胞核转录因子表达、靶基因平均表达量和motif富集量的热图
最后,作者结合HB的全基因组测序(WGS)数据来识别不同样本间共有的主干突变,以及特定样本独有的亚克隆突变,同时使用scReadCounts工具将这些突变投射到单细胞测序数据中。作者随后通过整合突变和拷贝数变异(CNA),重建了每个HB的单细胞克隆结构,并且比较了各种亚克隆的表型特征。所有亚克隆都显示出一定程度的转录组可塑性,但分化状态的广度以及向scH或scLP两端的倾向在不同亚克隆之间存在显著差异。最倾向于LP端的亚克隆对化疗具有抵抗力,并在新辅助治疗后增殖更快。
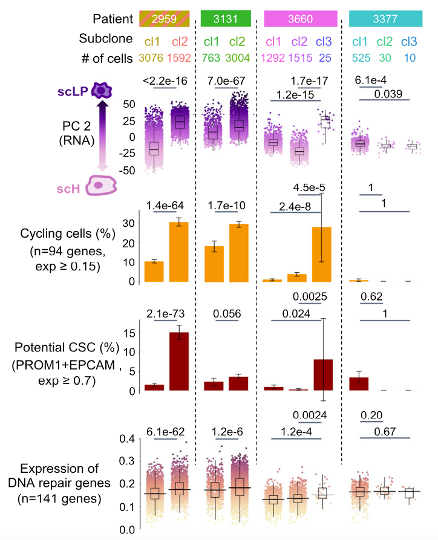
图4:各个亚克隆的表型总结
综上所述,作者使用单细胞多组学策略来揭示HB可塑性的分子决定因素,由此确定了HB细胞状态在scH、scLP和scM分化极之间的连续变化,还有每个分化极的基因调控网络,以及细胞状态转变背后的转录因子激活顺序。对体细胞改变的单细胞映射揭示了每个肿瘤的克隆结构,显示每个遗传亚克隆在分化状态中展现其独特的细胞可塑性范围。这些结果突显了克隆进化与表观遗传可塑性之间的相互作用,以及HB亚克隆类型对化疗反应可能的预示作用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肝母细胞瘤# #细胞可塑性# #单细胞多组学#
0