细胞内镜在溃疡性结肠炎中的应用进展
2023-01-19 消化界 消化界 发表于安徽省
如果采用人工智能相关技术整合细胞内镜下UC的病变特征,那么细胞内镜的实时诊断能力及效率可得到进一步提升。
【摘要】溃疡性结肠炎(UC)是一种缓解和复发交替出现的慢性非特异性炎性疾病。UC的治疗目标主要依靠内镜下评估黏膜愈合,而目前认为进一步达到组织学愈合有可能获得更好的长期疾病结局。细胞内镜作为一种新兴的内镜技术,可活体实时评估亚细胞结构,使无创评估组织学愈合水平成为可能。本文阐述细胞内镜在UC中的应用和进展,探讨采用细胞内镜进行UC的炎症评估及早期癌变识别的相关技术及研究前景,为UC诊治提供参考。
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性迁延、复发与缓解相交替的非特异性炎性疾病,目前对UC疾病活动度的评估主要依赖内镜下黏膜愈合。细胞内镜可以在组织学上提供详细的黏膜、血管结构及单细胞类型的识别,通过细胞内镜可以在无创水平上更好地评估黏膜愈合。本文探讨细胞内镜在UC中的应用进展,以供参考。
一、细胞内镜的演变及特点
第1代细胞内镜诞生于2003年,为导管式内镜放大附件,分为2种类型即XEC120U及XEC300F,分别能将内镜下结构放大至450倍和1125倍,但操作繁琐、耗时,无法广泛运用。2005年,第2代细胞内镜(GIF-Y0001)将放大附件与内镜合为一体,即在内镜下能够自由切换放大倍数(80倍或450倍),从而提高了内镜操作的便捷性。然而,固定的放大倍数并不能满足内镜医师对组织连贯性观察的需求[1]。2009年,第3代细胞内镜(GIF-Y0002)改用连续变焦的放大方式,实现放大操作的连贯性,方便内镜医师在内镜下定位病灶组织。2016年,第4代细胞内镜(GIF-Y0074/GIF-H290EC)问世。与第3代相比,第4代细胞内镜的放大倍数提高至500倍,直径缩小至9.7 mm[2],可在体内实时显示活细胞和肠道黏膜组织,无创识别黏膜中的单个炎症细胞,还能对黏膜隐窝结构及表面血管形态等进行亚细胞结构的评估[3]。各代细胞内镜详情见表1。
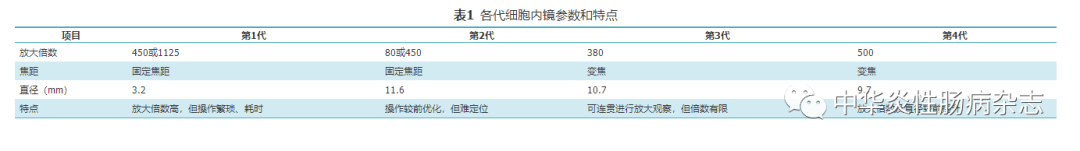
表1 各代细胞内镜参数和特点
二、细胞内镜在UC炎症评估中的作用
1.UC长期治疗目标—组织学愈合:目前大部分国内外指南及共识仍将内镜下黏膜愈合作为UC的治疗目标[4]。然而大量文献报道,许多内镜下黏膜愈合的患者仍存在持续的组织学炎症,持续的组织学活动性可能预示着较高的疾病复发率[3,5,6,7,8,9]。基于以上观察,2014年国际炎症性肠病组织提出组织学愈合的概念,并定义为隐窝和固有层未见中性粒细胞,基底未见浆细胞,理想情况下固有层浆细胞数量减少至正常及固有层嗜酸性粒细胞数量正常[10,11]。2021年欧洲克罗恩和结肠炎组织提出立场声明,当患者达到症状和黏膜愈合的治疗目标后,进一步达到组织学愈合有可能使患者获得更好的长期疾病缓解,并将组织学愈合纳入UC治疗目标[12]。细胞内镜作为可在体内实时显示活细胞和肠道黏膜组织的新兴内镜技术,可进一步对黏膜愈合UC的肠黏膜亚细胞结构进行观察,为评估组织学愈合提供参考,以实现对缓解期UC更加详细、精准的监测,并为UC预后评估提供更加完善的信息。
2.细胞内镜在UC炎症评估中的成效:随着细胞内镜技术的推广,近年来许多学者提出了多种针对缓解期UC的细胞内镜下评估的实践方法。Neumann等[13]利用细胞内镜分析40例IBD患者肠黏膜炎症细胞的浸润,结果显示细胞内镜观察下的局部炎症细胞浸润与活检组织病理学观察结果高度一致,并且细胞内镜还可用于区分不同的组织病理学特征。对比其他内镜检查,细胞内镜可提供更加细致的亚细胞结构信息,并与组织病理学特征一致,这使得细胞内镜在缓解期UC患者的内镜检查中具有独特优势。Maeda等[14]最早报道应用细胞内镜结合窄带成像技术,对Mayo内镜评分0或1分的临床缓解期UC患者直肠黏膜毛细血管的可见性及扭曲程度进行评分,发现细胞内镜下黏膜毛细血管评分对局部组织学炎症的诊断效率优于Mayo评分。该团队后续进一步整合了直肠黏膜毛细血管分布、黏膜隐窝形态等指标,设计了黏膜内毛细血管-隐窝评分(intramucosal capillary/crypt index,ICC index),并验证了该评分对局部炎症的诊断敏感性高于Mayo评分;其中,在Mayo内镜评分=1分的UC患者中,较高的ICC评分可预示UC临床复发风险[15]。上述研究指出,应用细胞内镜能更加准确地识别UC早期炎症并预测疾病,对临床缓解期患者的疾病监测具有重要价值。Ueda等[16]根据UC患者直肠黏膜隐窝结构(形状、分布、数量)的改变,提出细胞内镜下黏膜隐窝4级分级系统,发现该分级系统与Mayo内镜评分具有相关性,且分级较高的UC患者具有更高的复发风险,进而指出细胞内镜下单独的黏膜隐窝的评估同样可以提示UC预后。Nakazato等[9]应用细胞内镜结合镜下1%亚甲基蓝溶液染色,对内镜愈合的UC患者(Mayo内镜评分=0分)依据细胞内镜下的不同观察特性制定了细胞内镜评分系统(endocytoscopy system score,ECSS),纳入3个参数即隐窝的形状、相邻隐窝的间距及浅表微血管的可见性,验证了ECSS评分与组织学病理评分(Geboes评分)显著相关,且具有较高的准确性,从而指出ECSS评分系统可代替病理活检,用于缓解期UC的评估。Iacucci等[17]进一步验证了ECSS与Robarts病理评分和Nancy病理评分具有显著相关性,而Mayo内镜评分与ECSS及病理评分无显著相关。有趣的是,该研究还发现ECSS与多种黏膜愈合相关分子局部表达水平存在相关性,如可溶性血管黏附分子1(sVCAM-1)、2型肿瘤坏死因子受体(TNFR2)、白细胞介素1受体拮抗剂(IL-1ra),这从分子角度验证了应用细胞内镜评估UC愈合的有效性。除了对黏膜结构的观察外,Takishima等[18]纳入临床缓解期(Mayo内镜评分=0分)的UC患者,通过细胞内镜观察到黏膜杯状细胞数量的改变,且杯状细胞的减少与活检病理观察一致;在随访中,黏膜杯状细胞数量减少可提示较高的复发风险。这一研究将细胞内镜下表现、组织病理改变、黏膜功能异常多方面联系起来,为细胞内镜在UC疾病管理中的应用提供了新的角度[19]。
上述研究提出了多种切实可行的细胞内镜下评估UC愈合方法,并结合组织病理表现、细胞改变、分子表达变化分析,通过在细胞内镜基础上设立相关细胞内镜评分包括黏膜内毛细血管-隐窝评分(ICC index)、黏膜隐窝4级分级、细胞内镜评分系统(ECSS),将内镜评分与活检组织病理学、Mayo评分、组织学病理评分(Geboes评分、Robarts评分和Nancy评分)进行比较,结果均提示内镜评分系统与病理评分一致性良好,说明细胞内镜对UC的诊断、预测复发、指导治疗及判断预后具有重要意义。
目前在治疗UC时,生物制剂的选择完全依赖医师的临床经验,临床上缺乏对生物制剂的疗效评估及预测指标。通过细胞内镜下分子靶向标记的方法在活细胞和肠道黏膜组织明确靶向细胞分子的表达,可作为指导不同生物制剂选择及精准治疗的基础,这使得针对UC的靶向精准治疗成为可能。
3.国内初步实践成果:目前国内细胞内镜检查的应用及推广尚处于初步阶段。虽然国外指南陆续提出UC进行细胞内镜检查的可行性[10,11,12],但由于细胞内镜结果判读技术较为复杂,国内尚未能进行广泛推广及应用。中山大学附属第六医院消化内镜中心应用第4代细胞内镜技术,已进行了100余例UC患者的诊疗随访。在细胞内镜实践中,我们发现,应用第4代细胞内镜可观察评估UC患者肠道黏膜的中性粒细胞浸润及其他病变(图1)。通过收集并分析各级Mayo内镜评分下的UC患者检查节段、镜下染色、隐窝开口形态、相邻隐窝间距离以及炎性细胞浸润数据,再加上与活检病理Geboes评分的对接分析,我中心建立了一套简便有效的细胞内镜UC评分标准,实现了较好的病理评分一致性。

图1 溃疡性结肠炎在细胞内镜及白光内镜下肠道表现 A:黏膜内中性粒细胞浸润;B:腺管内淋巴细胞浸润;C:腺管间间隙增宽;D:腺管开口消失
三、细胞内镜在UC癌变评估中的作用
结直肠癌是一种常见的UC长期并发症。UC患者的结直肠癌发病率为4.7/1000人年[20]。随着时间的推移,UC患者在诊断10年左右癌变风险开始增加。UC确诊10年、20年及20年以后发生结直肠癌的累积风险分别为1%、2%和5%[21]。
目前UC癌变早期筛查的主要手段包括血清学检查、大便检查、肛门指检及肠镜检查。其中血清学检查、大便检查的特异性及敏感性均不理想;肛门指检虽然是发现结直肠癌一种较为简便、有效的方式,但其特异性差,且受癌变位置影响。因此,定期对UC患者进行内镜筛查仍是早期发现及干预结直肠癌的必要手段[22]。由于UC患者在监测过程中通常面临多次肠镜评估,且UC相关癌变多为平坦型,与周围组织分界往往不明显,普通内镜下与非肿瘤病变鉴别存在困难,其确诊依赖于随机病理活检。但多点活检筛查癌变存在发生出血、穿孔等并发症的风险,且大量消耗医疗资源,故对UC早癌的诊断需要精准判断病变性质、浸润深度,以便进行准确的医疗决策。随着内镜技术的发展,细胞内镜的出现使无创完成病理检查成为可能,其能发现细胞及细胞核的异型性,可实现在单次检查中即时"光学活检"。
既往研究者回顾性分析细胞内镜观察下结直肠癌的诊断要点,其中管腔表面形态、管腔扩张、黏膜腺管形态及分布、细胞分布特征、细胞大小及形态、细胞核形态及大小、细胞核/细胞质比例等是判断有无异常增生的重要指标,基于这些指标的诊断结果与活检病理诊断一致,且对于后续诊疗手段的选择有参考价值[23]。另有研究表明,细胞内镜下黏膜隐窝形态改变是结直肠癌的早期特征性改变[24]。以上标准可能适用于UC患者的结直肠癌筛查,但其可行性仍有待验证。有研究指出,细胞内镜能在组织学水平上判断细胞及细胞核、分析Pit分型,相较于普通内镜具有更好识别早癌的能力[25]。目前细胞内镜下如何判断UC相关结直肠癌尚无明确指南及共识定论。
因此,推广细胞内镜下UC患者的早癌筛查,开展该领域细胞内镜与病理组织学观察的临床研究,将有助于完善细胞内镜用于肠道早癌筛查的诊疗标准,并提高UC结直肠癌早期筛查效率。
四、展望与未来
细胞内镜经过4代革新及改进后,已成为新一代超高倍放大内镜系统,可以对病变部位的亚细胞结构进行评估及诊断。在UC的炎症评估及早癌监测中,细胞内镜有望实现对病变进行近似于病理诊断的活体实时评估,提高UC临床诊治效率。既往实践及研究证实细胞内镜可用于观察UC黏膜结构、细胞分布等多个方面的特征,验证了其在评估UC组织病理改变、疾病行为方面的重要作用。
虽然细胞内镜在提供实时病理诊断方面具有优势,但由于其放大倍数提高,导致内镜医生需进行更加细致的定点观察,因此细胞内镜的检查时间较普通内镜时间明显延长[26]。细胞内镜在UC诊疗中的应用尚无统一标准,故建立更加细致完善的细胞内镜下UC组织学愈合评估标准是非常必要的。目前关于细胞内镜的研究大多为单中心、回顾性研究,且样本量少,仍需要多中心、前瞻性研究来进一步指导细胞内镜在UC领域中应用。另外,应用细胞内镜进行细胞及病理结构水平的判读有赖于操作者的病理学知识,这使得部分经验尚不丰富的内镜医师运用细胞内镜进行实时组织学诊断存在困难,需要更加细致的病理学知识培训及经验指导。这也是目前细胞内镜在各基层医院开展受限的原因。
未来结合窄带成像系统、内镜下染色、分子成像内镜、激光共聚焦显微内镜等技术,可进一步实现对UC组织结构、细胞、分子多层次的观察,可能有助于发现更多具有特异性的细胞内镜下UC病变特征,完善并拓展细胞内镜在UC诊断中的应用。有研究者尝试通过分子成像内镜标记生物制剂相关分子靶点[27],结合该技术,细胞内镜也具备评估UC相关药物疗效的潜力。近年来研究者尝试将深层神经网络技术应用于UC的内镜评估中,并取得了较好的病理组织学一致性[28],但目前暂无该项技术用于细胞内镜诊断的报道。如果采用人工智能相关技术整合细胞内镜下UC的病变特征,那么细胞内镜的实时诊断能力及效率可得到进一步提升。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












学习
69