Nat Cell Biol:控制休眠癌细胞,可能成为肿瘤治疗关键
2017-01-31 MedSci MedSci原创
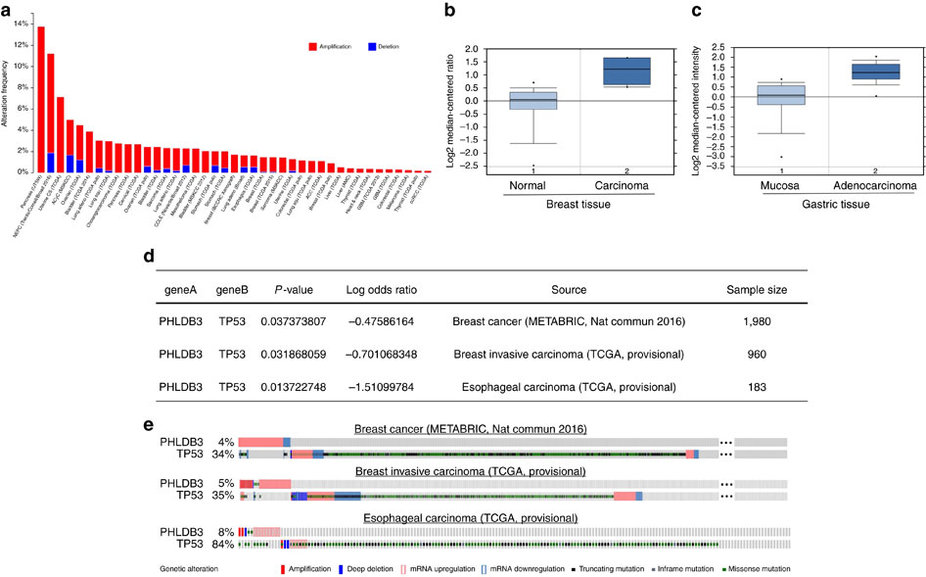
科学家们通过控制原发肿瘤细胞周围环境,首次发现了迁移癌细胞在扩散后进入休眠状态并逃避化疗。这篇在纽约西奈山医学院领导下完成的研究论文发表在《自然细胞生物学》杂志上。研究人员认为,这项研究工作可能会导致能够改变大部分转移性癌症目前尚未治愈的现状,开发出全新的治疗药物和方法。大多数癌症死亡的原因是癌症转移——这个疾病阶段开始于癌细胞从原发肿瘤逃逸,通过血液或淋巴系统发生迁移,并在身体其他部位发生继
大多数癌症死亡的原因是癌症转移——这个疾病阶段开始于癌细胞从原发肿瘤逃逸,通过血液或淋巴系统发生迁移,并在身体其他部位发生继发性肿瘤。继发性或转移性肿瘤与原发肿瘤是同一类型的肿瘤。当对转移性癌细胞进行检测时发现,它们具有与原发癌相匹配的特征,而非继发性肿瘤形成的组织。如果找到阻止癌细胞得以迁移、发生和发展成为继发性肿瘤的方法,可以挽救许多生命。
癌细胞在肿瘤形成非常早期的时候,就离开原发病灶,到其他组织器官独立安营扎寨了。他们还发现,在肿瘤形成早期就扩散出去的癌细胞,它在转移灶的定殖能力比肿瘤形成后散播出去的癌细胞更强。这简直颠覆了我们一贯以来对肿瘤转移的认识。但是,如何识别这些隐身的、休眠状态的逃逸出去的肿瘤细胞,是世界级难题。
休眠癌细胞对化疗“隐形”
已知细胞缺氧是实体肿瘤诱发应激反应并诱导抵抗化疗和放疗的一个标志。
然而,到目前为止,还不清楚原发肿瘤的细胞缺氧是如何影响癌细胞迁移到新的部位,以及是如何影响疾病预后的。
新的研究表明,原发肿瘤的低氧微环境会引起生成潜伏性播散性肿瘤细胞(DTCs),对治疗无反应,可能成为癌症复发及其预后较差的原因之一。
Julio A. Aguirre-Ghiso 博士说:“这项研究强调原发肿瘤指示播散性癌细胞处于休眠状态的信号标志。必须靶向作用于休眠细胞以解决全谱癌症并有效攻击癌症”。
在生物传感器、纳米技术和先进成像技术的帮助下,该研究小组在小鼠乳腺肿瘤中植入了产生低氧和非缺氧生态位的药物并观察其对细胞的影响。
他们发现,缺氧的肿瘤微环境不仅生成能够快速生长和扩散的潜伏性播散性肿瘤细胞(DTCs),还能够使其中很大一部分癌细胞进入休眠状态,使它们能够更好地逃避化疗。
因此,该研究表明,与缺氧肿瘤相关的不良预后不仅仅是因为它们产生更具侵袭性的癌细胞,也因为它们使得许多癌细胞程序性进入休眠状态,从而躲避化疗。
研究人员还发现,原发肿瘤的基因与继发肿瘤的休眠行为、抗治疗细胞相关。
他们认为这些基因可以作为生物标志物的基础用来预测哪些患者可能有更多的休眠耐药细胞。
Aguirre Ghiso 教授总结道:“我们希望这项研究使得原发肿瘤的休眠标记物得以应用以评估在次级器官中播散性癌细胞的患病率,由此制定出消除这些休眠和逃避治疗癌细胞的个性化治疗方案。”
去年底Aguirre Ghiso 教授在Nature上同一期发表两篇研究论文,发现乳腺癌中早期转移时休眠的癌细胞,详细见:两篇Nature:癌症在原发肿瘤形成前即可扩散和转移
Aguirre Ghiso 教授实验室链接:http://labs.icahn.mssm.edu/aguirre-ghisolab/
原始出处:
Fluegen G, Avivar-Valderas A, Wang Y, Padgen MR, Williams JK, Nobre AR, Calvo V, Cheung JF, Bravo-Cordero JJ, Entenberg D, Castracane J, Verkhusha V, Keely PJ, Condeelis J, Aguirre-Ghiso JA. Phenotypic heterogeneity of disseminated tumour cells is preset by primary tumour hypoxic microenvironments. Nat Cell Biol. 2017 Jan 23. doi: 10.1038/ncb3465.
Hosseini H, Obradović MM, Hoffmann M, Harper KL, Sosa MS, Werner-Klein M, Nanduri LK, Werno C, Ehrl C, Maneck M, Patwary N, Haunschild G, Gužvić M, Reimelt C, Grauvogl M, Eichner N, Weber F, Hartkopf AD, Taran FA, Brucker SY, Fehm T, Rack B, Buchholz S, Spang R, Meister G, Aguirre-Ghiso JA, Klein CA. Early dissemination seeds metastasis in breast cancer. Nature. 2016 Dec 14. doi: 10.1038/nature20785.
Harper KL, Sosa MS, Entenberg D, Hosseini H, Cheung JF, Nobre R, Avivar-Valderas A, Nagi C, Girnius N, Davis RJ, Farias EF, Condeelis J, Klein CA, Aguirre-Ghiso JA. Mechanism of early dissemination and metastasis in Her2+ mammary cancer. Nature. 2016 Dec 14. doi: 10.1038/nature20609.
Sosa MS, Parikh F, Maia AG, Estrada Y, Bosch A, Bragado P, Ekpin E, George A, Zheng Y, Lam HM, Morrissey C, Chung CY, Farias EF, Bernstein E, Aguirre-Ghiso JA. NR2F1 controls tumour cell dormancy via SOX9- and RARβ-driven quiescence programmes. Nat Commun. 2015 Jan 30;6:6170. doi: 10.1038/ncomms7170.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#Biol#
64
#Nat#
94
#CEL#
97
#休眠#
105
#Bio#
64
#Cell#
91
非常好的进展
99
这是一个全新的观念,特别好
143
最新科学进展
130
继续学习中
151