Ageing Res Rev 华中科技大学同济医学院附属同济医院陈琛、汪道文教授团队发表心力衰竭中蛋白质翻译后修饰研究进展的综述
2024-08-28 论道心血管 论道心血管 发表于上海
系统性总结了PTMs在心脏不同类型细胞中相互作用的分子机制,分别阐述了射血分数降低心力衰竭及射血分数保留心力衰竭的机制差异,并从临床转化的角度进行了详细评估。
心力衰竭是多种心血管疾病的终末状态,即使严格遵循指南制定的药物治疗,其预后仍然较差。心脏是由多种不同类型细胞组成的异质性器官,异常的信号通路造成细胞内稳态失衡,最终导致心脏的结构和功能失调。蛋白质翻译后修饰(post-translational modifications, PTMs)通过改变蛋白质的构象、定位、稳定性,广泛参与调控心脏的收缩、舒张以及能量代谢等过程。深入理解这些翻译后修饰位点,有助于筛选延缓或者治疗心力衰竭的潜在靶点。
2024年8月24日,华中科技大学同济医学院附属同济医院陈琛、汪道文教授团队在Ageing Research Reviews杂志上在线发表了题为“Insights into the post-translational modifications in heart failure”的综述论文,系统性总结了PTMs在心脏不同类型细胞中相互作用的分子机制,分别阐述了射血分数降低心力衰竭及射血分数保留心力衰竭的机制差异,并从临床转化的角度进行了详细评估。

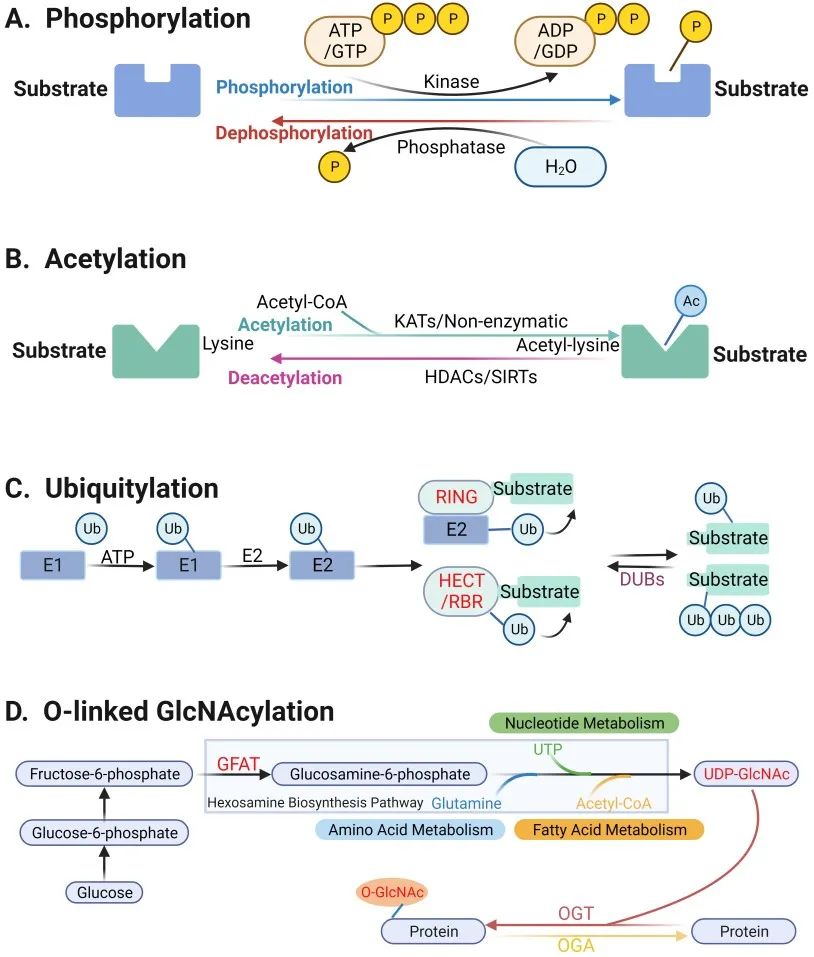
该综述首先描绘了4种常见的蛋白质翻译后修饰的基本过程:磷酸化、乙酰化、泛素化、糖基化。
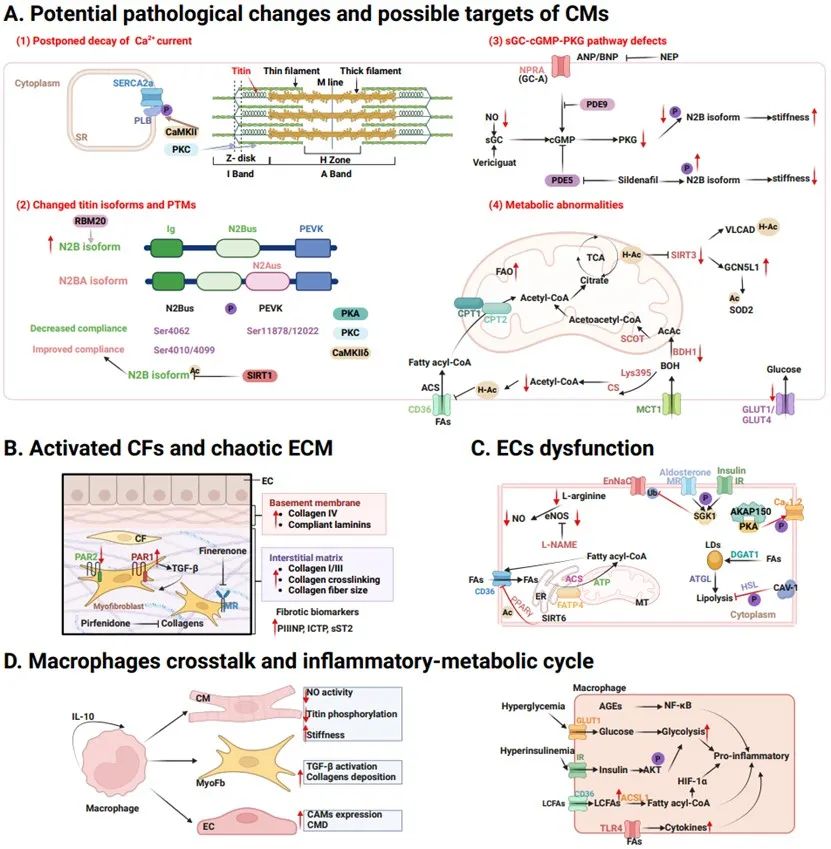
随后,作者全面总结了射血分数降低心力衰竭进程中,上述4种PTMs在心肌细胞、成纤维细胞、内皮细胞、巨噬细胞中的具体作用位点。在心肌细胞,PTMs主要参与钙离子调控、代谢重塑、线粒体质量控制,从而调控心肌的收缩力及能量供应;在成纤维细胞,转化生长因子-β (TGF-β)信号通路、瞬时受体电位(TRP)离子通道等的PTMs均是影响成纤维细胞活化的重要信号分子;在内皮细胞,PTMs通过影响血管内皮细胞生长因子(VEGF)及Notch信号通路从而改变血管的通透性及完整性;在巨噬细胞,PTMs通过调控不同时间点的趋化因子的分泌进而调控心脏的修复。此外,作者总结了射血分数保留心力衰竭中,PTMs在上述4种细胞中的作用方式。
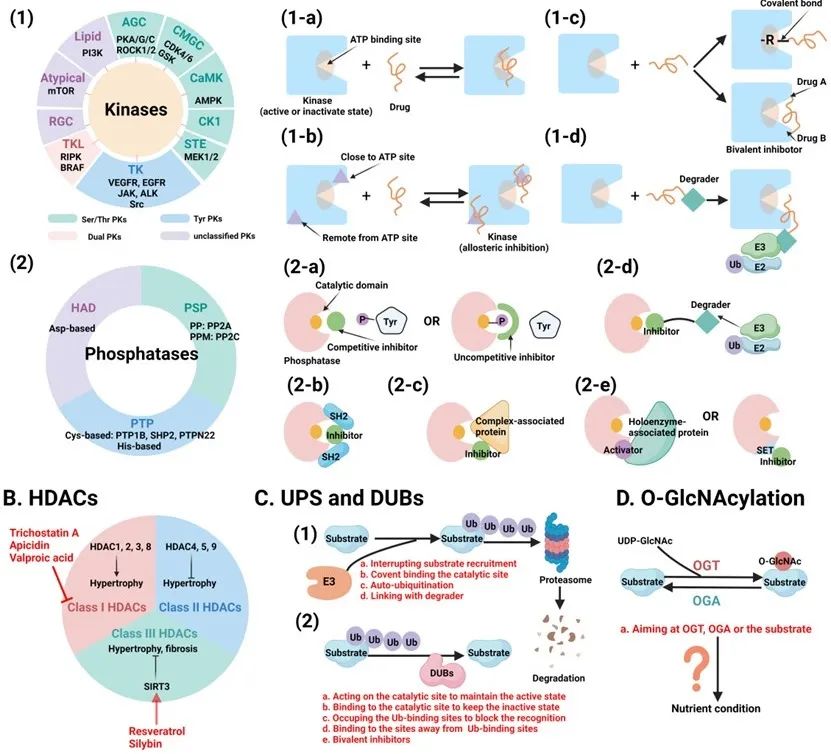
最后,作者评估了针对心力衰竭进展中蛋白质翻译后修饰的转化前景,并总结了相关的临床试验,展望了该领域的未来研究方向。
近年来,陈琛教授团队对心力衰竭的病理生理过程及分子机制展开了深入研究,通过多组学筛选和生物学验证揭示了代谢紊乱通过多种作用方式参与心力衰竭的发生发展,并提出了干预策略(Circulation. 2024 Jun 6. doi: 10.1161/CIRCULATIONAHA.123.067861, Circulation. 2024; 149:1102, Circ Res. 2024; 134:425, Sci China Life Sci. 2024; 67:1155, Circ Res. 2021; 128:1708, Circ Res. 2019; 125:1106, Circ Res. 2018; 122:712, Cardiovasc Res. 2018; 114:747, Circulation. 2016; 134:734等)。此项工作是该团队在之前研究的基础上,进一步总结心力衰竭进程中,PTMs在心脏不同类型细胞中相互作用的分子机制,并评估了临床应用前景。
华中科技大学同济医学院附属同济医院心血管内科陈琛教授和汪道文教授为本文的共同通讯作者,心血管内科张旭东医师为第一作者。本研究获得国家自然科学基金联合基金重点项目和华中科技大学基金等项目的资助。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S156816372400285X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#心力衰竭# #蛋白质翻译后修饰#
28