NEJM:Cemiplimab用于II 至 IV 期可切除的皮肤鳞状细胞癌的新辅助治疗
2022-09-13 MedSci原创 MedSci原创
Cemiplimab(西米普利单抗) 是一种抗程序性细胞死亡 1 (PD-1) 单克隆抗体,已被批准用于治疗没有局部治疗方案的转移性或局部晚期皮肤鳞状细胞癌。 在涉及晚期皮肤鳞状细胞癌患者的研究中,c
Cemiplimab(西米普利单抗) 是一种抗程序性细胞死亡 1 (PD-1) 单克隆抗体,已被批准用于治疗没有局部治疗方案的转移性或局部晚期皮肤鳞状细胞癌。 在涉及晚期皮肤鳞状细胞癌患者的研究中,cemiplimab 与 44% 至 50% 患者的客观反应相关,同时疾病得到持久控制并改善了患者报告的生活质量。其他 PD-1 抑制剂具有 也被证明在晚期皮肤鳞状细胞癌患者中具有活性。 皮肤鳞状细胞癌对免疫治疗的特殊反应的一个潜在原因是由于太阳相关的紫外线诱变导致的高肿瘤突变负担。 目前 ,尚未确定任何全身治疗作为皮肤鳞状细胞癌的治愈性治疗选择的作用。
与使用免疫疗法治疗晚期皮肤鳞状细胞癌相关的有希望的结果促使人们对评估使用新辅助免疫疗法治疗可切除皮肤鳞状细胞癌的兴趣产生兴趣。 在一项涉及对 20 名可切除的 III 或 IV 期 (M0) 皮肤鳞状细胞癌患者进行两剂新辅助西米普利单抗的单机构试点研究中,55% 的患者观察到病理完全缓解。 目前 第 2 阶段,多中心研究旨在提供验证性数据,并正式评估多达四剂西米普利单抗新辅助治疗对可切除的 II、III 或 IV 期 (M0) 皮肤鳞状细胞癌的疗效。
研究方法
18 岁或以上的患者如果患有可切除的 II、III 或 IV 期 (M0) 皮肤鳞状细胞癌,在常规临床实践中建议进行初次手术,则他们有资格被纳入研究。头颈部受累皮肤鳞状细胞癌的肿瘤-淋巴结-转移 (TNM) 分期基于美国癌症联合委员会第 8 版分期手册和无累及皮肤鳞状细胞癌的 TNM 分期头颈部肿瘤根据国际癌症控制联盟临床肿瘤学手册第 9 版。转移阶段表示存在远处转移 (M1) 或不存在远处转移 (M0)。本研究中包括的所有患者的转移阶段均为 M0。 II 期疾病患者的原发肿瘤最大直径至少为 3 cm。所有患者器官功能正常;根据实体瘤反应评估标准 1.1 版 (RECIST 1.1)至少有一个可测量的病灶;东部肿瘤协作组 (ECOG) 表现状态量表评分为 0 或 1(评分范围为 0 至 5,分数越高表示残疾越严重)。先前接受过皮肤鳞状细胞癌放射治疗的患者不符合条件。
研究设计和治疗
这项 2 期、多中心、单组、非随机研究在澳大利亚、德国和美国招募了患者。研究的第一部分评估了 cemiplimab 作为术前新辅助治疗的疗效,用于符合条件的可切除皮肤鳞状细胞癌患者。第二部分允许可选的辅助 cemiplimab 治疗、辅助放射治疗或仅观察,方法由研究者自行决定。
在长达 28 天的筛选期后,患者接受了新辅助西米普利单抗,每 3 周静脉内给予 350 mg 剂量,在 12 周期间(研究第 1、22、43 和 64 天)最多 4 剂或直至出现不可接受的毒性作用、疾病进展或撤回同意。患者在基线、第 6 周(第三剂新辅助西米普利单抗前)和第 12 周(手术前)接受了影像学评估(计算机断层扫描 [CT]、磁共振成像或两者)。外部可见病变的成像辅以数字医学摄影。新辅助期后,方案指定的手术窗口为第 75 至 100 天的研究。如果患者在新辅助期满足早期停用西米普利单抗的标准,则治疗医师可以将患者转诊至较早的时间。
主要终点是病理完全缓解,定义为治疗后获得的手术标本中没有活的肿瘤细胞,由独立审查确定。一个关键的次要终点是病理上的主要反应,定义为存在存活的肿瘤细胞,占治疗后获得的手术标本的 10%,由独立审查确定。病理完全缓解和病理主要缓解的定义是根据免疫相关病理缓解标准指定的。 在独立审查中,手术标本在中心实验室由两名非研究者且不知道结果的病理学家分别评估其他病理评估;如果需要,该样本还由一名审裁者进行审查(有 10 个案件需要审裁)。其他次要终点包括:病理完全缓解和病理主要缓解,由当地实验室的研究者评估确定;影像学的客观反应,根据 RECIST 1.1 定义为完全或部分反应的最佳整体反应,并由研究者评估确定不良事件,以评估 cemiplimab 的安全性和副作用。
结果
从 2020 年 3 月 20 日到 2021 年 7 月 8 日,共有 79 名患者开始接受研究治疗。表 1 总结了基线患者的特征。中位年龄为 73 岁(范围为 24 至 93 岁),67 名患者(85%)为男性。肿瘤的主要主要解剖部位是头部和颈部(72 名患者 [91%])。大多数患者的 ECOG 体能状态评分为 0(60 名患者 [76%])并且患有 III 期疾病(38 名患者 [48%])或 IV 期(M0)疾病(36 名患者 [46%]); 47 名患者(60%)出现淋巴结转移(表 S1)。在新辅助期间,62 名患者 (78%) 接受了所有四剂新辅助西米普利单抗(表 S2)。从第一剂cemiplimab给药到数据截止日期之间的中位随访时间为9.7个月(范围,1.3至19.6)。

表 2 临床疗效
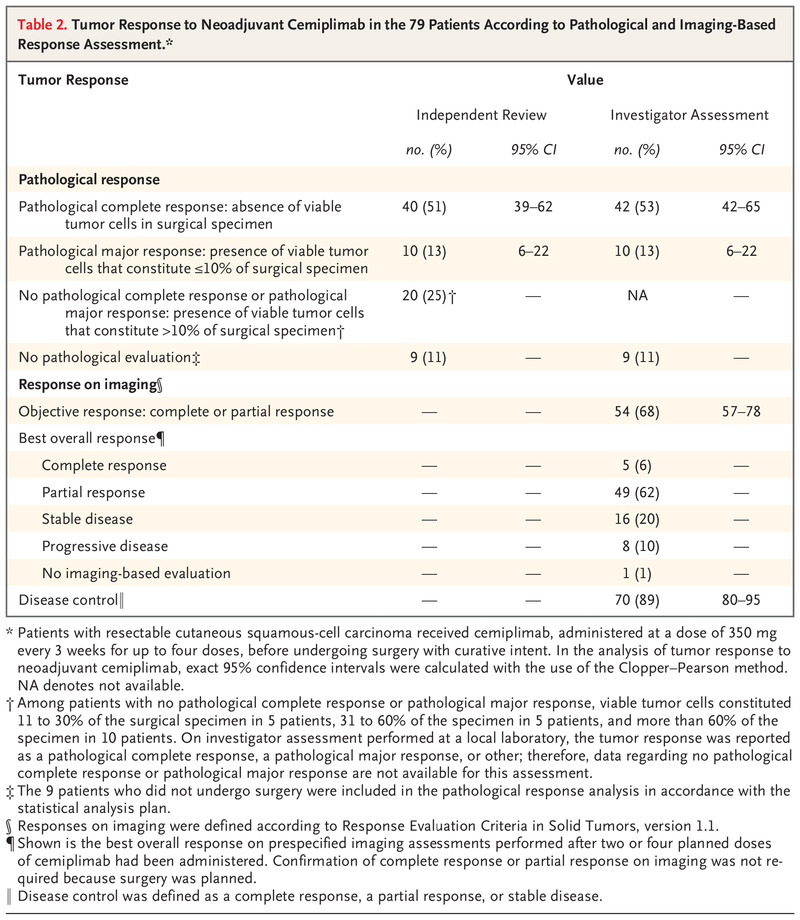
根据病理学和基于影像学的反应评估,79 名患者对新辅助 Cemiplimab 的肿瘤反应。
接受新辅助西米普利单抗治疗后,在中心实验室进行独立审查时,40 名患者(51%;95% CI,39 - 62)观察到病理完全缓解(表 2)。在独立审查中,10 名患者(13%;95% CI,6 - 22)观察到病理性主要反应。此外,发现 20 名患者 (25%) 没有病理完全缓解或病理主要缓解,定义为存在占手术标本 10% 以上的活肿瘤细胞。独立审查的结果与当地实验室调查人员评估确定的病理反应相似。在研究者评估中,42 例患者(53%;95% CI,42 至 65)观察到病理完全缓解,10 例患者出现病理主要缓解(13%;95% CI,6 至 22)。
在未接受所有四剂新辅助西米普利单抗的 17 名患者(22%)中,最常见的原因是疾病进展,这一发现基于影像学(8 名患者)或临床评估(3 名患者)。总体而言,9 名患者(11%)未在方案指定的窗口(研究天数 75 至 100)内接受手术,因此未进行病理学评估。在这些患者中,有 5 名患者在接受新辅助西米普利单抗治疗后影像学有部分反应,其中 3 名拒绝手术,1 名失访,1 名死于手术前发生的不良事件(心肌梗死在 85 -岁的男人)。在其余 4 名未接受手术的患者中,2 名在基线时出现大块疾病,进展为无法手术的疾病(1 名患者使用一剂西米普利单抗后,另一名患者使用两剂西米普利单抗后)。一名未进行基于影像学评估的患者死于手术前发生的不良事件(一名 93 岁女性的充血性心力衰竭恶化)。一名患者在服用两剂 cemiplimab 后出现疾病进展,并且未参加方案规定的随访。
在 54 名患者(68%;95% CI,57 至 78)中观察到根据 RECIST 1.1 定义并根据研究者评估确定的新辅助西米普利单抗治疗后成像的客观反应(表 2)。在基于影像学的反应评估中,5 例患者完全缓解,49 例部分缓解,16 例疾病稳定,8 例疾病进展; 1名患者没有基于影像学的评估。影像学完全缓解的患者百分比(6%)远低于独立审查病理完全缓解的患者百分比(51%)。
图 1 显示了独立审查确定的病理反应和成像反应,根据 RECIST 1.1 定义为目标病变直径总和相对于基线的最佳百分比变化,对于每个具有至少一个横截面成像的患者- 基于研究期间的反应评估。 大多数病理完全缓解的患者在术前影像学检查中未被归类为完全缓解。
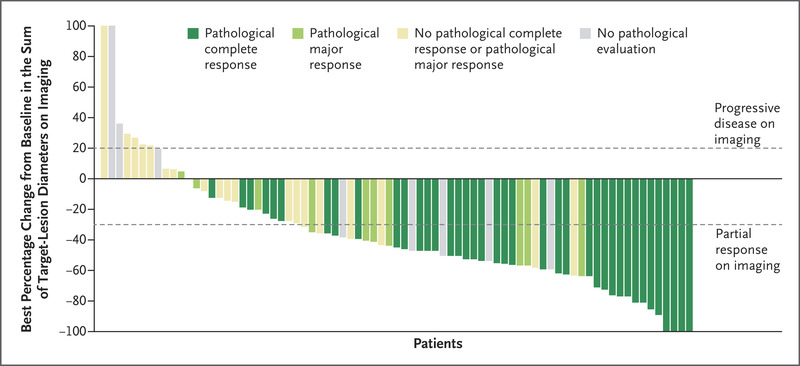
在进行手术的 70 例患者中,5 例完全缓解,44 例部分缓解,16 例影像学检查病情稳定。影像学完全缓解的 5 名患者也发现病理完全缓解(表 S5 和图 S3)。影像学部分缓解的 44 例患者中,30 例(68%)病理完全缓解,8 例(18%)病理主要缓解,6 例(14%)无病理性完全缓解或病理性主要缓解。在这 6 名患者中,残留的活肿瘤细胞占手术标本的 15%、20%、40%、65%、89% 和 90%(表 S5)。在影像学上病情稳定的 16 名患者中,5 名(31%)有病理完全缓解,2 名(12%)有病理主要缓解。截至数据截止时,没有患者在手术后出现疾病复发。

图 2 对新辅助西米普利单抗有病理完全反应的患者的临床反应
图 2 显示了代表性患者在基线和术前接受四剂西米普利单抗治疗后靶病变的照片和 CT 图像。发现这两名患者对cemiplimab有病理完全反应,以及对成像有部分反应。在这两名患者中,成像检测到的对 cemiplimab 的反应使他们免于进行眼眶切除术。
结论:
新辅助西米普利单抗(cemiplimab),每 3 周一次,最多 4 剂,每 3 周给药一次,最多 4 剂,以治愈为目的,与 51% 的 II、III 或 IV 期(M0)皮肤鳞状细胞癌患者的病理完全缓解相关。在基于影像学的反应评估中,根据 RECIST 1.1 定义并根据研究者评估确定的反应,在 68% 的患者中观察到客观反应。总体而言,病理反应患者的百分比与影像学反应患者的百分比相似,绝大多数影像学反应的患者在手术标本检查时发现病理完全反应.病理完全缓解的患者百分比(51%)大大高于影像学完全缓解的患者百分比(6%);这种差异的原因尚不清楚。这些结果表明新辅助西米普利单抗对可切除的皮肤鳞状细胞癌患者具有较高的治疗活性。
这项在中心实验室进行独立病理学审查的多中心研究表明,在可切除的 II、III 或 IV 期 (M0) 皮肤鳞状细胞癌患者中,cemiplimab 与高比例的病理完全缓解相关,并且没有新的 确定了cemiplimab的安全信号。 保留功能手术的潜力以及病理完全缓解的高频率支持在该患者群体中使用西米普利单抗的新辅助治疗。
参考资料:
Neoadjuvant Cemiplimab for Stage II to IV Cutaneous Squamous-Cell Carcinoma. NEJM, September 12, 2022 DOI: 10.1056/NEJMoa2209813
相关研究:
研究性癌症疫苗BNT116联合Libtayo (cemiplimab) 治疗非小细胞肺癌
赛诺菲(Sanofi)和再生元(Regeneron)撤销关于Libtayo治疗宫颈癌的申请
Eur J Cancer:Cemiplimab治疗局部晚期/转移性皮肤鳞状细胞癌的真实数据
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#新辅助#
111
#细胞癌#
125
#CEMIP#
109
#mAb#
98
#cemiplimab#用于II 至 IV 期可切除的#皮肤鳞状细胞癌#的#新辅助治疗#
198