Blood Adv:rrDLBCL患者的基因突变谱及对CAR-T治疗的疗效
2022-08-09 聊聊血液 网络
本研究中作者确定了4个主要的基因学存在差异的 rrDLBCL亚组,与既往报告的主要高危分子学亚组相似。
基因学
弥漫大B细胞淋巴瘤
CAR-T细胞疗法已在治疗难治性或复发性 DLBCL(rrDLBCL) 患者方面非常有前景,然而证据显示,CD19 CAR-T细胞疗法治疗rrDLBCL的完全缓解 (CR) 率仅有40%-54%,这可能归咎于rrDLBCL的基因异质性。
高通量二代测序技术的出现迅速增加了DLBCL基因组改变的知识,多篇报道均提出分子学亚型的概念。不同的分类结论描述了部分重叠的特征,提示分子亚型的存在及其在指导新型靶向治疗的作用,但尚不清楚不同分子亚型对CAR-T细胞治疗的疗效是否不同。
为了解决上述问题,克晓燕教授牵头对105例rrDLBCL患者的92个血液学相关基因进行了靶向深测序,这些患者中的大多数在对多线治疗反应不佳后接受了CAR-T细胞免疫治疗。研究结果近日发表于《Blood Advances》。

研究结果
本研究共纳入105例rrDLBCL的患者,其中含6例滤泡性淋巴瘤转化患者、2例黏膜相关淋巴组织 (MALT) 淋巴瘤转化患者和2例慢性淋巴细胞白血病 (CLL) 淋巴瘤转化患者;84例患者 (86%,84/105) 入组了一项B细胞 CAR-T 细胞治疗临床试验并接受 CAR-T 细胞治疗。
本研究纳入的105例患者的基线临床特征总结见表1。初次诊断时中位年龄为49岁。29例 (27.6%)的IPI评分相对高危(4-5分),难治或复发的中位时间为12.7个月。既往中位化疗周期数为11。11例 GCB 患者 (11/31,35.5%) 为“双打击”或“三打击 (DH/TH),包含MYC和 BCL2/BCL6 易位,而仅2例非GCB患者 (2/74,2.7%)为DH/TH。大多数患者为晚期。
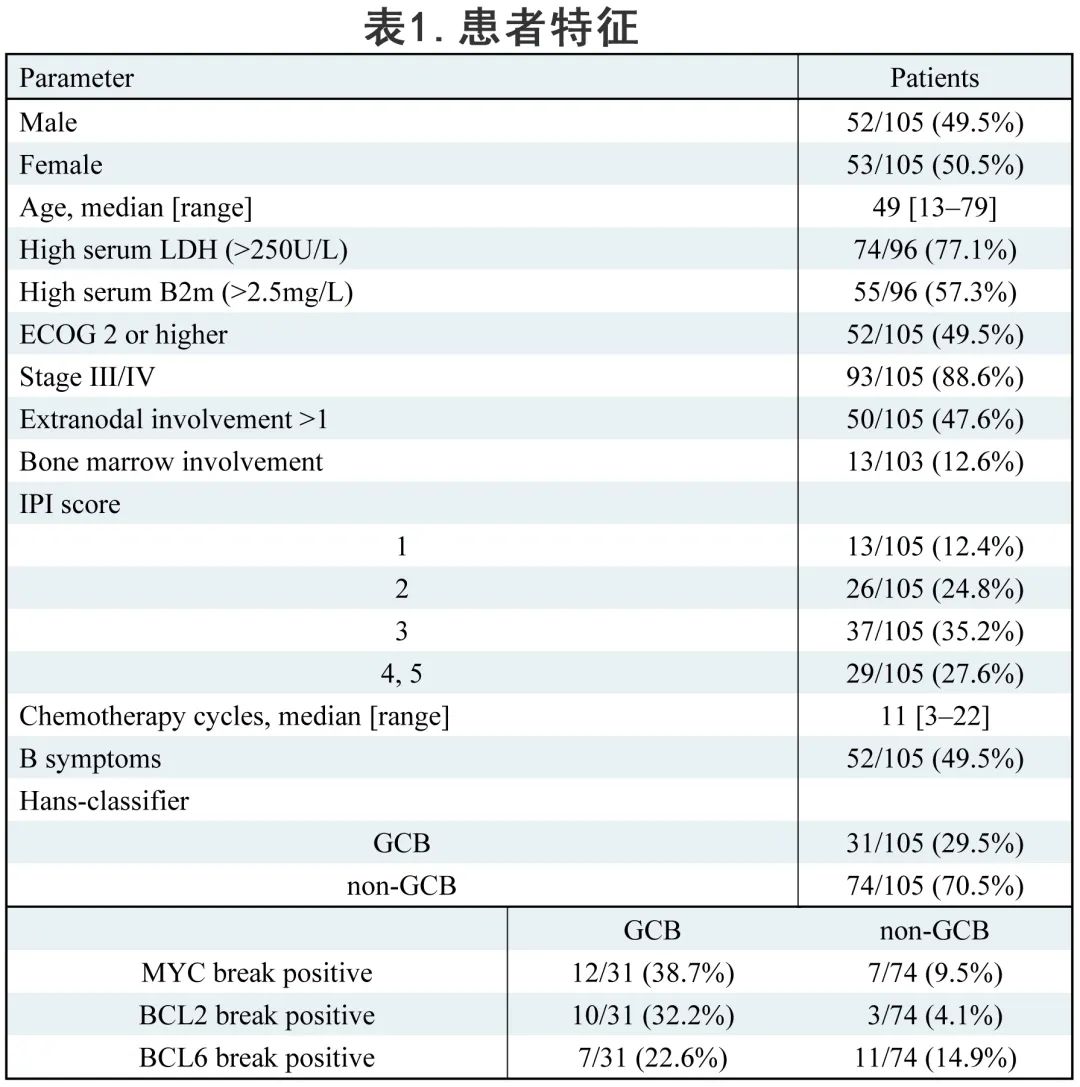
图1A为rrDLBCL 患者中>5%的癌症基因突变的分布情况,rrDLBCL患者的中位遗传驱动因素为6,最常见(>15%)的突变基因为TP53、KMT2D、PIM1、MYD88、CREBBP、CD79B和B2M(图1A)。
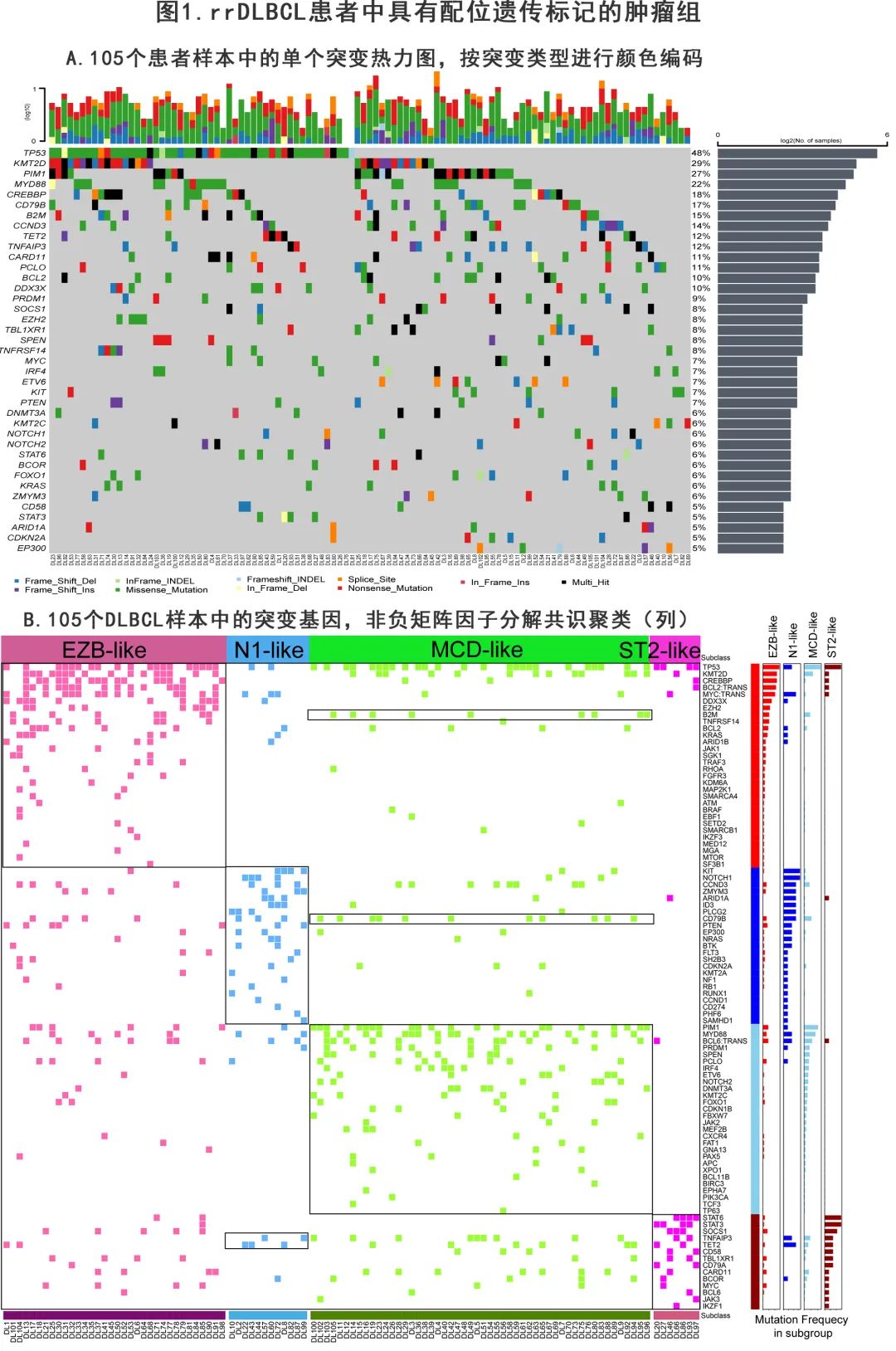
为了评估基因突变与CAR-T细胞免疫治疗成功之间的关系,作者对rrDLBCL患者进行了基因分类,并发现了4个稳健的肿瘤亚群(簇clusters)(图1B)。
为呈现各亚型的基因组成,作者选择了一组与亚型显著相关的基因特征 (p<0.05),且它们在每种亚型的肿瘤中均>10%。
EZB样—34例DLBCL中的大多数具有DH(BCL2易位和 MYC 断裂),并且还表现出染色质修饰因子KMT2D、CREBBP和EZH2的频繁突变,以及具有非同义单核苷酸变体 (SNV) 和停止增益突变的 DDX3X 突变。与此结果一致,EZB样亚型在大多数转化的滤泡性淋巴瘤病例中存在,并在 DH GCB 型DLBCL中强烈富集。此外该亚组的遗传特征与 Wright 等2020年在《CANCER CELL》描述的EZB相似。
N1样—12例 DLBCL的特征在于NOTCH1突变、B细胞分化调节因子ID3和 BCR 信号中间体(BTK和PLCG2)的功能获得。N1 样肿瘤中的体细胞KIT p.M541L体细胞突变增强了 KIT 激活 PI3K-AKT-MTOR 和 MAPK 信号转导的能力,并诱导肿瘤细胞持续增殖和凋亡信号通路失活。该亚组同样表现出与 Wright 等报道的 N1 相似的特征。
MCD样—52例 DLBCL表现出PIM1、MYD88和 CD79B 的频繁突变,这些改变之前与 ABC 型 DLBCL 肿瘤相关。在具有 MCD 样亚型的肿瘤中,33%(17/52) 携带 MYD88 突变,21%携带 CD79B 畸变(主要是突变Y196),11.5%(6/52) 同时携带 MYD88L265P 和 CD79B 异常。与 ABC-DLBCL相关的其他改变包括 IRF4 和 ETV6 的改变以及 PRMD1 的失活。该亚组同样表现出与 Wright 等报道的MCD相似的特征。
ST2 样—7例 DLBCL的特征为 JAK/STAT 通路成员(SOCS1、STAT6和STAT3)突变和免疫逃逸 (CD58)。该亚型的一半发现纵隔受累,提示与 PMBCL 有一定程度的生物学相似性。该亚组同样表现出与 Wright 等报道的ST2相似的特征。
所有患者中的一半为 SCD 样,32.4%为 EZB 样,11.4%为 N1 样,6.7%为 ST2 样。N1 样、MCD样和 ST2 样亚型以非 GCB 为主,而EZB样包括大部分GCB患者。大多数 DH/TH 患者属于 GCB亚组和 EZB 样亚型。
共84例患者 (86%,84/105) 接受了 CAR-T 细胞治疗。CAR-T 细胞输注3个月后,完全缓解 (CR) 率为42.8%,总有效率为58.3%。截至数据截止日期共有39.2%的患者保持CR。中位随访时间为13.63个月,接受 CAR T 治疗的患者的中位无进展生存期 (PFS) 和总生存期 (OS) 分别为6.23个月和16.2个月,与未接受 CAR-T 治疗的患者相比,PFS和 OS均更佳。
作者接下来评估了基因组病变的差异是否影响 CAR-T 细胞治疗后的治疗获益。在各肿瘤遗传因素中,在单变量 logistic 回归分析中,仅 TP53 改变可预测较低的 CR 率(图2A,B),其他细胞遗传学特征不影响CR率(图2A)。此外携带 TP53 和 DDX3X 突变的患者在 CAR-T 细胞免疫治疗后的 OS 劣于 WT 组(图2D,E);而在携带 TP53 突变的患者中,CAR-T细胞免疫治疗可以改善生存期。DH/TH 组和非 DH/TH 组的 CR 率相似(图2C)。
在各分子亚型中 CR 率无统计学显著差异(图2F)。作者还发现各分子亚型之间的 OS 均无显著差异(图2G),但MD 样和 EZB 样亚组接受 CAR-T 治疗的患者的 OS 优于未接受 CAR-T 治疗的患者。
结论
本研究中作者确定了4个主要的基因学存在差异的 rrDLBCL亚组,与既往报告的主要高危分子学亚组相似。作者发现基因分类对 CAR-T 结果的影响有限,还证明了 TP53 和 DDX3X 突变对接受 CAR T 治疗的 rrDLBCL患者的潜在预后影响。此外接受 CAR-T 治疗的 rrDLBCL患者OS更佳。
参考文献
Hui Shi, Peihao Zheng, Rui Liu,et al. Genetic landscapes and curative effect of CAR T-cell immunotherapy in relapse and refractory DLBCL patients.Blood Adv . 2022 Jul 28;bloodadvances.2021006845. doi: 10.1182/bloodadvances.2021006845.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CAR-#
83
#LBCL#
85
#DLBCL#
68
#突变谱#
90