病理干货 | ADC药物或将开启HER2 低表达乳腺癌诊治的新篇章
2023-11-11 上海阿克曼病理 上海阿克曼病理 发表于陕西省
多种抗HER2靶向药物为该亚型的患者提供了显著的临床益处,伴随新型HER2靶向治疗药物的研发,越来越多的研究焦点转向HER2低表达的患者。
乳腺癌是女性中发病率最高的癌症,异质性高,组织学类型多样,分子分型日趋完善,不同类型的乳腺癌具有不同的预后,治疗决策基于传统的肿瘤分期、组织学类型和分子分型,包括Luminal A型、Luminal B型(HER2阴性)、HER2阳性和三阴型4种不同的亚型。其中HER2阳性乳腺癌,约占所有乳腺癌的15%,ERBB2基因扩增导致HER2蛋白过表达,具有侵袭性强、预后差的特点,多种抗HER2靶向药物为该亚型的患者提供了显著的临床益处,伴随新型HER2靶向治疗药物的研发,越来越多的研究焦点转向HER2低表达的患者。
01 HER2低表达的定义与临床意义
2018年美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)撰写的“HER2检测指南”更新:当至少一个肿瘤组织样本IHC分析评为“HER2 3+”或ISH分析证实HER2过表达或基因扩增时,称为HER2阳性乳腺癌。在IHC HER2 2+的情况下,需要额外进行ISH检测来确定HER2状态,同时需要结合IHC切片以进行综合评估。在IHC评分为0和1+,或IHC 2+同时ISH阴性的情况下,称为HER2阴性乳腺癌,不推荐进行HER2靶向治疗。
近年来,对于IHC 1+或2+伴ISH阴性的病例提出了一个潜在的新命名,即HER2低表达/HER2弱阳性乳腺癌(HER2低表达乳腺癌)。HER2 低表达肿瘤与HER2 阴性的肿瘤具有不同的分子特征。有研究表明[1],在HER2 1+和HER2 2+的乳腺癌细胞膜上存在着50万~100万个HER2受体分子,新型抗体偶联药物(Antibody-drug conjugates,ADC)通过独特的药理学机制实现HER2低表达乳腺癌的肿瘤细胞被杀伤,ADC的靶向细胞毒性药物可进入癌细胞,或吸引免疫活性细胞杀伤癌细胞。HER2低表达乳腺癌的新型抗HER2药物的临床开发有可能改善这部分患者的治疗手段,从而将这些疗法扩展到目前认为不适合抗HER2靶向治疗的乳腺癌患者中。超过一半的乳腺癌可能符合HER2低表达[2],见图1。HER2低表达的临床定义本质上依赖于病理检测技术,目前应用标准的IHC/ISH方法。
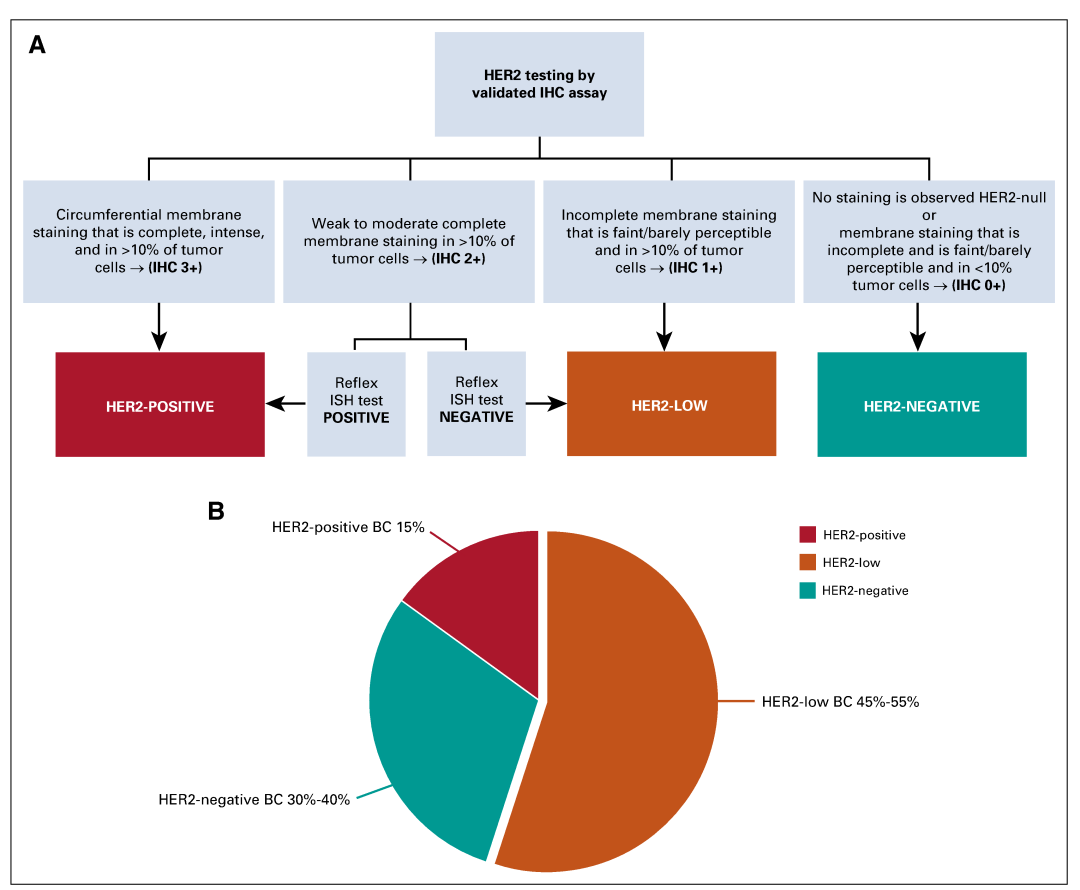
图 1
(DOI: 10.1200/JCO.19.02488 Journal of Clinical Oncology 38, no. 17 (June 10, 2020) 1951-1962.)
02 HER2低表达相关的重要研究及药物概述
2022年4月1日,NMPA将trastuzumab deruxtecan(T-DXd)纳入突破性治疗类别,用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性乳腺癌成人患者,第一三共和阿斯利康合作研发的T-DXd,(又称DS8201;英文商品名为ENHERTU®)用于治疗HER2低表达晚期乳腺癌的3期DESTINY-Breast04研究达到主要研究终点,这项研究计划入组540例HER2低表达(IHC 2+且ISH−或IHC 1+)、既往接受过1或2线化疗的不可切除或转移性乳腺癌患者,按照2:1比例随机分配至T-DXd组(5.4 mg/kg IV q3w)或研究者选择方案组(卡培他滨、艾立布林、吉西他滨、紫杉醇或白紫),主要终点是独立盲法中心(BICR)评估HR阳性、HER2低表达患者的PFS。T-DXd相较于研究者选择方案,可显著降低HR阳性、HER2低表达患者的疾病进展或死亡风险,而且关键次要终点也有获益,包括无论HR状态(阳性或阴性)、HER2低表达患者的PFS,以及HR阳性、HER2低表达患者和无论HR状态(阳性或阴性)患者的OS均有改善。
DESTINY-Breast04研究是一项全球208个中心共同参与的国际多中心研究,国内有18个中心参与其中,徐兵河院士是该研究在中国的主要PI,中国患者为该试验贡献了重要的中国数据。
图 2
T-DXd是新型抗HER2抗体偶联药物(ADC),由人源化抗HER2 IgG1抗体、可裂解的GGFG四肽连接子和拓扑异构酶I抑制剂(喜树碱衍生物Dxd)组成,具备精准靶向和高效低毒的双重优势,主要药理作用如下[3]:

图 3
DS8201a在临床前实验、乳腺癌的Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验,胃癌的Ⅰ期临床试验、Ⅱ期临床试验,非小细胞肺癌的Ⅰ期临床试验、Ⅱ期临床试验及结直肠癌Ⅱ期临床试验均取得了一定的研究成果。诚然根据其研究结果,DS-8201a的不良反应表现为间质性肺病(interstitial lung disease,ILD)、轻至中度的胃肠道和血液学事件和心脏毒性[3]等。
另一项III期临床试验 DESTINY-Breast06研究正在进行中,该研究将入组850例≥2线晚期内分泌治疗失败的HR+/HER2低表达患者,随机接受T-DXd或研究者选择方案(卡培他滨、紫杉醇或白紫)治疗。
03 HER2低表达诊断的局限
DESTINY-Breast04等研究提示,T-DXd对HER2低表达乳腺癌患者具有治疗价值,HER2低表达被视为“HER2-”的患者需要进一步被区别出来,但通过免疫组化染色来准确区分“1+”和“0”之间的微弱差异,则增加了病理医生的判读的精细化和挑战性。
杨懿等[4]研究FISH和IHC方法在HER2检测的一致性评价,表明IHC法检测HER2结果为3+的病例与FISH检测结果为阳性扩增的符合率可以达到90%以上,当IHC为-/+和3+时,两种方法检测结果的一致性最好。Wolff AC[5]等研究HER2检测的差异性显示,最初获得IHC 0分的肿瘤患者中,高达85%实际上是1+或2+。此外,福尔马林的固定人为地降低检测出的蛋白质表达量,IHC方法上的局限性可能也会影响HER2低表达结果。因而在日常病理诊断工作中,需要标准化HER2的检测方法,全流程监控样本前处理、实验方法和判读质控等。
HER2低表达乳腺癌的出现,提醒临床医生注重HER2 0 和HER2 1+的患者存在治疗差异的可能。期待有更多的HER2 低表达乳腺癌的临床研究结果、HER2状态的临床解读,包括重新评估现有的HER2检测方法,并明确对HER2状态描述。目前的HER2检测方法(IHC/ISH方法)不足以识别HER2低表达,非此即彼的区分基因扩增状态的HER2+和HER2-评价方法虽然有益,但可能不够细致、全面。新的检测手段如定量免疫分析和RT-qPCR可能会使潜在的HER2低表达被检测,但仍需要更多的临床数据支撑。
结束语:
HER2低表达患者目前被诊断为HER2 阴性,HER2低表达是否能定义为临床相关的一个乳腺癌亚型,并没有太多的证据。HER2低表达在肿瘤细胞表面有着不同程度的HER2蛋白表达,从而可能影响患者的治疗决策和预后,新型的抗体药物偶联物ADC能通过其独特的药物作用机制杀伤HER2低表达肿瘤细胞,从而产生治疗效果,多项关键Ⅲ期临床研究正在开展,期待HER2低表达有越来越多的临床研究成果,为该类型乳腺癌患者提供更多的临床治疗方案。
参考资料
[1] Onsum MD, erettiE, PragasV, et al. Single-cell quantitative HER2 measurement identifies heterogeneity and distinct subgroups within traditionally defined HER2-positive patients[J] Am J Pathol,2013,183(5):14461460.
DOI:10.1016/j.ajpath.2013.07.015.
[2] Paolo Tarantino, Erika Hamilton, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape[J] Journal of Clinical Oncology 2020: 10.1200/JCO.19.02488.
[3] 朱逸晖,李婷,胡夕春 Trastuzumab deruxtecan的临床研究进展及展望——HER2耐药患者的新希望;《中国癌症杂志》2021,31(8):754-761.
[4] 杨懿,孟刚 两种方法对乳腺癌人类表皮生长因子受体2检测的一致性评价[J] 中华疾病控制杂志. 2020,24(08): 981-984.
[5] Wolff AC, Hammond MEH, Allison KH, et al: Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med.2018,142:1364-1382.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言