Nature:治愈“癌王”更近一步:治疗有效率高达50%!突破性癌症疫苗,强力阻止癌症复发
2023-05-14 iNature iNature 发表于上海
该研究进行了一项基于尿苷mRNA -脂质体纳米颗粒的I期试验,该研究从手术切除的PDAC肿瘤中实时合成mRNA新抗原疫苗。
胰腺导管腺癌(PDAC)在88%的患者中是致命的,但它含有突变衍生的T细胞新抗原,适合用于疫苗。
2023年5月10日,纪念斯隆-凯特琳癌症中心Vinod P. Balachandran和Benjamin D. Greenbaum共同通讯在Nature在线发表了题为“Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer”的研究论文,该研究进行了一项基于尿苷mRNA -脂质体纳米颗粒的I期试验,该研究从手术切除的PDAC肿瘤中实时合成mRNA新抗原疫苗。手术后,依次给予atezolizumab(一种抗PD-L1免疫疗法)、自体cevumeran(每位患者最多20种新抗原)和改良版的四药化疗方案(mFOLFIRINOX,包括亚叶酸、氟尿嘧啶、伊立替康和奥沙利铂)。终点包括疫苗诱导的高阈值新抗原特异性T细胞,18个月无复发生存期和肿瘤学可行性。该研究用atezolizumab和autogene cevumeran治疗了16例患者,然后用mFOLFIRINOX治疗了15例患者。
在基准时间的3天内给予自体cevumeran,结果显示在16名患者中有8名患者耐受并诱导新生高强度新抗原特异性T细胞,其中一半针对一种以上的新抗原疫苗。使用一种新的策略来跟踪T细胞克隆(CloneTrack)和功能分析,该研究发现疫苗扩增的T细胞占所有血液T细胞的10%,用疫苗增强剂重新扩增,包括长寿的多功能新抗原特异性效应CD8+ T 细胞。在18个月的中位随访中,有疫苗扩增T细胞(应答者)的患者比没有疫苗扩增T细胞的中位无复发生存期更长。因此,atezolizumab、autogene cevumeran和mFOLFIRINOX可诱导大量T细胞活性,可能与PDAC延迟复发相关。

PDAC是美国癌症死亡的第三大原因,全球排名第七。随着发病率的增加,以及近60年来生存率基本停滞不前,一直在12%,预计到2025年,PDAC将导致更大的全球癌症死亡。手术是治疗PDAC的唯一方法。然而,尽管手术,近90%的患者在中位7-9个月时有疾病复发,5年总生存率(OS)仅为8-10%。虽然辅助多药化疗能延迟复发,是手术切除的PDAC的标准治疗,但近80%的患者在14个月左右出现疾病复发,其5年OS为30%。放射、生物制剂和靶向治疗也无效。
PDAC对免疫检查点抑制剂几乎完全不敏感(有效率5%)。这种不敏感性部分归因于这样一个事实,即PDACs具有低突变率,产生很少的新抗原,健康组织中缺乏突变产生的蛋白质,这些蛋白质将癌症标记为T细胞的外来物,因此可能使PDACs的抗原性较弱,很少浸润T细胞。然而,最近的观察表明,大多数PDAC实际上比以前预测的含有更多的新抗原。
对PDAC长期幸存者的研究表明,新抗原可能刺激PDAC中的T细胞。富含免疫原性新抗原的原发性肿瘤也含有约12倍高密度的活化CD8+ T 细胞,这与延迟疾病复发和延长患者生存期相关。因此,由于大多数PDAC含有可能刺激T细胞的新抗原,递送新抗原的策略可能会诱导新抗原特异性T细胞并影响患者的预后。
观察到PDAC的长期幸存者对肿瘤特异性新抗原产生自发T细胞反应,但这些反应在患者中并不相同,该研究测试了佐剂个体化疫苗是否可以刺激新抗原特异性T细胞,并为手术切除的PDAC患者提供临床益处。治疗性mRNA疫苗技术促进了个体化新抗原疫苗的快速递送,已经完全融入常规肿瘤学工作流程。此外,mRNA可以快速制造成含有多种新抗原的个体化疫苗,可以激活抗原呈递细胞,并且可以使用新开发的临床阶段配方有效地递送。因此,该研究假设一种有效的个体化mRNA疫苗可以在PDAC中诱导新抗原特异性T细胞,消除微转移并延迟复发。
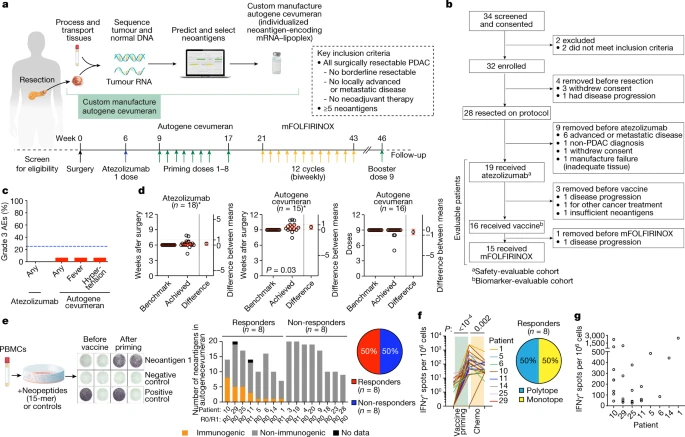
个体化mRNA新抗原疫苗在PDAC患者中是安全、可行和具有免疫原性的(图源自Nature )
该研究结果证明了autogene cevumeran,一种基于尿苷mRNA -脂质体纳米颗粒的个体化新抗原疫苗,与atezolizumab和mFOLFIRINOX联合使用是安全可行的,并且在50%的可切除PDAC的未选择患者中产生大量新抗原特异性T细胞。疫苗扩增的T细胞是持久的,治疗后仍持续存在长达2年。高强度疫苗诱导的T细胞反应是免疫反应分析的重点,包括一种追踪疫苗扩增克隆的新方法,与延迟的PDAC复发相关。尽管样本量有限,但这些早期结果为PDAC个体化mRNA新抗原疫苗的更大规模研究提供了依据。
原文链接:
https://www.nature.com/articles/s41586-023-06063-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言