Nature子刊:哈佛大学陈曾熙公共卫生学院打造癌症免疫治疗新框架MetaTiME!
2023-05-08 转化医学网 转化医学网 发表于上海
MetaTiME可发现肿瘤免疫和癌症免疫治疗的细胞状态和基因调节因子,在癌症免疫治疗方面实现了重大突破。
导读:癌症研究的最新进展表明肿瘤微环境(TME)是肿瘤进展和治疗反应中的重要部分。了解癌细胞和非癌细胞间的相互作用已成为癌症免疫治疗的潜在目标。
5月6日,哈佛大学陈曾熙公共卫生学院研究人员在Nature Communications上发表了名为“MetaTiME integrates single-cell gene expression to characterize the meta-components of the tumor immune microenvironment”的文章,研究人员利用数以百万计的TME单细胞开发了计算框架MetaTiME,在肿瘤免疫治疗方面实现了突破。

1、研究背景
单细胞rna测序(scRNA-Seq)已应用于许多肿瘤患者,并且能够高分辨率地识别干扰癌细胞消除的TME成分。然而,肿瘤scRNA分析中细胞类型和细胞状态的定义仍然依赖于专家使用已知的独家生物标志物进行人工标记,这缺乏一致性且在不同的队列之间存在差异。
随着单细胞数据的积累,整合多个队列的大量细胞可以统一细胞类型和状态的定义,从而促进自动注释新的scRNA-seq数据。细胞注释的一种方法是使用预定义的生物标记物列表。然而,这些生物标记物可能无法覆盖特定区域的细胞状态,此外,尽管参考数据库的细胞类型定义可能很有用,但定义粒度会因数据库而有所差异。另一种方法是将包含未注释单元格状态的数据集映射到带注释的引用。获得这种表示的方法包括典型相关分析(CCA),调整主成分(Harmony),或使用变分自编码器(scVI)的生成深度学习模型。
2、研究方法
研究人员开发了一个计算框架,用于将来自多个队列的数百万个单细胞映射到一个全面的潜在空间,并从数据中进行学习。MetaTiME(肿瘤免疫微环境元组件)框架确定了可重复的低维元组件,反映出跨队列和癌症类型的基因表达变异的独立组件。框架采用ICA进行降维,从而最大限度地提高组件之间的相互独立性。研究人员使用MetaTiME从79个肿瘤数据集中的170万个单细胞中获得元成分(mec)。这些mec代表了86个数据驱动的转录方向上的TME,反映了谱系特异性细胞状态和信号活动。此外,研究人员还开发了一个MetaTiME工具包,用于使用mec来注释肿瘤scRNA数据集中的细胞状态和特征连续体,并揭示免疫治疗反应之间的差异特征。最后,通过结合转录因子结合数据,MetaTiME可以识别并优先考虑可能调节肿瘤免疫的转录调节因子。
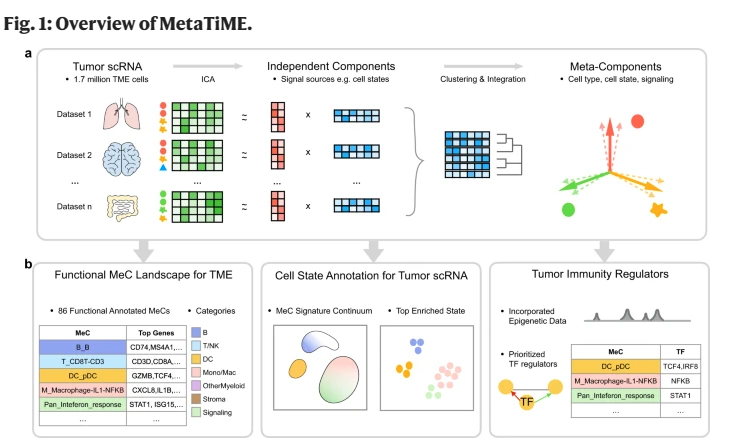
MetaTiME框架包括三个阶段:元组件(MeC)的发现、MeC的解释和单元状态注释的应用(图1a)。MeC发现阶段从多个具有相似细胞特性的单细胞测量中检测可重复的变异源。MeC解释步骤包括使用生物标志物数据库、途径信息和Cistrome DB染色质分析数据的一次性管理工作。在第三步中,用户使用MetaTiME应用工具将mec映射到新的肿瘤scRNA-seq数据集上,以获得注释的细胞状态和签名连续体。
为训练TME背景下的mec,研究人员收集并整理了来自27种癌症类型、76项研究中的2,157,387个细胞,使用了主要来自TISCH28的公开肿瘤scRNA-Seq数据。去除TISCH注释的恶性细胞后,保留102,703个基质细胞和1,617,110个免疫细胞进行下游训练。76项研究根据癌症类型进一步划分,得到93个数据集,其中7个数据集使用免疫检查点阻断(ICB)治疗,3个10x Genomics提供的数据集代表来自健康供者的外周血单个核细胞(PBMC)。
在MeC发现阶段,MetaTiME首先使用独立成分分析(ICA)分解每个单个数据集的对数变换表达式矩阵。采用ICA来最大限度地提高基因表达组分之间的相互独立性。在模拟中,ICA在具有预嵌入转录特征的模拟单细胞数据中的表现略好于非负矩阵分解(NMF)。此外,研究人员使用标准方法通过批效应去除、聚类和差异表达分析获得聚类智能签名。受服务器计算内存的限制,以这种方式集成的数据集的最大数量为21个,并且聚类智能签名在测试数据中显示出较低的特异性。因此,MetaTiME方法允许有效地集成大量的单元数据集,随着数据的积累,这将变得越来越重要。
3、研究意义
研究人员开发的MetaTiME工具可利用表观遗传学数据揭示细胞状态的关键转录调节因子。总体而言,MetaTiME可发现肿瘤免疫和癌症免疫治疗的细胞状态和基因调节因子,在癌症免疫治疗方面实现了重大突破。
参考资料:
https://www.nature.com/articles/s41467-023-38333-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言