【衡道丨笔记】甲状腺肿瘤的病理诊断更新及分子检测进展
2023-12-26 衡道病理 衡道病理 发表于上海
“复旦大学附属中山医院病理科31周年系列公开课”的课程中,刘亚岚老师为大家带来了甲状腺肿瘤的病理诊断更新及分子检测进展的分享。摘要如下:
一、2022版(第五版)内分泌肿瘤甲状腺肿瘤的更新内容简介
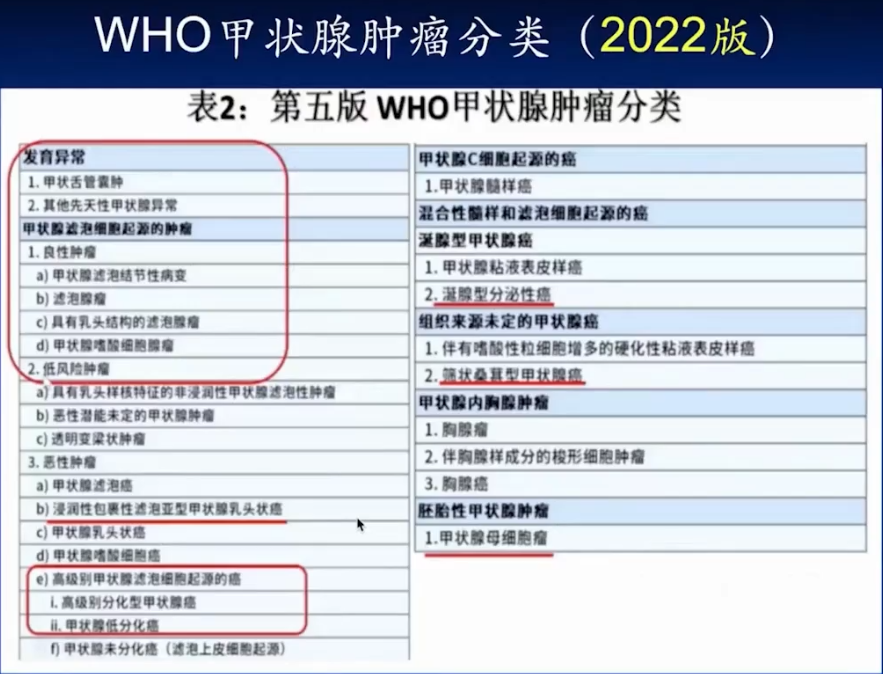
二、甲状腺滤泡来源恶性肿瘤的分类及临床病理特征
按照分化程度,甲状腺滤泡来源的癌分为:
高分化癌:
其中乳头状癌(PTC)和滤泡癌(FTC)又称为高分化癌。大于90%的甲状腺癌属于高分化癌,临床表现为惰性过程,手术切除可治愈,即使有区域淋巴结转移,预后仍良好,属于低度复发危险因素。
中分化癌:
高分化癌的某些亚型——"侵袭型”PTC(包括乳头状癌的部分柱状细胞亚型、高细胞型、弥漫硬化型、鞋钉亚型)和“广泛浸润型“FTC,呈现临床侵袭性过程,有相对较高复发率,称为高分化癌侵袭性亚型,预后较一般高分化癌差,但好于低分化癌,属于中度复发危险因素。
低分化癌:
低分化癌临床及生物学行为介于高分化癌和未分化癌之间;
2022版包括高级别分化型甲状腺癌和传统型低分化/岛状癌。
未分化癌:
未分化癌罕见,是恶性度最高的甲状腺癌,中位生存期不足6个月,TNM分期直接将其归入T4期。

PTC亚型(“鞋钉样型”):
-
1955-2004年间梅奥诊所2534例乳头状癌,其中8例鞋钉样型,6女/2男,28-78岁(平均57.6岁),肿瘤直径1-4cm(平均2.5cm);
-
标准:>30%区域出现鞋钉样形态;
-
平均随访77个月:5例远处转移、4例死于疾病(平均43个月)、2例带瘤生存(4个月和87个月)、2例无病生存(120个月和236个月)、4/7存在b-raf突变(57%)。
伴有显著鞋钉样形态的PTC是一种中分化亚型,具有侵袭性的临床行为及较高的死亡率。
-
1.18例鞋钉样型(>30%);
-
2.4例淋巴结转移;
-
3.基因改变:BRAF突变(72.2%)、TP53(55.6%)、hTERT(44.4%)、PIK3CA(27.8%)、CTNNB1(16.7%)、EGFR(11.1%)、AKT1(5.5%)、NOTCH1(5.5%)。
PTC亚型(“高细胞型”):
-
1976年首次报道;
-
年龄大,1-19%PTC(6%);
-
20%难治性;
-
一组回顾性6282例PTC全/次全甲状腺切除病例中,经典型PTC:4702例(74.8%)、滤泡亚型:1126(17.9%)、高细胞亚型:239(3.8%);
-
高风险参数递增:滤泡型-经典型-高细胞型。
PTC亚型(“柱状细胞型”)
-
少见
-
年龄分布广
-
生物学行为难预测:可为惰性,可为侵袭性/广泛转移
-
对Ⅰ131或化疗不敏感
-
一个大样本回顾性报道中:9/5174例PTC,4女/5男,32-90岁(平均57岁),均手术,术后7例进行Ⅰ131治疗,3例行放疗,BRAF突变:3/9。
PTC亚型(“弥漫硬化型”)
-
年轻患者;
-
双侧多见;
-
不形成明显肿块(弥漫性);
-
多合并自身免疫性甲状腺炎;
-
显著的淋巴结转移;
-
25%患者就诊时发生肺转移。
小结
不是所有的甲状腺癌都预后好——需看病理分型!
不是所有的甲状腺乳头状癌都预后好——需看病理亚型!
具有侵袭特征的乳头状癌亚型:
-
实体型/梁状
-
柱状细胞型
-
高细胞型
-
鞋钉样型
-
弥漫硬化型
具有侵袭特征的滤泡癌亚型:
-
广泛浸润型
三、甲状腺低风险肿瘤(交界性肿瘤)
2022版WHO——甲状腺低风险肿瘤(2017版WHO——甲状腺交界性肿瘤)
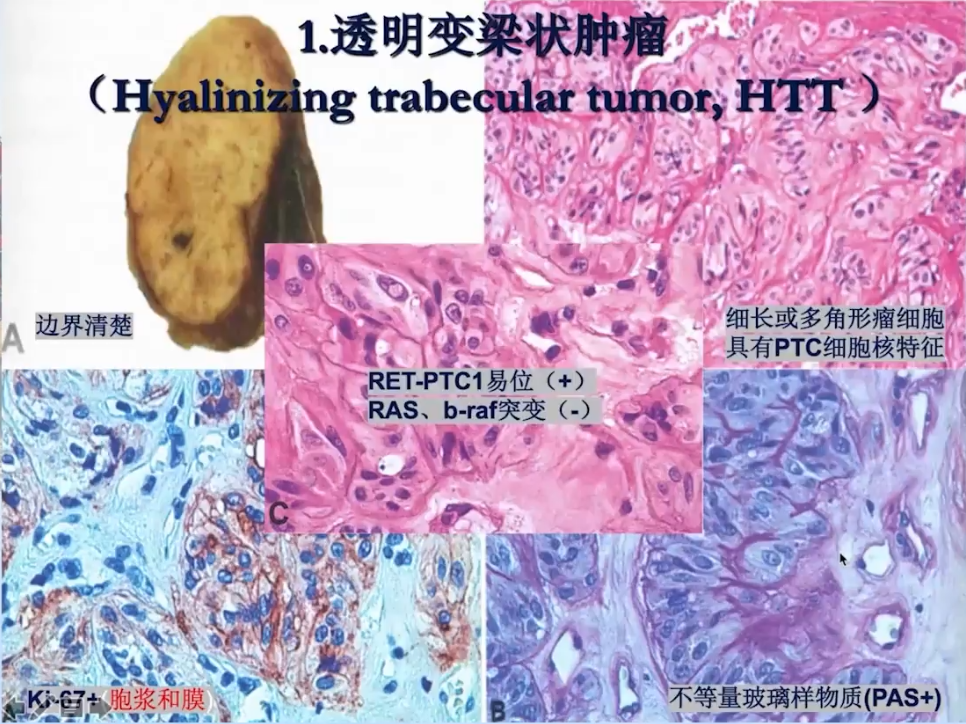
1、透明变梁状肿瘤
2.甲状腺低风险肿瘤之“其它包裹性滤泡性肿瘤”
-
包裹性/边界清楚
-
滤泡状生长方式(无真性乳头)
2.1恶性潜能未定的滤泡性肿瘤(FT-UMP)
可疑浸润+非PTC细胞核(PTC细胞学评分0/1分)
2.2恶性潜能未定的高分化肿瘤(WT-UMP)
可疑浸润+(可疑)PTC细胞核(PTC细胞学评分2/3分)
可疑包膜侵犯——UMP
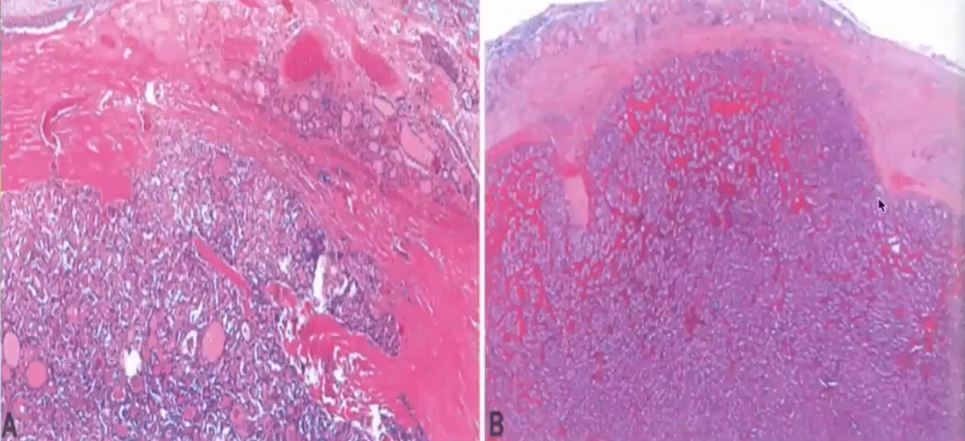
图A:“蘑菇状”包膜侵犯,但未穿破。
图B:“穹顶样”:广基范围内肿瘤细胞顶起纤维结缔组织被膜,但未穿破。
可疑血管浸润——UMP
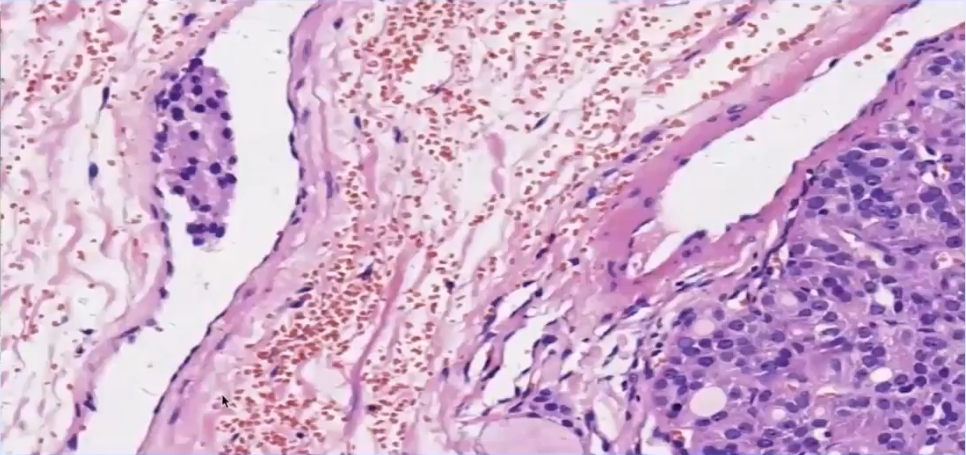
瘤巢周围缺乏血管内皮被覆及纤维素性血栓
-
大小和形态——核增大/重叠/拥挤/拉长;
-
核膜不规则——轮廓不规则/核沟/核内假包涵体;
-
染色质特征——透明/玻璃状核
以上三条各占1分,总分0-3分
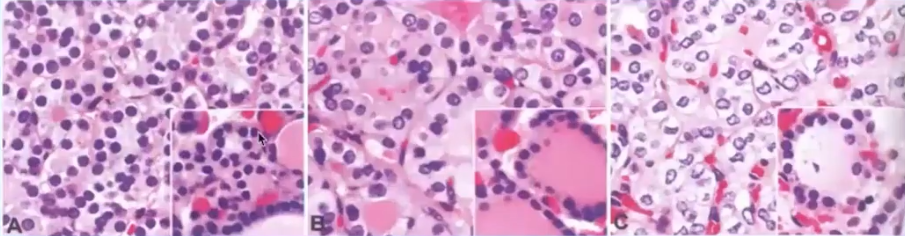
图A:1分——大小和形态(+);核膜不规则(-);透明核(-)
图B:2分——核增大;核膜不规则(+);透明核(-)
图C:3分——核增大;核膜不规则(+);透明核(+)
2.3具有乳头状癌细胞核特点的非浸润包裹型滤泡性肿瘤(NIFTP)
非浸润+(可疑)PTC细胞核(PTC细胞学评分2/3分)
2017新分类影响:
-
良性增生——交界性病变的更新:
原“可疑浸润的腺瘤样增生”——UMP
原“边界清楚的非典型腺瘤样增生”——NIFTP
-
癌——交界性病变的更新:
原“非浸润性滤泡亚型PTC”——NIFTP
-
单纯肿瘤切除+随访
NIFTP新命名符合非侵袭性包裹性滤泡亚型PTC特点:
1.重要形态学特征——滤泡状生长模式和乳头状癌的细胞核特点;
2.不具有侵袭性;
3.可通过寻找驱动突变基因明确肿瘤生物学性质;
4.复发几率极低。
NIFTP的诊断标准也被明确:
1.包膜完整或边界清楚(厚/薄/无包膜);
2.滤泡状生长模式(微/正常/大滤泡),伴乳头结构<1%、无砂粒体、<30%实性/梁状/岛状生长模式;
3.核评分2-3分;
4.无血管或包膜浸润(充分取材情况下);
5.无肿瘤坏死;
6.核分裂活性不高(每10个高倍视野下小于3个)。
四、甲状腺癌的分子检测及临床应用进展
(一)甲状腺癌分子特征概述
-
基因简单的疾病,每个肿瘤中的突变数量相对较少;
-
在超过90%的甲状腺癌中发现了驱动突变和基因融合,使其成为分子特征了解最彻底的人类恶性肿瘤之一;
-
总体上,最常见的改变是BRAF和RAS点突变以及RET/PTC和PAX8/PPARy染色体重排(产生融合基因);
-
高分化甲状腺癌中的驱动基因变异是相互排斥的(中位数=每个肿瘤1个突变);
-
去分化甲状腺癌会积累额外的基因改变,即所谓的晚期变异(中位数=每个肿瘤6个突变);
-
染色体重排(以及由此产生的基因融合)与辐射有关;
-
大多数体细胞突变不是甲状腺特异的,常见于各种其他的实体癌。
多步致癌作用:
-
甲状腺癌是通过多种遗传改变的积累和信号通路的逐渐紊乱而发展起来的;
-
BRAF和RAS突变以及RET/PTC重排是早期变异,TP53突变是典型的晚期变异。
(二)乳头状癌(PTC)
1.B-RAF突变
-
30-90%的PTC可检测出b-raf点突变(欧美30-60%,亚洲70-90%)
-
几乎都是V600E点突变,只有1-2%是K601E突变——滤泡亚型PTC
-
与肿瘤亚型相关:
多见于——经典型、高细胞亚型(60-95%)
不见于——滤泡亚型(RAS)、儿童实性梁状亚型(RET-PTC)
还可见于20-40%的低分化岛状癌、25-40%的间变性未分化癌,但从未在FTC或良性甲状腺结节中发现。
检测到即意味着恶性!
-
检测方法:
基于DNA:直接(Sanger)测序、实时PCR、NGS
免疫组化:VE1突变蛋白
弥漫强阳性着色有意义
抗体贵
仅能检测V600E表型
2.RET/PTC重排(融合)
-
与多种融合伴侣融合(已报道20多种)——导致有功能的RET酪氨酸激酶过度产生——激活下游MAPK和PI3K-AKT通路;
-
最常见的重排类型是RET/PTC1(由RET与CCDC6基因融合形成)和RET/PTC3(由RET与NCOA4基因融合形成)
-
PTC中的检出率报道差异大(5-35%)——与检测手段和地域有关
-
与肿瘤亚型相关:
与辐射相关的儿童实性梁状型PTC
弥漫硬化型PTC
-
检测方法:
免疫组化:目前没有可靠的抗RET抗体
RT-PCR(新鲜或冷冻组织)、FISH(石蜡标本)、NGS
多个独特断裂位点存在,而通常使用RT-PCR检测,其所用的引物仅能覆盖最典型的RET基因融合位点——上述检测方法存在假阴性
NGS(例如,基于RNA平台)
阳性结果几乎可以预测100%恶性风险!
3.其他少见的突变或融合
(1)RAS突变
-
虽然RAS是MAPK和PI3K-AKT通路的经典双重激活剂,但RAS突变在甲状腺肿瘤发生中优先激活PI3K-AKT通路(与FTC更密切);
-
占PTC的10-20%,几乎都是滤泡亚型PTC;
-
仅携带RAS突变的分化型甲状腺癌预后良好。
(2)TERT启动子突变
-
TERT是一种编码端粒酶逆转录酶,有助于干细胞或癌细胞的永生化;
-
高分化甲状腺癌中少见(PTC10%,FTC15%);
-
常见于侵袭性甲状腺癌——PDTC(30-40)、ATC(30-50%),广泛浸润性嗜酸细胞癌,高细胞亚型PTC(20%);
-
诊断意义:在良性甲状腺病变和MTC中未发现——阳性即100%恶性!
-
预后意义:与高分化甲状腺癌(PTC和FTC)的疾病持续/复发、远处转移、放射抗性和更高的死亡率相关。
(3)其他罕见的突变
-
FTC、PTC和ATC中的IDH1(合计10-20%);
-
经典型PTC中的EGFR(5%);
-
TP53、PIK3CA、AKT1突变、染色体不稳定性增加——与PTC去分化相关。
(三)滤泡癌(FTC)
1.RAS突变
-
MAPK和PI3K-AKT通路的经典双重激活剂,但RAS突变在甲状腺肿瘤发生中优先激活PI3K-AKT通路(与FTC相关)
-
驱动基因
-
发生率:FA(20-40%)FTC(30-50%)、PTC(10%,滤泡亚型)、PDTC(20-40%)、ATC(10-50%)、MTC(25%)
-
存在多种同源体(H-ras,N-ras与K-ras)
-
检测方法
基于DNA:直接(Sanger)测序、实时PCR、NGS
NRASQ61R免疫组化,评价与b-rafVE1相似
-
临床意义
RAS突变预测甲状腺结节恶性的诊断价值低于BRAF,因为RAS突变也见于良性肿瘤;
仅携带RAS突变的分化型甲状腺癌预后良好。
2.PAX8/PPARγ重排
-
致癌机理不明;
-
PAX8/PPARγ重排发生率:FTC(30-40%),滤泡亚型PTC(5-30%),FA(5-20%);
-
少数病例存在CREB3L2/PPARγ重排.
-
检测方法:针对PPARγ设计
FISH、RT-PCR、NGS;
免疫组化(抗PPARγ抗体):辅助筛选工具,只有弥漫强阳性染色才应视为阳性(仍需分子验证)。
-
临床意义--尚不明
使用PAX8/PPARγ作为唯一标记(类似于RAS突变)预测恶性肿瘤的诊断价值不足,可以作为分子panel的一部分。
3.其他分子改变
(1)PIK3CA突变
晚期变异
FTC(5-10%)、PDTC(10%),和ATC(10-20%)。
(2)PTEN突变
PTEN是肿瘤抑制基因,其产物终止PI3K-AKT信号,
罕见:PTC1-2%,FTC10%,ATC(10-20%),
PTEN的胚系突变导致Cowden综合征,其特征是多发错构瘤和某些癌症的风险增加,包括乳腺癌和FTC。
(四)低分化和未分化甲状腺癌(PDTC、ATC)
分子遗传学复杂
(1)早期变异:RAS,RAF
(2)晚期变异:TP53,PI3KA,b-cat/CTNNB1,AKT1,ALK,PTEN,TERT……
目前的研究结果:
——显示从高分化甲状腺癌进展而来的ATC比开始发生是即为间变性肿瘤更常见
——部分研究显示P53、b-cat突变与ATC预后差相关
检测方法:NGS
发生率:
TP53:PDTC(10-40%)和ATC(50-80%)
PI3KA:10-20%
b-cat/CTNNB1:25-60%
AKT1:5-10%
ALK:5-10%
PTEN:10-20%
TERT:30-50%
其他分子机制:
mRNA表达谱
miRNA表达谱
InRNA
拷贝数变异
表观遗传学(甲基化)
遗传易感性(SNP)
(五)甲状腺分子检测的临床应用
1.辅助诊断
NCCN指南:推荐对于经FNA不能确定良恶性的甲状腺结节进行分子检测。如BRAF突变,RAS突变,RET/PTC重排等。
2.制定个体化治疗方案
术前辅助判断手术方式和范围
术后协助判断预后,确定靶向治疗方案(BRAF、ALK、NTRK、RET……)
(六)小结:
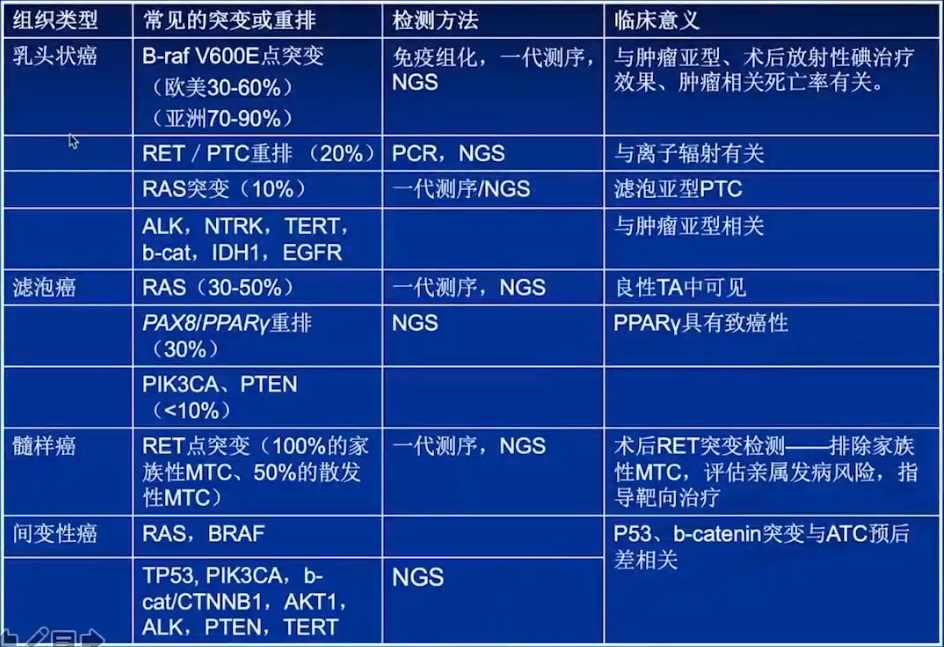
常见甲状腺癌中的分子特征
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#病理诊断# #甲状腺肿瘤#
90