这项技术,有望从根本上治疗癌症
2022-04-11 文竞择 生物探索
2021年6月27日,首个体内CRISPR基因编辑安全性和效果的临床数据在NEJM公布,结果表明单次静脉注射CRISPR可精确编辑体内的靶细胞,治疗基因疾病。
导语
众所周知,在体基因编辑可以通过对体内靶细胞的基因编辑,敲除致病基因或插入功能性基因,以治疗从前被认为无法治愈的疾病,如遗传病和癌症等。2020年,CRISPR基因编辑技术荣获诺贝尔化学奖;2021年6月27日,首个体内CRISPR基因编辑安全性和效果的临床数据在NEJM公布,结果表明单次静脉注射CRISPR可精确编辑体内的靶细胞,治疗基因疾病。
基因编辑技术可从根本上治疗癌症
基因编辑技术多用于基因功能研究和疾病治疗,常用工具包括锌指核糖核酸酶(Zinc Finger Endonuclease,ZFN)、转录激活样效应因子核酸酶(Transcription Activator Like Effector Nuclease,TALEN)和CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats-associated)系统(表1)。
表1 三种基因编辑技术的比较
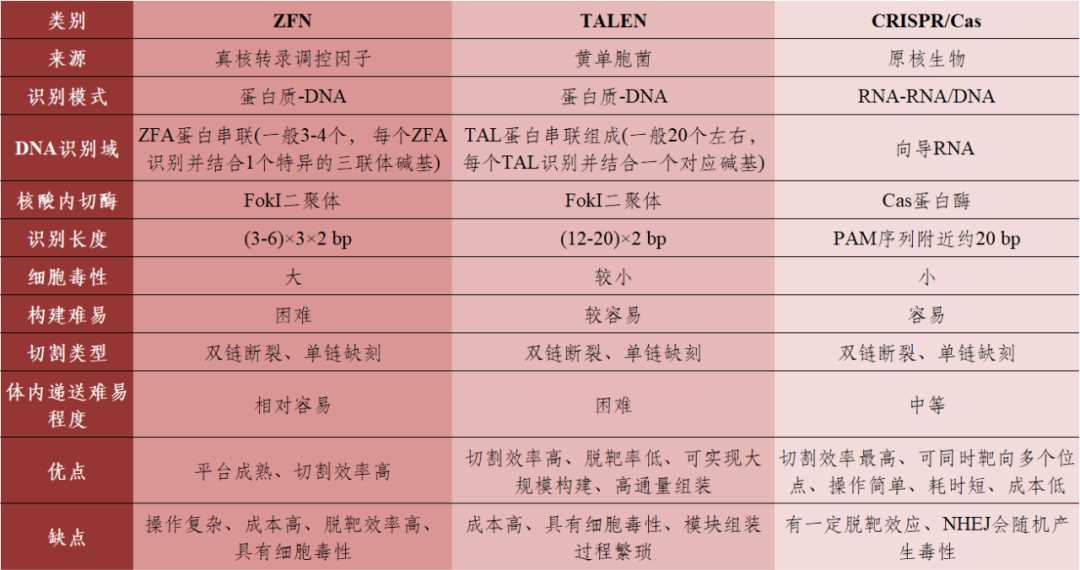
数据来源:[1]丨制表:生物探索编辑团队
CRISPR/Cas系统广泛存在于细菌和大部分古生菌的天然免疫系统,主要由两部分组成:编码Cas蛋白的基因和由前导序列、不连续的重复序列、长度相似间隔序列组成的CRISPR序列。其应用条件包括:待编辑区域有保守的PAM序列(Proto-spacer Adjacent Motifs)、可与PAM上游序列互补配对的sgRNA和发挥功能的Cas酶。与传统的基因编辑工具相比,CRISPR/Cas系统优点突出。
根据效应蛋白的不同,CRISPR/Cas系统分为两类(图1):
- 1类系统是由多种不同效应蛋白组成的复合物,通常形成多亚基蛋白crRNA(CRISPR RNA)效应复合物,包括I、Ⅲ和Ⅳ三种类型和12种亚型;
- 2类系统只有单个效应蛋白(Cas9、Cas12、Cas13)进行目的基因的干扰,约占CRISPR/Cas系统的10%,包括II、Ⅴ和Ⅵ型和9种亚型,除了切割DNA,2类系统中的Cas13a (C2c2)可以靶向切割ssRNA (Single-stranded Ribonucleic Acid)。
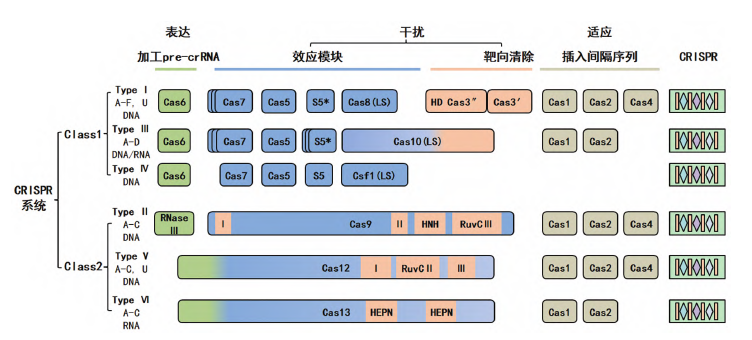
图1 CRISPR/Cas系统的分类(图源:[1])

CRISPR/Cas系统的作用机制分为三个阶段(图2):
(1) 适应:摄取外源遗传物质
外源遗传物质入侵后,CRISPR/Cas系统识别外源基因的PAM序列,并从PAM序列附近获取部分外源片段形成间隔序列,从5’端整合到CRISPR重复序列之间使之具有“记忆”,可在下次感染时对入侵核酸特异性破坏,多数已知的CRISPR/Cas系统在此过程中需要Cas1-Cas2复合物的参与。
(2) 表达:crRNA的表达和成熟
CRISPR区域首先转录成pre-crRNA,之后被切割为包含1个间隔序列和部分重复序列的成熟crRNA,直接或进一步加工后与Cas蛋白结合成“效应子”或“干扰”复合物,具有特异性核酸内切酶活性。
(3) 干扰:对外源遗传物质进行剪切
复合物在crRNA的引导下沿外源遗传物质进行扫描,当遇到PAM序列附近有crRNA匹配区域,效应复合物进行切割促进核酸分子降解,外源核酸表达沉默。
Cas9属于2类Ⅱ型CRISPR系统,自2013年在人类细胞中得到验证以来成为应用最广泛的基因组编辑工具,为了使其有更大的作用范围,这一工具的开发也在不断深入。
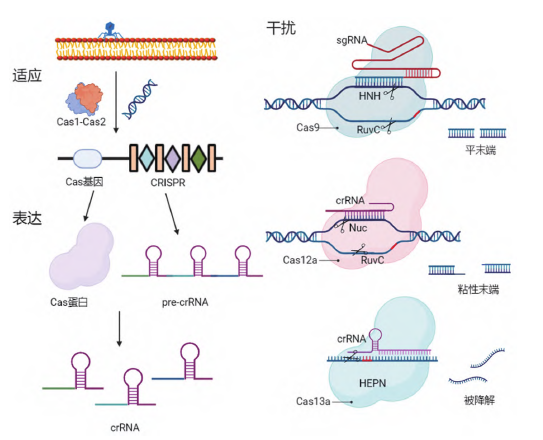
图2 CRISPR/Cas作用机制示意图(图源:[1])
肿瘤是由体细胞突变积累形成的,根据癌症类型有不同的突变基因及突变位点。传统的癌症治疗方法效果有限,复发性高,通过基因编辑技术使致癌基因失活或抑癌基因激活,进而改变下游信号通路进行癌症治疗,可以从根本上治疗疾病。CRISPR/Cas9作为一种基因编辑工具,可用于开展同源定向修复、基因敲除、插入、染色体异位、染色质重组、疾病诊断等工作。目前,CRISPR/Cas9技术已应用于肿瘤治疗中的基础研究(表2)及生物治疗(表3)。
表2 CRISPR/Cas9在肿瘤治疗中的基础研究
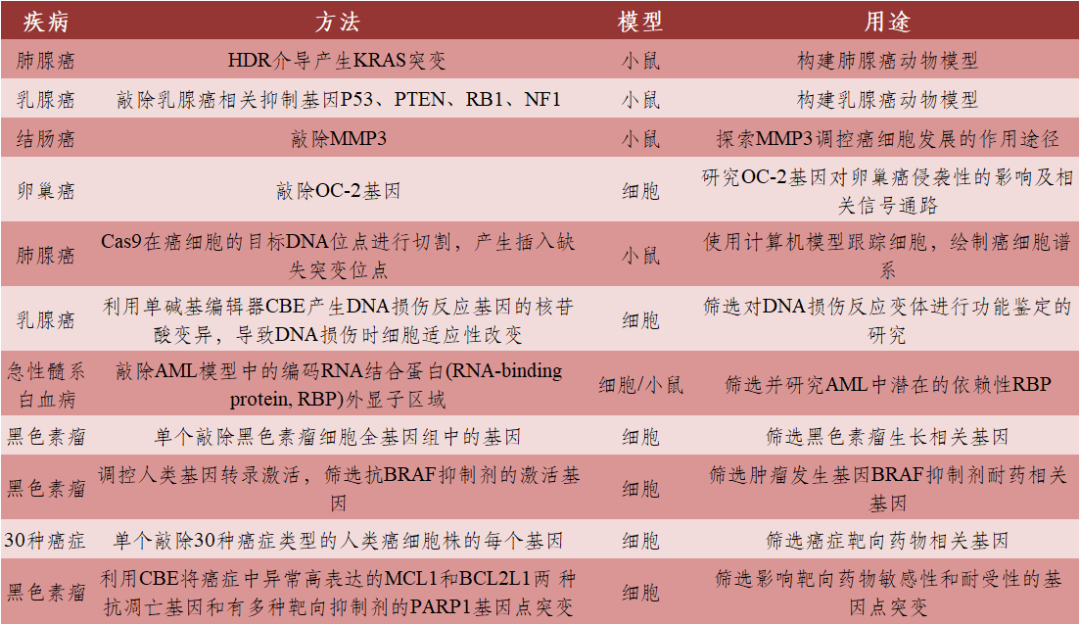
数据来源:[1]丨制表:生物探索编辑团队
表3 CRISPR/Cas9介导的肿瘤生物治疗
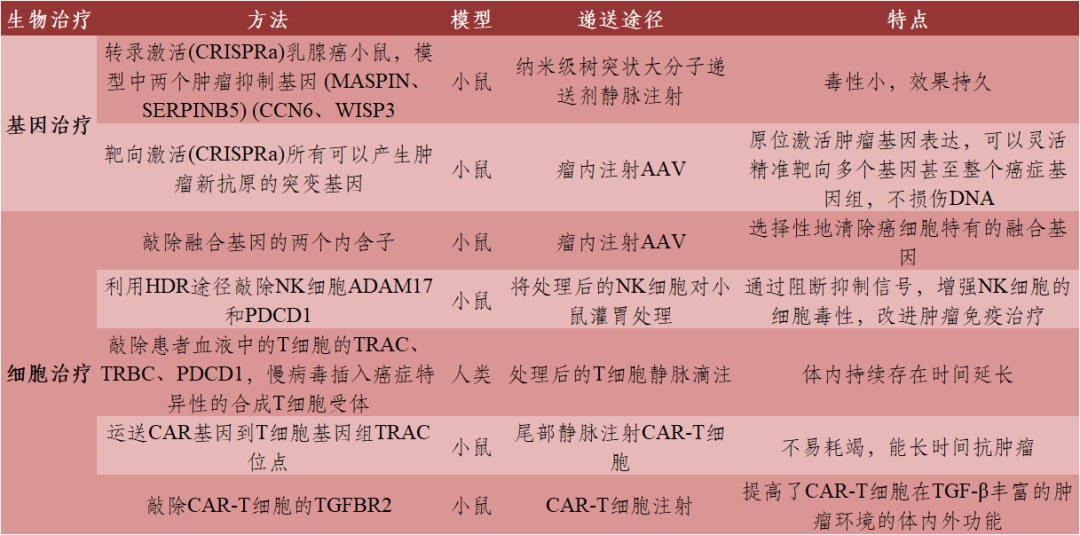
数据来源:[1]丨制表:生物探索编辑团队
CRISPR技术优势突出,临床应用如何
2021年6月17日,The New England Journal of Medicine(NEJM)报道了世界首例支持体内CRISPR基因编辑安全性和效果的临床数据(图3)。此项研究由伦敦大学医学部国家淀粉样变性中心、伦敦圣乔治大学、皇家自由学院、奥克兰大学和新西兰临床研究等团队共同完成,并由Intellia Therapeutics和Regeneron联合赞助。

图3 研究成果(图源:NEJM)
转甲状腺素蛋白淀粉样变性(ATTR)是一种危及生命的疾病,其特征是错误折叠的转甲状腺素蛋白(TTR)蛋白主要在神经和心脏中进行性积累。NTLA-2001是体内基因编辑治疗剂,旨在通过降低血清中TTR浓度来治疗ATTR淀粉样变性。NTLA-2001基于成簇规则间隔的短回文重复序列和相关的Cas9核酸内切酶(CRISPR-Cas9)系统,通过脂质纳米颗粒封装Cas9蛋白的信使RNA和靶向TTR的单向导RNA(图4)。
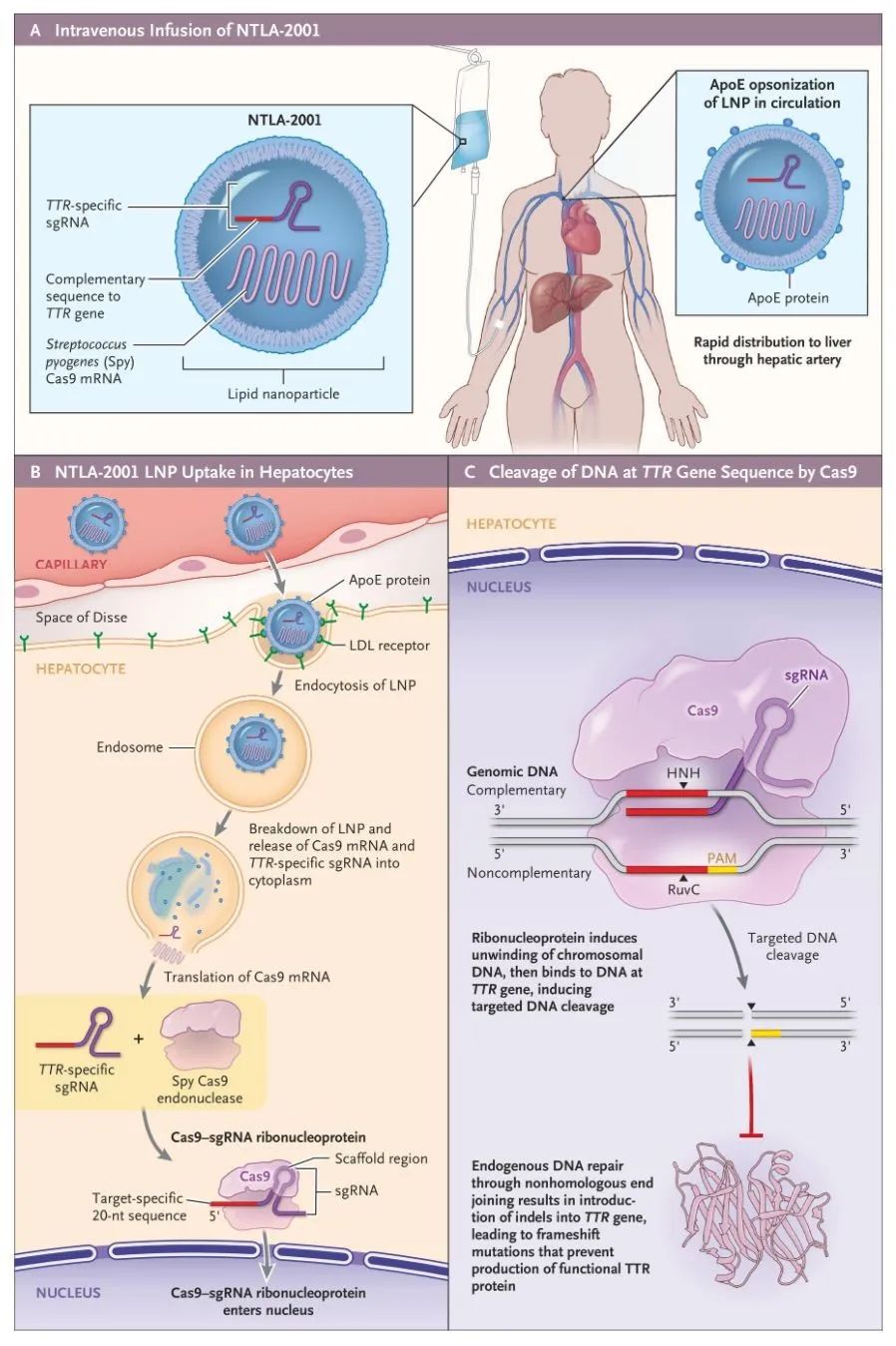
图4 NTLA-2001的作用机制(图源:NEJM)
此项研究公布的中期临床数据涵盖了在1期临床试验中接受治疗的6名ATTR患者,其中3名接受剂量为0.1 mg/kg的NTLA-2001的治疗,另外3名接受的剂量为0.3 mg/kg。通过检测病人血清中TTR浓度水平、NTLA-2001体内药理学、NTLA-2001体外评估、评估不良事件和脱靶效应得到如下结果:
1、接受NTLA-2001治疗的第28天,单剂量的NTLA-2001能够剂量依赖性降低患者血清中的TTR水平。0.1 mg/kg剂量组TTR水平平均下降52%;0.3 mg/kg剂量组TTR水平平均下降87%,其中一名患者TTR水平下降96%;
2、接受NTLA-2001治疗的第28天,NTLA-2001表现出良好的安全性,没有发现严重不良事件和肝脏问题。所有不良事件均为轻度不良事件(1级);
3、治疗剂量的NTLA-2001并未产生“脱靶效应”。
此项研究资金资助人Intellia总裁兼首席执行官John Leonard博士表示:“有史以来首次体内基因编辑临床数据表明,通过单次静脉输注CRISPR系统,便可在患者体内精准编辑靶细胞,从而治疗遗传疾病。NTLA-2001中期结果验证了假设,其具有在单次给药的情况下中止和逆转ATTR的潜力。解决将CRISPR/Cas9系统靶向递送至肝脏的挑战,也为基于我们的技术平台治疗其他遗传疾病打开了大门,我们计划快速推进和扩展我们的研发管线。这些数据让我们相信,我们正在真正开启医学的新时代。”
题图来源:Spotlight Therapeutics官网,仅用于学术交流。
参考资料:
[1]马孟丹,杨育宾,陈延萍,等.CRISPR/Cas9技术及其在肿瘤研究与治疗中的应用[J]生命科学,2021,33(11):1370-1381.DOI:10.13376/j.cbls/2021153.
[2]Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021 Aug 5;385(6):493-502. doi:10.1056/NEJMoa2107454. Epub 2021 Jun 26. PMID: 34215024.
[3]https://www.crunchbase.com/organization/spotlight-therapeutics/company_financials.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言