Nature:神经元清除垃圾的新途径——exopher
2017-02-13 佚名 生物探索
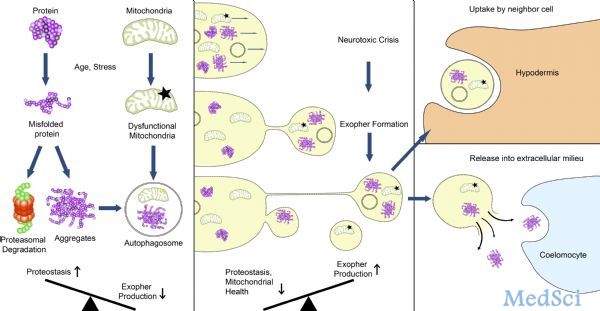
许多与年龄相关的神经退行性疾病都与蛋白质聚集和线粒体损伤密切相关。神经元需要及时处理这些“垃圾”才能维持正常功能。近日,发表于Nature杂志上的研究报道了神经元内的一种新的清除机制——exopher。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
51
#新途径#
63
好东西大家一起学!
111
新发现,学习了
110