PLoS Gene:朊病毒成分和基因剂量或可控制亨廷顿氏症
2012-06-17 T.Shen 生物谷
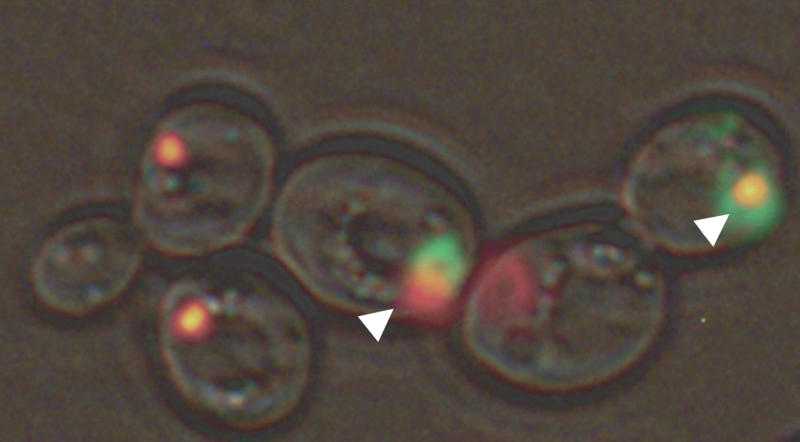
如图显示沉积体中的多聚谷氨酰胺(绿色)可以隔离朊病毒转录释放因子Sup35(红色)。(Credit: Yury Chernoff) 近日,来自乔治亚理工学院的研究者研究揭示了亨廷顿氏症病人的细胞损伤效应,这就为识别治疗的靶点提供了一些新的线索和方法。亨廷顿氏症可以引发大脑神经细胞渐进性崩溃,并且影响个体的运动、认知以及智力。从遗传学角度来讲,这种疾病和亨廷顿基因的突变密切相关,亨廷顿基因可以使得

如图显示沉积体中的多聚谷氨酰胺(绿色)可以隔离朊病毒转录释放因子Sup35(红色)。(Credit: Yury Chernoff)
近日,来自乔治亚理工学院的研究者研究揭示了亨廷顿氏症病人的细胞损伤效应,这就为识别治疗的靶点提供了一些新的线索和方法。亨廷顿氏症可以引发大脑神经细胞渐进性崩溃,并且影响个体的运动、认知以及智力。从遗传学角度来讲,这种疾病和亨廷顿基因的突变密切相关,亨廷顿基因可以使得其蛋白质将谷氨酰胺包括进来扩大其长度范围。
这项研究中,研究者表示亨廷顿蛋白的毒性效应并不仅仅是由蛋白质长度的扩张引起的,也有可能是因为细胞中存在其它的蛋白质所导致的。研究者将携带有多聚谷氨酸盐的亨廷顿蛋白转入酵母细胞中,研究其不同的毒性差异。研究者阐明了调节多聚谷氨酸盐在细胞中毒性的遗传及表观学机制,并且通过细胞中预存的蛋白质建立了一种新方法来发现新的潜在治疗靶点,相关研究成果刊登在国际杂志PLoS Genetics上。
人类细胞中扩大的亨廷顿蛋白质团块可以被沉积体运输以及储存,直到这些团块可以被移出机体。沉积体的储存小室被认为可以保护细胞的内容物免于毒性损伤,当前的研究揭示了沉积体中的亨廷顿分子依然对细胞存在毒性。细胞中沉积体的形成包含了朊病毒病毒样的Rnq1蛋白质,可以检修少亨廷顿蛋白对细胞的毒害。然而当朊病毒以翻译释放因子Sup35形式存在的时候,亨廷顿蛋白就依然保持其毒性。
Rnq1和Sup35并不会导致朊病毒本身致病,研究者的结果也揭示了细胞中朊病毒的成分也会导致产生毒性,目前研究者并不清楚是否多聚谷氨酰胺可以隔离机体Sup35和Sup45释放因子,但是研究者的这项研究揭示了有机体可以通过细胞蛋白组分而改变,并且影响其对多聚谷氨酰胺疾病如亨廷顿氏症的敏感性。(生物谷Bioon.com)
编译自:Key to Controlling Toxicity of Huntington's Disease Protein May Be Cell Contents
编译者:天使托

doi:10.1371/journal.pgen.1002634
PMC:
PMID:
Polyglutamine Toxicity Is Controlled by Prion Composition and Gene Dosage in Yeast
He Gong1¤a, Nina V. Romanova1¤b, Kim D. Allen1¤c, Pavithra Chandramowlishwaran1, Kavita Gokhale1, Gary P. Newnam1, Piotr Mieczkowski2, Michael Y. Sherman3, Yury O. Chernoff1*
Polyglutamine expansion causes diseases in humans and other mammals. One example is Huntington's disease. Fragments of human huntingtin protein having an expanded polyglutamine stretch form aggregates and cause cytotoxicity in yeast cells bearing endogenous QN-rich proteins in the aggregated (prion) form. Attachment of the proline(P)-rich region targets polyglutamines to the large perinuclear deposit (aggresome). Aggresome formation ameliorates polyglutamine cytotoxicity in cells containing only the prion form of Rnq1 protein. Here we show that expanded polyglutamines both with (poly-QP) or without (poly-Q) a P-rich stretch remain toxic in the presence of the prion form of translation termination (release) factor Sup35 (eRF3). A Sup35 derivative that lacks the QN-rich domain and is unable to be incorporated into aggregates counteracts cytotoxicity, suggesting that toxicity is due to Sup35 sequestration. Increase in the levels of another release factor, Sup45 (eRF1), due to either disomy by chromosome II containing the SUP45 gene or to introduction of the SUP45-bearing plasmid counteracts poly-Q or poly-QP toxicity in the presence of the Sup35 prion. Protein analysis confirms that polyglutamines alter aggregation patterns of Sup35 and promote aggregation of Sup45, while excess Sup45 counteracts these effects. Our data show that one and the same mode of polyglutamine aggregation could be cytoprotective or cytotoxic, depending on the composition of other aggregates in a eukaryotic cell, and demonstrate that other aggregates expand the range of proteins that are susceptible to sequestration by polyglutamines.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Gene#
48
#亨廷顿#
66