基因组医学| 脑肿瘤mRNA新产品和相关疫苗的开发和应用
2024-02-18 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
研究员开发了针对特定肿瘤预测的个性化 mRNA 疫苗,并在临床前模型中验证了这种策略在提高免疫反应和潜在治疗效果方面的潜力。
星形母细胞瘤(GBM)和髓母细胞瘤(MB)由于具有高度的良性和肿瘤异质性,免疫治疗治疗效果不佳,被认为是难治性。其中髓母细胞瘤(MB)是儿童常见的恶性肿瘤,占儿童颅内肿瘤的15%-20%,大约有85%的髓母细胞瘤都发生于18岁以下。
肿瘤全谱精准定位,包括新的精准定位和减少免疫逃逸。 ,mRNA疫苗获得了快速开发和广泛使用,取得了可编码性、易于合成的优势,能够同时实现多种肿瘤有效,应用潜力巨大。
2024年1月,来自美国佛罗里达大学医学院的 Duane A. Mitchell 团队在Genome Medicine上发表了题为“基于mRNA的精确靶向恶性脑肿瘤中的新抗原和肿瘤相关抗原”的 文章,开发了针对特定肿瘤预测的个性化 mRNA 疫苗,并在临床前模型中验证了这种策略在提高免疫反应和潜在治疗效果方面的潜力。

为了预测作者和鉴定试剂盒,首先建立了一个免疫基因组学平台ORAN,并建立了肿瘤选择性基因富集平台,用于生产肿瘤突变mRNA治疗药物TOFU mRNA,在单一疫苗中编码大量肿瘤通过RNA-seq和全外显子组测序(WES)测定GBM肿瘤KR158-Luc(Kluc)和GL261模型,以及小鼠MB肿瘤NSC和Ptch模型的基因表达谱,并他们鉴定了Kluc模型中的12个新提示和15个TAA,GL261肿瘤模型中是192个新提示和37个TAA,NSC肿瘤模型中的6种新句子且和14种TAA以及Ptch肿瘤模型中的19种新句子和13种TAA(图1b),这些TOFU句子的富集率均达80%(图1c-f)。接着对这些潜在靶点进行疫苗开发并引发T细胞选择的实验。
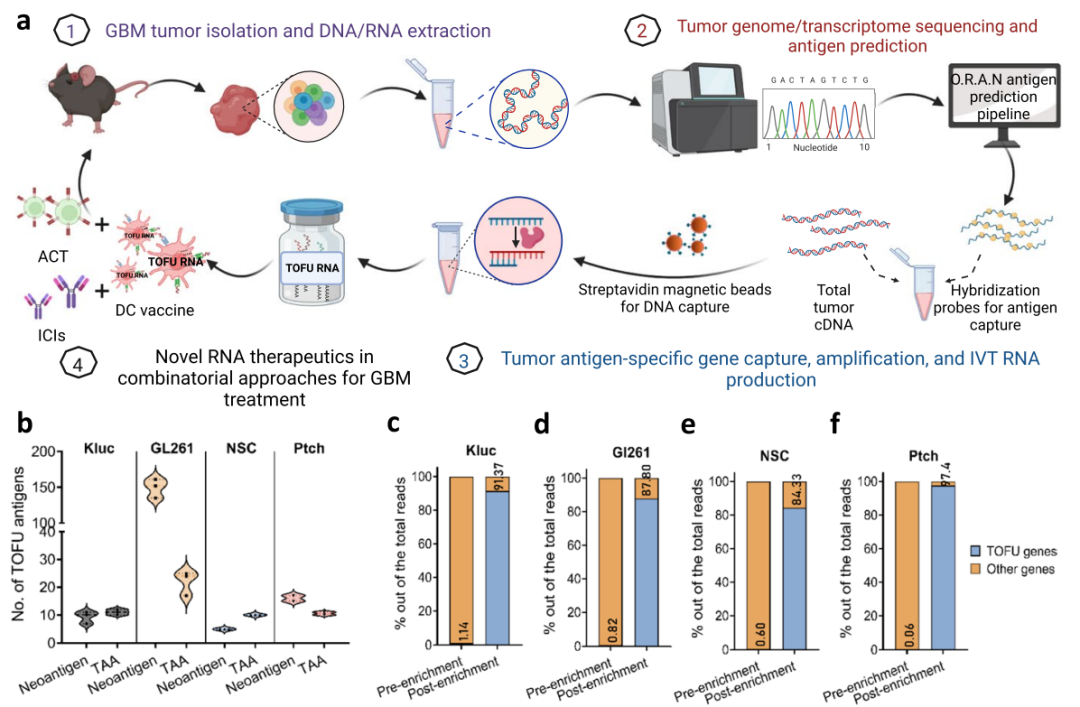
图1 TOFU mRNA的筛选流程及富集率
为了验证预测的肿瘤修复的免疫原性,用TOFU mRNA转染的树突状细胞(TOFU-DC)作为前置递呈细胞在体内引发T细胞反应,通过IFN-γ情况评估T细胞在体外的反应由不同TOFU编码的抗原表位刺激后对Kluc、GL261、NSC和Ptch TOFU抗原的反应性。与不相关肽相比,Kluc、GL261、NSC和Ptch的部分TOFU mRNA抗原肽均引起了相应的T细胞IFN-γ的产生增加(图2),证实了TOFU mRNA的生物活性,可以产生提示T细胞反应。
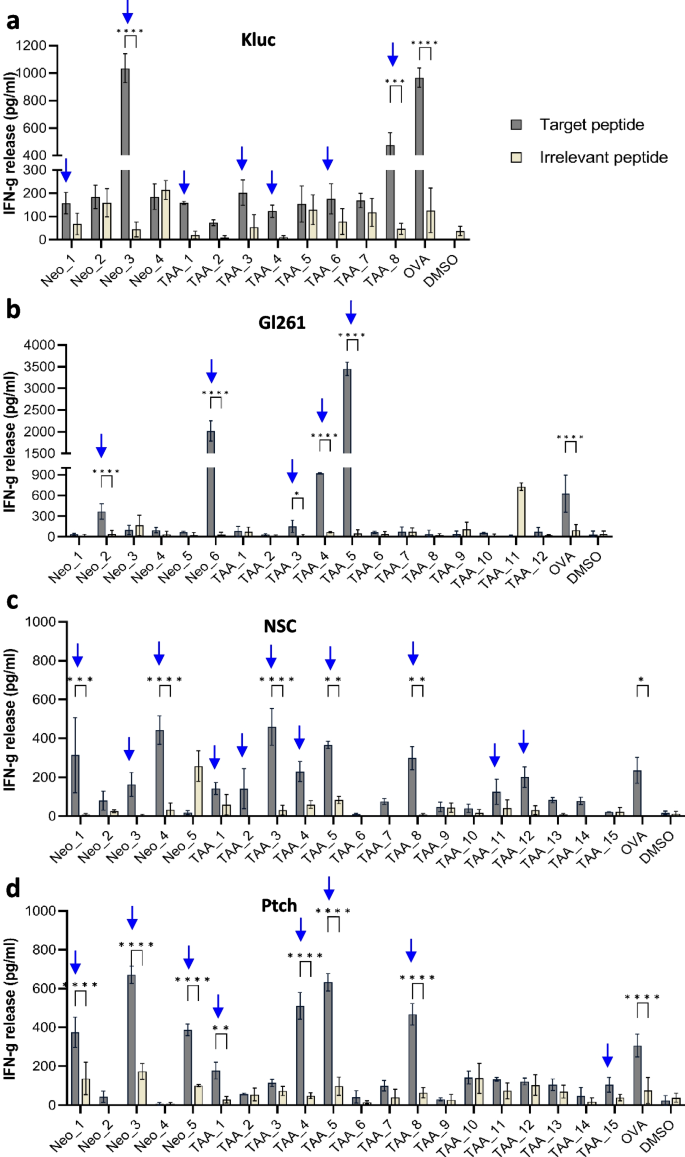
图2 TOFU突变的引发反应验证
接下来,作者研究了TOFU mRNA疫苗与抗PD-1肿瘤检查点免疫疗法(ICI)联合使用的抗功效。以GBM荷瘤小鼠为实验对象,实验组每周接种3剂TOFU- DC疫苗和抗PD-1抗体(TOFU-DCs+PD-1),分别注射Ctl-DC和同种型IgG抗体作为对照(Ctl-DC+IgG、Ctl-DC+PD-1和TOFU-)通过生物发光测量,TOFU-DCs+PD-1治疗在震动有效Kluc肿瘤进展方面强度更明显,中位生存期为54.5天,而Ctl-DCs+IgG组为31天,Ctl- DCs+PD-1组为36天,TOFU-DCs+IgG处理组为40天。TOFU-DCs+PD-1治疗在GL261模型中也较坚硬有较好的效果,中位生存期为62天(图3)。进一步通过流式细胞技术对外周T细胞的分析,在TOFU-DCs+PD-1处理的Kluc模型样本中,CD4+和CD8+T细胞的PD-1表达增加;同时,免疫学反应灵敏分析结果显示,清除、清除转运和TNF家族信号转导增加,说明对肿瘤微环境进行了重编程。这些结果表明TOFU mRNA疫苗与抗PD-1疫苗具有良好的作用。
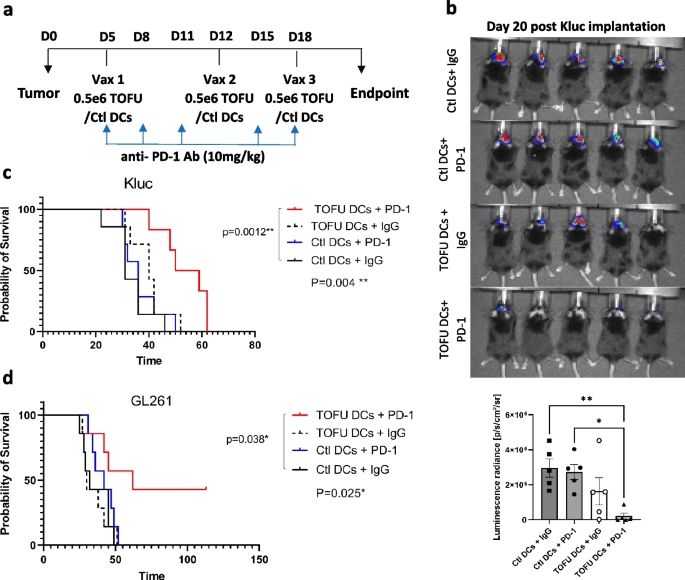
图3 TOFU mRNA疫苗联合ICI的治疗效果
联合治疗治疗时间地图;b 内部发光成像检测Kluc肿瘤生长情况;c 接受Kluc TOFU DC + PD-1和对照治疗(Ctl DCs + IgG、Ctl DCs + PD-1和 TOFU DCs + IgG)治疗的Kluc荷瘤小鼠的S曲线;d GL261 TOFU DCs+PD1联合治疗和对照治疗的GL261荷瘤小鼠的生存曲线
过继性免疫细胞疗法(ACT)是一种采用mRNA转染的DC在体外扩增肿瘤抗原特异性T细胞,然后在9戈瑞(Gy)的全身照射(TBI)后将其与造血干细胞一起过继转移到荷瘤宿主中的治疗方法。作者将TOFU mRNA用于ACT(TOFU-ACT),并每周注射TOFU mRNA-DC维持抗肿瘤免疫力。与未治疗的小鼠相比,TOFU-ACT治疗显著延缓了肿瘤进展并显着提高了Kluc和GL261荷瘤小鼠的存活率(图4a-d)。分离CD45+免疫细胞和CD45-肿瘤和正常脑细胞并进行了单细胞RNA-seq,与未治疗(69%)和9Gy TBI治疗的小鼠(49.3%)相比,TOFU-ACT治疗小鼠(21.5%)的肿瘤细胞群显著减少(图4e)。肿瘤细胞的泛癌通路分析显示,与未治疗的小鼠相比,TOFU-ACT治疗小鼠的剩余肿瘤细胞免疫反应下调,这提供了肿瘤免疫抵抗和逃逸机制的可能性。
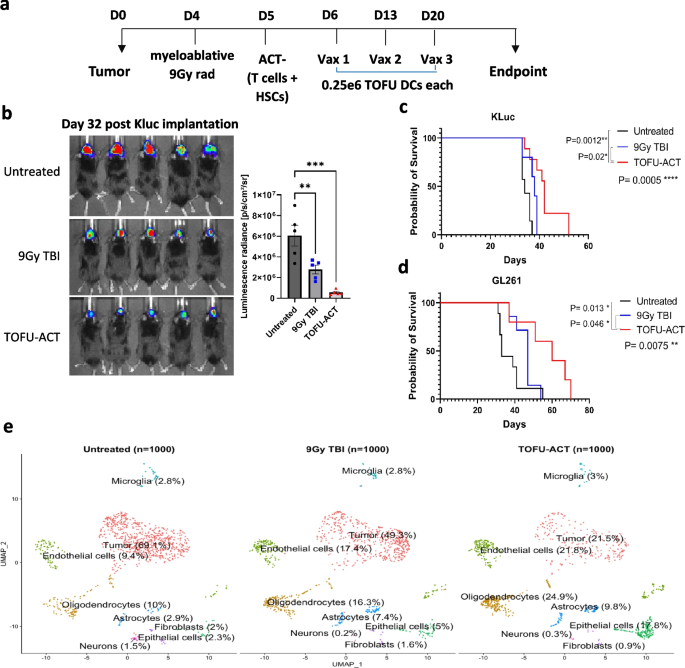
图4 TOFU mRNA疫苗联合ACT的治疗效果:a 用9Gy TBI和HSC进行宿主预处理后,TOFU mRNA疫苗加ACT联合治疗给药时间示意图; b肿瘤植入后第32天使用体内发光成像进行Kluc肿瘤检测; c 用Kluc TOFU-ACT和对照处理治疗的Kluc荷瘤小鼠的存活曲线; d 用GL261 TOFU-ACT和对照处理处理的GL261荷瘤小鼠的存活曲线
最后,作者还对TOFU-ACT联合治疗实验中小鼠模型肿瘤中的CD45+单细胞数据进行了全面分析,发现与对照组相比,TOFU-ACT治疗的小鼠M1巨噬细胞增加,M2巨噬细胞减少,表明肿瘤微环境的促炎效果。对T细胞亚群的分析表明,TOFU-ACT治疗的动物的肿瘤微环境中T细胞向效应或效应记忆T细胞转变。对T细胞毒性和耗竭标志物的基因表达分析显示,与未处理的小鼠相比,TOFU-ACT治疗小鼠中T细胞耗竭标志物Pdcd1、CTLA4、Tigit和Lag3的表达显著降低,细胞毒性标志物Prf1、Nkg7、Gzma、Gzmb和Gzmk的表达显著上调,说明TOFU-ACT治疗增强了T细胞的作用(图5)。作者还通过TCR-seq比较了TOFU-ACT治疗的小鼠与对照组的多样性、克隆扩增和T细胞受体库验证了治疗组小鼠T细胞多样性降低、克隆扩增和超扩增克隆的响应。
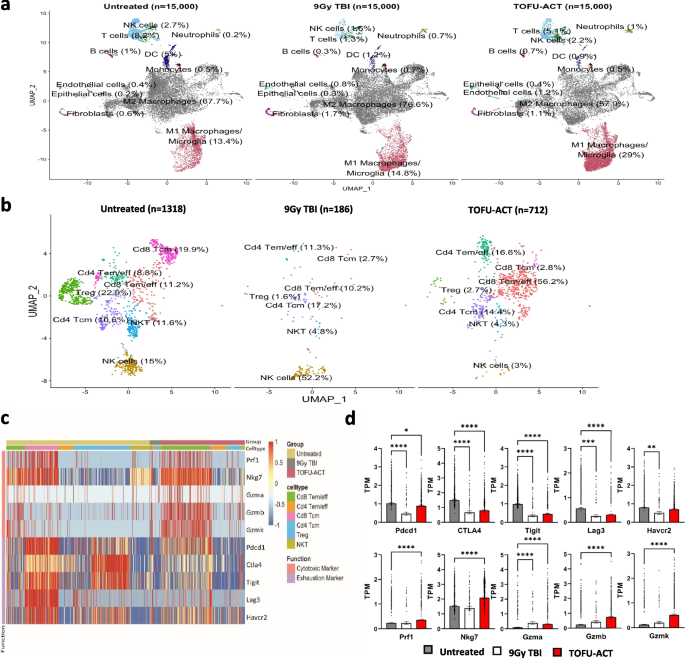
图5 TOFU-ACT治疗后肿瘤微环境重编程
综上所述,该研究发现预测和生产针对胶质母细胞瘤和髓母细胞瘤的TOFU mRNA疗法的可行性,并验证了预测抗原的免疫原性和TOFU mRNA 疫苗与标准免疫治疗方法(ICI和ACT)在多种临床前脑肿瘤模型中的疗效。TOFU mRNA定向免疫疗法通过刺激T细胞活化和效应,并改变免疫抑制性肿瘤微环境来提高肿瘤模型小鼠的生存率。该研究为胶质母细胞瘤和髓母细胞瘤提供了新的治疗策略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















认真学习了
56
#mRNA# #髓母细胞瘤# #胶质母细胞瘤#
74