Nature: 蛋白复合体有望成为新的癌症治疗靶标
2016-10-30 生命奥秘/张洁 生命奥秘/张洁
科学家们发现,热激蛋白(Heat-shock protein, HSP)是大型蛋白复合体(英文名为epichaperome)的组成部件。鉴于这些蛋白复合体起到了维持肿瘤细胞存活的作用,所以有望成为治疗癌症的新靶点。科学家们发现,热激蛋白(Heat-shock protein, HSP)是大型蛋白复合体(英文名为epichaperome)的组成部件。鉴于这些蛋白复合体起到了维持肿瘤细胞存活的作用
科学家们发现,热激蛋白(Heat-shock protein, HSP)是大型蛋白复合体(英文名为epichaperome)的组成部件。鉴于这些蛋白复合体起到了维持肿瘤细胞存活的作用,所以有望成为治疗癌症的新靶点。科学家们发现,热激蛋白(Heat-shock protein, HSP)是大型蛋白复合体(英文名为epichaperome)的组成部件。鉴于这些蛋白复合体起到了维持肿瘤细胞存活的作用,所以有望成为治疗癌症的新靶点。
当肿瘤血管的形成速度跟不上肿瘤生长的速度时,肿瘤细胞就会处于应激条件下,例如缺乏氧气和营养。当细胞在应激条件下,热激蛋白(Heat-shock protein, HSP)就会被激活。Rodina 等人研究了HSP在人类癌症中的作用,结果发现HSP存在于一些肿瘤细胞的蛋白复合体中。
维持正确的3D结构是蛋白质发挥功能的前提。细胞内有专门的蛋白质量控制机制,以确保蛋白质正确折叠,形成正确的三维结构。具有结构缺陷的蛋白质只有两种去向:一,被折叠成正确的构象;二,如果结构异常过于严重,就只能被降解。蛋白质的质量控制受到分子伴侣蛋白的调节,这些分子伴侣往往具有促进蛋白折叠的作用。HSP就是一类常见的分子伴侣。人体细胞的HSP在正常条件下和在应激条件(如炎症或缺氧)下都是处于激活状态的。
Rodina等人借助生化技术研究人类癌症细胞中的HSP蛋白。结果他们发现,在一些癌细胞样品中,通过结构识别技术,Rodina等人可以将HSP90分离出来(他们把这类癌细胞称为“2型”癌细胞)。然而,在另外一些样本中,他们却无法通过结构识别技术来将HSP90分离出来,这可能是因为HSP与其它蛋白形成了蛋白复合体。他们把这种含有大型蛋白复合体的癌细胞称为“1型”癌细胞(图1)。
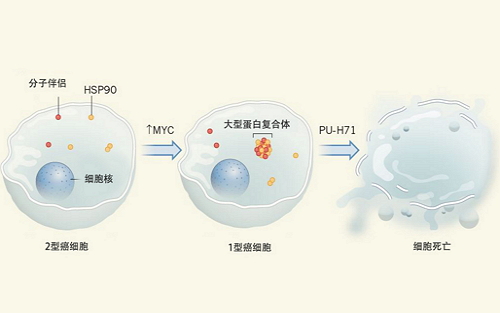
图1 Rodina等人发现在某些癌细胞(他们称之为2型细胞)中,HSP90等HSP蛋白,以及分子伴侣等与细胞发生应激反应相关的蛋白,能单独存在,或以小的复合体形式存在。然而,其它癌细胞(他们称之为1型细胞)中存在大的、由HSP90和其它蛋白质组成的蛋白复合体。如能增加2型细胞中MYC蛋白的表达,就能诱导这些蛋白复合体的形成。在体外用HSP90抑制剂PU-H71处理1型细胞后,蛋白复合体会降解,细胞走向死亡。因此,蛋白复合体可能可以成为新的癌症治疗靶标。
研究人员发现,在1型癌细胞中,HSP90与数十种其它蛋白质,包括参与调控蛋白折叠的支架和衔接蛋白结合在一起。Rodina等人把这个蛋白复合体结构称为epichaperome。相比之下,在2型癌细胞和非癌细胞中,HSP90仅与一小组蛋白质联系在一起,并且大多数HSP独立存在,或结合成小的复合体。
HSP90需要ATP的帮助才能发挥功能。因此,Rodina等人使用HSP90的抑制剂PU-H71处理细胞。(PU-H171能与HSP90的ATP结合位点相结合,从而阻断HSP90发挥作用。)他们发现,相比于独立存在的HSP90,PU-H171与epichaperome中的HSP90的结合更为紧密,且对1型癌细胞的杀伤作用明显强于2型癌细胞或非癌症细胞。这种差异不仅来自于HSP90的失活,因为研究者们发现,基因敲除或敲减其它HSP蛋白时,对1型癌细胞的杀伤作用也更明显。这表明,1型细胞的存活依赖于完整的epichaperome。
借助蛋白复合体分析技术和PU-H71处理,Rodina等人研究了不同类型的癌细胞的epichaperome。结果他们发现,60-70%的乳腺癌、胰腺癌、肺癌、白血病和其它癌症的细胞系中存在epichaperome,表明这种蛋白质复合物在多种癌症中都存在,具有作为癌症靶标的临床意义。并且,epichaperome的存在并不局限于某个基因或蛋白表达造成的癌症亚型。1型癌细胞中,癌相关蛋白MYC的表达水平也非常高。当MYC被下调时,epichaperome消失,而在2型细胞中过表达MYC会诱导epichaperome形成。因此,MYC是epichaperome形成的重要调节因素。
癌症治疗的理想靶标是存在于大多数癌细胞中,但不存在于正常细胞中。Rodina等人发现,1型癌细胞的epichaperome中含有HSP90,但是正常细胞中,HSP90主要单独存在。这意味着,epichaperome可能是临床靶点。
尽管成果喜人,但作者发现,不同肿瘤类型,甚至同种肿瘤类型中,epichaperome的形成都具有明显差异。这意味着,以epichaperome为治疗靶标,可能会出现药物抵抗变异体。此外,在许多癌症,如乳腺癌中,癌细胞的转移性迁移是死亡的主要原因,并且转移性细胞可能与初始原发性肿瘤不同。这些转移细胞对epipaperome的依赖程度,对靶向蛋白复合体的药物的响应都不明确,需要进一步研究。
然而,通过活检从患者身上获得转移性肿瘤组织存在较大困难。一方面,活检属于有创性操作;另一方面,在肺、骨和脑中的肿瘤无法取得。外周血循环肿瘤细胞的“液体活检”可能是一种替代策略,可用于评估转移细胞中的epichaperome。在癌症早期阶段,检测迁移到骨髓的肿瘤细胞或循环肿瘤细胞,也是一种早期诊断肿瘤迁移的方法。
Rodina等人的研究结果可能会产生更广泛的影响。许多细胞程序由依赖于大量蛋白质的信号传导途径组成,这些蛋白可以像形成epichaperome一样,形成稳定的复合物。例如,内质网中的分子伴侣机器可形成大的蛋白复合物,并且在应激条件下内质网伴侣机器的活力对癌细胞的存活起到关键作用。此外,癌症相关的ErbB受体可能形成高级结构的受体复合体。因此,发现其它大型癌症特异性蛋白复合物对于了解癌症生物学,设计新的癌症治疗策略具有重要意义。
Kai Bartkowiak & Klaus Pantel. Cancer: A shocking protein complex. Nature.538(1038): 322-323. 20 October 2016.doi:10.1038/nature19476
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#复合体#
52
#癌症治疗#
51
#治疗靶标#
46
#Nat#
56
很好,会继续关注的!
83
很好,会继续关注!
73
#靶标#
71
清华大学的研究成果
98
很好,不错,以后会多学习
82
继续关注
59