Nature:史上详细转录因子TFIID三维结构出炉,力助揭示人类基因表达秘密
2016-03-26 佚名 生物谷
你的DNA不只是控制你眼睛的颜色和你是否卷舌。你的基因含有制造你身体所有蛋白的指令,而这些指令是你的细胞让你存活所持续需要的。但是在此之前,基因表达在分子水平上如何运行的一些关键细节一直有点神秘。在一项新的研究中,来自美国加州大学伯克利分校、劳伦斯伯克利国家实验室和西班牙国家研究委员会(CSIC)罗卡索拉诺物理化学研究所的研究人员

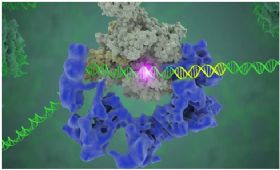
图片来自Eva Nogales/Berkeley Lab。
你的DNA不只是控制你眼睛的颜色和你是否卷舌。你的基因含有制造你身体所有蛋白的指令,而这些指令是你的细胞让你存活所持续需要的。但是在此之前,基因表达在分子水平上如何运行的一些关键细节一直有点神秘。
在一项新的研究中,来自美国加州大学伯克利分校、劳伦斯伯克利国家实验室和西班牙国家研究委员会(CSIC)罗卡索拉诺物理化学研究所的研究人员在理解我们体内被称作转录起始前复合物(pre-initiation complex, PIC)的分子机构(molecular machinery)如何发现合适的DNA片段进行转录方面取得重大进展。他们史无前例地详细呈现一种被称作TFIID的转录因子所发挥的作用。相关研究结果于2016年3月23日在线发表在Nature期刊上,论文标题为“Structure of promoter-bound TFIID and model of human pre-initiation complex assembly”。论文通信作者是劳伦斯伯克利国家实验室生物物理学家Eva Nogales,论文第一作者是Nogales实验室生物物理学研究生Robert Louder。其他作者是Yuan He、José Ramón López-Blanco、Jie Fang和Pablo Chacón。
这一发现是非常重要的,这是因为它为科学家们理解和治疗一系列恶性肿瘤铺平道路。Eva Nogales说,“理解细胞中的这种调节过程是操纵它或当它变坏时修复它的唯一方式。基因表达是包括从胚胎发育到癌症在内的很多重要生物学过程的关键。一旦我们能够操纵这些基本机制,那么我们就能够要么校正应当或不应当存在的基因表达,要么阻止这种过程[即基因表达]失去控制时的恶性状态。”
18年来,Nogales一直在研究基因表达。尽管她和她的团队近几年取得几项重大发现,但是她将当前的这项发现称为她迄今为止最大的突破。她说,“这一发现将会写入生物化学教科书中。我们如今绘制出在每个基因开始转录时形成的这种蛋白分子机构(即PIC)的结构。由于依据传统方法确实很难研究它,所以在此之前没有人有机会做到这一点。”
在活的有机体中,基因信息从DNA流动到蛋白的过程被称作“分子生物学的中心法则”。细胞持续地开启和关闭基因以应对它们所在环境中发生的事情,而为了做到这一点,细胞使用它自己的DNA---大型的基因蓝图库(library of genetic blueprints)---找到正确的基因片段,然后进行转录产生信使RNA(mRNA),mRNA然后被用来产生所需的蛋白。
问题在于这种“基因蓝图库”没有页码,也没有目录。然而,每个基因含有特异性的DNA序列,即作核心启动子基序(core promoter motif),从而指示一个基因在何处开始和结束。因此,执行转录的RNA聚合酶如何知道在何处开始转录?Nogales说,“DNA是一种非常非常大的分子。人们不得不从中找到这种基因转录从何处开始,不过这种RNA聚合酶知道在何处开始转录。这种转录因子,即TFIID,确实就是这种准确地做到这一点的蛋白复合体。它识别和结合到DNA核心启动子序列上。”
Nogales和她的团队能够以前所未有的细节可视化观察结合到DNA上的TFIID。TFIID由TATA结合蛋白(TBP)和13个TBP结合因子(TAF1~13)组成,能够特异性识别基因的起始或者说启动子序列。他们也发现TFIID起着着陆架(landing pad)的作用,这样这整个分子机构(即PIC)就能够在这个位置上组装起来。PIC最终将这种RNA聚合酶安置在适当位置,这样后者才能够开始转录。
Nogales说,“TFIID不仅发挥着结合到DNA上、招募[其他PIC组分]和充当着陆架的作用,它还在有机体一生当中任何一个给定时间点上对不同的基因发挥的作用存在着某种程度上的差异。”
Louder补充道,“我们首次解析出完整的基于TFIID的人PIC结构图。我们的结构图对人PIC组装产生新的认识,包括TFIID在将PIC其他组分招募到DNA启动子序列上的作用,以及长期观察到的TFIID构象柔性变化如何在调节转录起始中发挥作用。”
传统上,科学家利用X射线衍射晶体分析法研究蛋白结构,但是这种技术不适合用于当前的这种类型的研究。Nogales说,“TFIID很难形成蛋白结晶,这是因为没有足够的材料让它结晶,而且它非常有柔性,此外它的尺寸大。我们能够利用低温电子显微(cryo-electron microscopy, cryo-EM)成像技术克服这些问题。”
在Cryo-EM中,科学家在低温条件下对蛋白样品进行成像,同时不需要使用染料或固定剂。这种技术从上个世纪八十年代开始就一直用于结构生物学研究当中。对成像所获得的这些图片广泛地计算分析,研究人员能够绘制出蛋白的三维结构。不过,随着劳伦斯伯克利国家实验室开发的新型检测器的降临,cryo-EM在过去几年也经历技术变革,比如这些新型检测器能够提高分辨率,同时将所需的数据量降低高达100倍。
她说,“我们曾认为很多生物系统不可能在高分辨率下进行研究。如今,这种高分辨率允许我们获得分子细节。这是劳伦斯伯克利国家实验室成为佼佼者之一的一个领域。”
尽管这项研究揭示出基因表达方面的新认识,但是Nogales注意到还需开展更多研究。接下来,她将继续研究TFIID如何能够识别不同类型基因的不同序列,以及它如何受到辅因子和激活物的调节。
她说,“我们只是刚刚开了个头。这种TFIID复合体是非常非常至关重要的。如今,从这个意义上讲,我们打破了一些障碍:我们能够开始绘制分子结构,并且获得DNA如何被TFIID结合的细节。”
原始出处:
Robert K. Louder, Yuan He, José Ramón López-Blanco,et al.Structure of promoter-bound TFIID and model of human pre-initiation complex assembly.Nature.23 March 2016.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
58
#TFIID#
64
#转录#
54
#三维结构#
62
#基因表达#
0
#转录因子#
60