CFDA提示睾酮药品或引起心血管风险,涉30余家药企
2017-01-03 佚名 医谷
近日,CFDA发布第七十三期《药品不良反应信息通报》,提示关注睾酮药品引起的心血管风险,涉及的具体厂家和品种如下表:据悉,睾酮是维持男性生长发育和雄性特征的一种非常重要的激素。在性腺机能减退男性中,睾酮水平异常偏低,影响了正常的性发育。睾酮药品通过弥补体内缺乏的性激素,有助于恢复男性正常的睾酮水平,以确保男性正常的性发育、成熟。我国睾酮药品主要用于原发性或继发性男性性功能低下,绝经期后女性晚期乳腺
近日,CFDA发布第七十三期《药品不良反应信息通报》,提示关注睾酮药品引起的心血管风险,涉及的具体厂家和品种如下表:
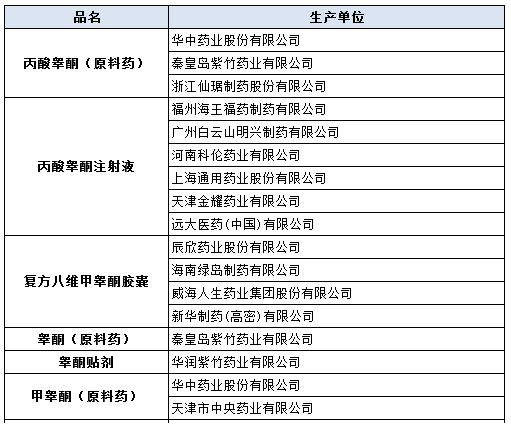

据悉,睾酮是维持男性生长发育和雄性特征的一种非常重要的激素。在性腺机能减退男性中,睾酮水平异常偏低,影响了正常的性发育。睾酮药品通过弥补体内缺乏的性激素,有助于恢复男性正常的睾酮水平,以确保男性正常的性发育、成熟。我国睾酮药品主要用于原发性或继发性男性性功能低下,绝经期后女性晚期乳腺癌的姑息性治疗等。
目前我国上市的睾酮药品主要有甲睾酮片、十一酸睾酮软胶囊、十一酸睾酮胶丸(进口)、十一酸睾酮注射液、丙酸睾酮注射液、睾酮贴剂,其中甲睾酮片、丙酸睾酮注射液是国家基本药物目录品种。
2014年,美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、加拿大卫生部等国外监管机构,相继发布了关于睾酮药品的安全性信息,主要涉及到心血管事件风险。国家药品不良反应监测中心对国家药品不良反应监测数据和国内文献开展了分析评价,结果显示国内心血管系统损害病例报告较少,无国外关注的心脏病发作、脑卒中和死亡等病例报告。CFDA将继续组织加强对睾酮药品的不良反应监测。为加强风险沟通与交流,提示关注该药品可能引起的心血管风险,CFDA建议:医务人员应关注睾酮药品的心脏病发作、卒中和死亡等风险,在治疗过程中加强睾酮激素水平的检测,发现相关药品不良反应及时上报;患者在使用睾酮药品过程中,当出现如胸痛、呼吸急促或呼吸困难、身体部分或一侧虚弱、口齿不清等症状时,请立即就医;药品生产企业应当加强不良反应监测,并及时将相关安全性信息传达给医务人员和患者。
CFDA表示,睾酮的不良反应主要累及胃肠损害、皮肤及其附件损害、全身性损害等,表现为恶心、呕吐、腹痛、皮疹、瘙痒、痤疮、头晕、乏力、头痛、肝功能异常、肝细胞损害等。通报中提到的睾酮药品可以引起心脏病发作、脑卒中和死亡等风险,国内尚无相关病例报告,应密切关注此类心血管事件风险。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#血管风险#
0
#CFDA#
55