央视“点赞”韩春雨!“魔剪CRISPR”新近进展TOP7
2016-06-17 佚名 生物探索
自河北科技大学副教授韩春雨团队的基因编辑成果发表以来,受到了科学界和媒体的广泛关注。6月16日,央视报道称,目前最时兴的是第三代基因编辑技术,近些年来一直是诺贝尔奖的热门。韩春雨团队发明的新基因编辑工具在很多人看来是对第三代技术的挑战,也被称为第四代基因编辑技术。报道还表示,韩春雨团队的发现能有效针对基因组内的任何位置进行定位并改造,对游离于细胞核内的DNA具有更高的切割效率,大幅降低了基因编
自河北科技大学副教授韩春雨团队的基因编辑成果发表以来,受到了科学界和媒体的广泛关注。6月16日,央视报道称,目前最时兴的是第三代基因编辑技术,近些年来一直是诺贝尔奖的热门。韩春雨团队发明的新基因编辑工具在很多人看来是对第三代技术的挑战,也被称为第四代基因编辑技术。
报道还表示,韩春雨团队的发现能有效针对基因组内的任何位置进行定位并改造,对游离于细胞核内的DNA具有更高的切割效率,大幅降低了基因编辑的门槛。同时,这项技术还有可能使地球上大部分生物的基因被精准改造。对于有人预言这项新技术问世将替代原有技术的说法,韩春雨团队表现出很谨慎的态度。他说:“这一技术的出现丰富了人们的选择范围。”
近几年,基因编辑技术飞速发展,已成为全球科学家争相研究的热门领域之一。进入6月以来,CRISPR技术的发文热潮仍在持续,多项研究发表在Science、Nature Biotechnology等顶级期刊上。本月的“开门红”文章于6月2日发表在Science杂志上,张锋和Eugene V. Koonin是该研究的共同通讯作者。
该研究描述了一种新型靶向RNA的CRISPR系统。DNA编辑会使细胞基因组产生永久的改变,而这一基于CRISPR的RNA靶向途径能够让研究人员实现短暂的改变,且与现有的RNA干扰方法相比特异性和功能性更强。
以下为大家汇总截止本月中部分基因编辑相关的其它新进展:

mBio:“偷”CRISPR系统的病毒(6月14日)
Viruses Infecting a Freshwater Filamentous Cyanobacterium (Nostoc sp.) Encode a Functional CRISPR Array and a Proteobacterial DNA Polymerase B [文献]
6月14日,发表在mBio上的一项研究发现,一种感染主要淡水细菌的噬菌体病毒似乎利用“偷来”的免疫系统DNA抵御宿主的免疫响应。具体来说,科学家们发现,噬藻体N1(Cyanophage N1)携带了CRISPR DNA序列,而这一系统通常是细菌用来抵抗病毒感染的。
Nature Microbiology:科学家发现CRISPR/Cas的“敌人”(6月13日)
Inactivation of CRISPR-Cas systems by anti-CRISPR proteins in diverse bacterial species [文献]
6月13日,发表在Nature Microbiology上的一项研究中,多伦多大学和Otago大学的科学家小组证实,不同的细菌物种编码了多种抑制特定CRISPR/Cas系统活性的基因。研究人员鉴定出了5个新的抗CRISPR(anti-CRISPR)基因。这项工作指出了一条学习CRISPR系统工作机制的新途径。
Science:George Church发表CRISPR/Cas重要研究成果(6月9日)
Molecular recordings by directed CRISPR spacer acquisition
6月9日,发表在Science上的一项研究中,哈佛大学的科学家们利用细菌CRISPR/Cas适应性免疫系统开发出了一种长期记录活细胞中的分子事件的方法。George Church是该研究的通讯作者。[详细]
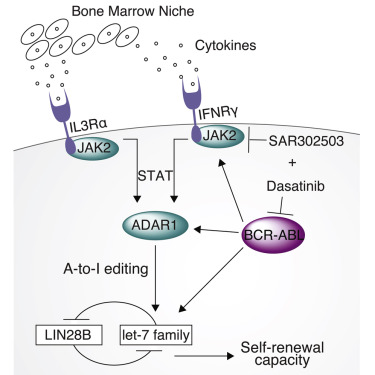
Cell Stem Cell:癌症与基因编辑系统“狼狈为奸” (6月9日)
ADAR1 Activation Drives Leukemia Stem Cell Self-Renewal by Impairing Let-7 Biogenesis [文献]
6月9日,在线发表于Cell Stem Cell上的一项研究中,加州大学圣地亚哥医学院的科学家们发现体内的基因编辑系统能够帮助产生白血病干细胞,抑制其中RNA编辑酶ADAR1可能会为血癌治疗提供一种全新的方法。研究证明,癌症干细胞通过“拉拢”RNA编辑系统克隆自己。
研究人员揭示了该过程中的一系列分子事件:首先,携带促白血病基因突变的白细胞会对炎症信号更加敏感,随后,炎症响应会激活ADAR1,从而引发一种叫做let-7的microRNAs表达降低,最终增加细胞再生或自我更新,将白细胞前体细胞转变为白血病干细胞。基于这些机制,通过利用小分子化合物抑制白细胞对炎症的敏感性或抑制ADAR1,研究人员逆转了ADAR1对白血病干细胞的自我更新作用,并修复了let-7的表达。
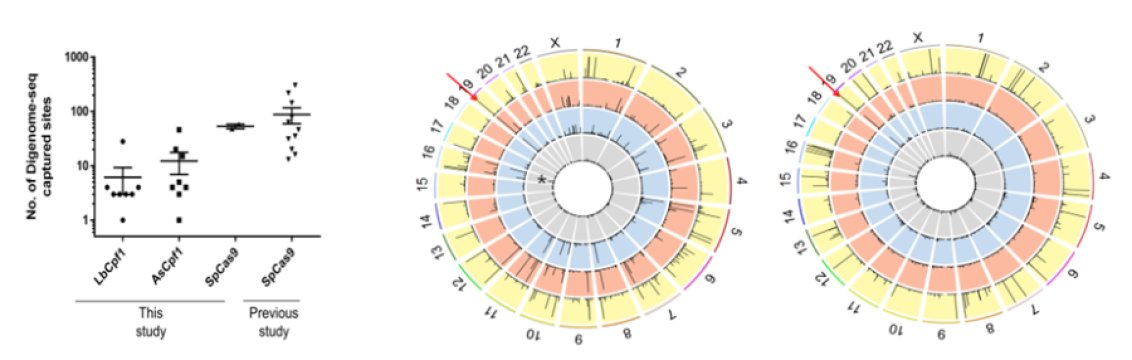
2篇Nature Biotechnology:科学家证实CRISPR/Cpf1几乎没有脱靶效应(6月6日)
1)Genome-wide analysis reveals specificities of Cpf1 endonucleases in human cells [文献]
2)Targeted mutagenesis in mice by electroporation of Cpf1 ribonucleoproteins [文献]
6月6日,韩国基础科学研究院(IBS)基因组编辑中心在Nature Biotechnology杂志上同时发表两篇论文,证实了Cpf1作为一种不会引发意外突变的精确基因组编辑工具具有的优势。
在第一项研究中,研究人员利用了Cpf1家族蛋白中编辑效率最高的两种蛋白AsCpf1和LbCpf,并进行了Digenome-seq测试:他们设计出这种测试方法以便在全基因组中鉴定出Cpf1能够进行切割的靶位点(on-target site)和脱靶位点(off-target site)。
分析结果显示,Cpf1高度特异,相比Cas9显示较少的脱靶切割位点(LbCpf1为6个,AsCpf1为12个)。具体说来,大多数体外切割位点中,代表脱靶效应的插入或缺失(indels)低于0.1%,远低于靶位点的indels,表明这两种Cpf1蛋白几乎没有脱靶效应。
在第二项研究中,科学家小组成功地将Cpf1核糖核蛋白(RNP,编者注:由crRNA和Cpf1组装而成)介导的突变引入小鼠胚胎中,培育出突变小鼠。研究人员选择发生突变的靶基因为Foxn1和Tyrosinase,前者可促进皮肤毛发生长,后者催化黑色素产生。
为了研究Cpf1是否有脱靶效应,研究小组对从一只Foxn1基因发生突变的小鼠和它的野生型近亲小鼠体内分离出的基因组DNA进行全基因组测序。序列分析表明没有脱靶突变发生。对其他突变小鼠的DNA进行靶向深度测序(targeted deep sequencing)也显示没有发生脱靶突变。
Cancer Discovery:细胞对CRISPR的应答不容忽视(6月3日)
Genomic copy number dictates a gene-independent cell response to CRISPR-Cas9 targeting
6月3日,在线发表于Cancer Discovery上的一项研究指出,细胞会对CRISPR-Cas9产生一种不容忽视的应答。这种应答会干扰人们对CRISPR筛选数据的解读。[详细]
特别备注:本文部分内容编译自Sciencedaily、The Scientist、GEN,部分内容参考自生物谷、生物通。
参考链接:
Body's own gene editing system generates leukemia stem cells
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#魔剪#
68
真理的唯一标准在于时间和实践,会验证一切的!
95
厉害厉害
110
hao好
166
好好
150
#CRISPR#
57
#韩春雨#
53
这个家伙火了,呵呵
141
好文章,值得学习
102
32个赞
111