Nature盘点:解密CRISPR:基因编辑技术或许才刚刚开始
2016-03-17 佚名 生物谷
每当媒体有一篇和CRISPR–Cas9相关的报道时,Addgene公司的员工就会找到,该公司是一个非盈利的公司,研究作者通常会将他们经常使用的分子工具“放在”这里以便其他科学家们可以快速获取该工具以促进研究进展。从2013年开始Addgene公司的电话就响个不停,当科学家们首次报道利用CRISPR–Cas9系统在特定位点切开人类细胞基因组时,其他研究者们都“坐不住了”,从那时开始,分子生物

每当媒体有一篇和CRISPR–Cas9相关的报道时,Addgene公司的员工就会找到,该公司是一个非盈利的公司,研究作者通常会将他们经常使用的分子工具“放在”这里以便其他科学家们可以快速获取该工具以促进研究进展。从2013年开始Addgene公司的电话就响个不停,当科学家们首次报道利用CRISPR–Cas9系统在特定位点切开人类细胞基因组时,其他研究者们都“坐不住了”,从那时开始,分子生物学家们就开始相继采用这种新型基因编辑技术来改变几乎任何有机体的基因组;目前Addgene公司已经向83个国家的研究者发出了6万个CRISPR相关的分子工具,大约占到了工具总量的17%,而Addgene公司相关的网页在2015年也被浏览了超过100万次。
目前关于CRISPR–Cas9技术的谈论已经演变到了利用该技术来进行人类胚胎的编辑,但研究者表示,真正的技术革新才刚刚开始;CRISPR可以为我们带来什么?为什么科学家们这么热衷于该技术?因为其可以靶向作用任何基因组的特殊DNA序列,而对DNA进行编辑仅仅是其众多作用中的一种而已;来自波士顿儿童医院的血液病学家Daniel Bauer表示,对于众多分子生物学家而言,这种方法可以大大帮助我们来理解基因组的工作模式,CRISPR–Cas9技术可以真正帮助我们了解我们所想要知道的。
本文中,Nature杂志分析了5种方法,即CRISPR–Cas9技术如何帮助生物学家们来对细胞进行编辑修饰。

“破碎的剪刀”
CRISPR–Cas9系统中有两种主要的成分:Cas9酶,其像分子剪刀一样沿着DNA进行修剪;另一个是小RNA分子,其可以指导修剪剪刀进入DNA的特殊序列来制造切口,细胞的原始DNA修复系统就会广泛修补这些缺口,但通常会产生一定的错误。2012年研究者们揭示了这些基因编辑工具如何切割人类的DNA,而其中一个小组决定采用另外一种不同的方法,而首先研究者要做的就是破碎基因剪刀。
来自加利福尼亚大学的研究人员Jonathan Weissman表示,我们从斯坦福大学的研究者Stanley Qi那里学到了如何去破碎基因剪刀,研究者Stanley Qi对Cas9酶进行了突变以便其可以在同导向RNA匹配的位点同DNA进行结合,同时不对DNA进行切割,随后Cas9酶就会停顿并且阻断其它蛋白的翻译,这种攻击系统就可以帮助研究者实现对特殊基因的关闭,同时并不改变DNA序列的结构。
随后研究人员拿走了死亡的Cas9酶,并且尝试了一些新的事情,即将Cas9酶同另外一种可以激活基因表达的蛋白进行结合,在进行了一些巧妙的调整后,研究者构建出了新型的开关基因的方法。目前很多实验室都发表了对该方法进行修改的相关结果,而且很多研究者都竞相利用该方法加速研究进展,其中一种最流行的应用就是快速产生成百上千个不同的细胞系,每一种细胞系中都包含可以靶向作用特殊基因的不同引导RNA。
来自加州大学旧金山分校的研究者Martin Kampmann希望对每一个细胞进行筛查来研究是否特殊基因的开启或关闭会影响暴露于蛋白质聚集体中的神经元的生存情况,蛋白质的聚集被认为是很多神经变性疾病发病的根源,比如阿尔兹海默氏症;同时研究者Kampmann利用RNA干扰进行了一项类似的筛选研究,但结果显示该技术存在一定缺点;RNAi技术存在一定的脱靶效应。随后Weissman和其同事对该方法进行了一定调整以便其依赖于长链引导RNA来发挥作用,这种RNA携带有可以结合不同蛋白质的基序,而这一调整就可以帮助科学家们在同一个实验中的三个不同位点来激活或抑制基因的表达;研究者认为该系统可以帮助一次进行5个实验,而唯一的限制就是这么多引导RNAs和蛋白质如何被填入细胞中。

CRISPR的表观遗传学
当遗传学家Marianne Rots开始他的职业生涯时,她就想去开发新的医学疗法,于是她学习了基因疗法,即可以靶向作用疾病中突变的基因,但数年后她决定更换自己的专业,Rots说道,我意识到很多疾病都是因为基因表达特性的改变而致,但我从来都没有这么关注过其中一种基因突变,而最好的方法就是控制基因的活性,于是我将研究重点从基因组转移到了表观基因组上来。
表观基因组是添加到DNA及DNA包裹蛋白(组蛋白)上的众多化合物的“星座”集合,这些化合物可以控制对DNA的“访问”,从而适时地调节基因表达所需的蛋白,而且这些表观标志物可以随着时间而改变,其可以随着有机体发育或环境改变而被添加或者移除。过去很多年里,科学界花费了很多资金来对不同人类细胞的表观遗传标志物进行分类编目,但除了可以改变特殊位点上标志的能力外,科学家们并不能确定是否他们可以引发特定的生物学改变,CRISPR–Cas9技术似乎可以扭转这个局面,2015年4月,杜克大学的研究者Charles Gersbach开发了一种系统,其可以利用破碎的分子剪刀将酶类携带到基因组中的特殊位点上,以此来将特殊的表观遗传标志—乙酰基添加到组蛋白上。
研究小组发现,将乙酰基添加到和DNA相关的组蛋白上足以使得目标基因的表达飙升,当这一成果发表后,研究者Gersbach将他们所使用的酶“存放”到了Addgene公司以便其他研究者也可以利用其进行相关研究。Gersbach预测,当多个表观遗传标记物被同时进行操控的话或许就会使得多篇研究论文表现出一股协同效应。
Gersbach提供的工具需要被“精炼”,而很多种酶类就可以产生或剔除DNA上的遗传标志物。研究者Rots利用锌指蛋白探究了癌症相关基因上表观遗传标记物的新功能,如今科学家们采用CRISPR–Cas9来进行相关工作,新型工具的使用将会带来更广泛的效应;人们可能会说这种关联是偶然性的,但Rots却说道,如果对表观遗传学进行重写或许并不会对基因表达产生任何影响,但如今我们却可以很轻松对其进行检测,而且有很多人都相继加入了进来。

CRISPR的密码破译
DNA上的表观遗传标志物并不仅仅是被破碎的遗传代码,超过98%的人类基因组都不会编码蛋白,但研究者却认为,这些大量的看似垃圾的DNA实际上也发挥着重要作用,而且目前研究者正在利用CRISPR–Cas9技术来研究这些垃圾DNA的奥秘。其中有些基因组编辑RNA分子,比如microRNAs和长链非编码RNAs,除了制造蛋白以外,这些RNA分子被认为还存在其它功能,而其它的序列就是可以放大基因表达的增强子。很多DNA序列都和常见疾病的发病风险直接相关,这取决于包含非编码RNA和增强子的特殊基因组区域,在CRISPR–Cas9技术出现之前,研究者很难确定到底是哪些基因组的问题,但如今却很方便。
如今研究者Farnham和其同事利用CRISPR–Cas9技术剔除了在前列腺癌癌和结肠癌中发现的突变的增强子区域,在这项成果未发表的研究中,研究人员剔除了被认为非常关键的增强子;来自MIT的研究者David Gifford和布莱根妇女医院的研究者Richard Sherwood就通过合作,利用CRISPR–Cas9技术在4万个字母的序列中引发突变,随后他们检测了是否每一个突变都会对附近产生荧光蛋白的基因带来影响,研究者将结果绘制成了一张展示增强基因表达的DNA序列图谱。
深入研究“暗物质”存在一定挑战,而CRISPR–Cas9技术也是一样,Cas9酶可以切割导向RNA的特殊位点,但仅仅是当一种特殊但却常见的DNA序列出现在切割位点附近时才会这样;如今研究人员正在搜集细菌王国中Cas9酶的“亲戚”,Cas9酶可以识别不同的序列;去年来自MIT博德研究所的研究者Feng Zhang就发现了一种名为Cpf1的酶类家族,该酶类和Cas9酶相似,这就可以扩展这种特殊酶类识别序列的选择;但研究者指出,目前并没有可以替代Cas9酶的新型酶类,未来他们希望可以完整地搜集可以在基因组任意位点被靶向作用的酶类。
CRISPR看见了光明
研究者Gersbach的实验室利用基因编辑工具来帮助理解细胞命运的变化,同时研究者还揭示了如何改变细胞的命运,他们希望有一天可以在培养皿中培养组织供药物筛选和细胞疗法的开发;但CRISPR–Cas9技术的效应却是持久性的,而且研究者需要在组织中的特殊位点短暂地开启或关闭基因的表达。
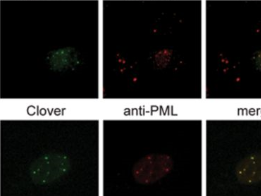
Gersbach及其同事就利用这种破碎可修饰的酶类Cas9(激活基因的表达)及被蓝光激活的添加蛋白进行研究,这种新型系统就就可以在细胞暴露光下的时候诱发基因的表达,当无光的时候就会阻断基因的表达;来自东京大学的研究者Moritoshi Sato开发了一种相似的系统,并且也制造出了一种可以在蓝光刺激下对基因组进行编辑的Cas9酶。

模型CRISPR
癌症研究者Wen Xue在其博士后第一年就开始研究制造可以在某些人类肝癌中产生一种突变的转基因小鼠,他埋头苦干最终开发出了对基因靶向作用非常必要的工具,随后将该工具注入到胚胎干细胞中,并且设法制造携带突变的小鼠,这项研究的花费是一年,外加2万美金。一年之后当他开始着手另外一种转基因小鼠实验时,他的导师让他试试利用CRISPR–Cas9技术,这次Xue仅仅利用工具对单细胞小鼠胚胎进行研究,最后仅仅在一个月内就获得了想要的小鼠种类,最后Wen Xue的博士后生涯缩短了很长时间。
如今不管是研究癌症还是研究神经变性疾病的研究者都开始着手利用CRISPR–Cas9来制造用于疾病研究的动物模型,该技术可以帮助科学家以多种复杂的方式制造出多种模式动物,而研究者Xue就是其一种一位,他利用该技术在培养基和动物体内的细胞中对疾病突变模型进行了研究。研究者希望混合并且配对新型的CRISPR–Cas9技术来更加精准地操控动物模型的基因组及表观基因组,这将可以帮助研究人员更加深入地理解常见人类疾病的复杂性及发病机制。
就拿肿瘤来讲,其拥有许多可以促进癌症发生的突变,研究者Dow说道,然而他们对于制造肿瘤去并不是最重要的,但很明确的是我们需要两个或三个、甚至四个突变来真正地模拟恶性疾病,并且更加深入地模拟人类癌症;将所有这些突变以老式的方法引入小鼠中或许花费非常昂贵而且耗时。
研究人员Patrick Hsu 2015年在索尔克研究所开始自己的研究工作,他的目的就是利用基因编辑技术在细胞培养液或绒猴中模拟神经变性疾病的相关情况,比如阿尔兹海默氏症和帕金森疾病等,相比小鼠模型而言这种方式可以更加精确地反应人类疾病的进展,但这在CRISPR–Cas9技术出现之前却是非常昂贵而且缓慢的。
正巧当研究者Patrick Hsu设计出了新型的实验方法来遗传性地对其首个CRISPR–Cas9绒猴进行工程化操作,他表示,这种方法或许是通往下一步研究的奠基石,很多技术转瞬即逝,而我们总是应该需要考虑需要解决的生物本源问题。未来新型CRISPR基因编辑技术的发展或将大放光彩。(生物谷Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷APP.
生物谷推荐的新闻阅读:
CRISPR: gene editing is just the beginning
参考文献:
【1】Multiplex Genome Engineering Using CRISPR/Cas Systems
Science DOI: 10.1126/science.1231143
【2】RNA-Guided Human Genome Engineering via Cas9
Science DOI: 10.1126/science.1232033
【3】RNA-programmed genome editing in human cells
eLife doi:10.7554/eLife.00471
【4】Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression.
Cell doi:10.1016/j.cell.2013.02.022
【5】Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation
Cell doi:10.1016/j.cell.2014.09.029
【6】Beyond editing:repurposing CRISPR–Cas9 for precision genome regulation and interrogation
Nature Reviews Molecular Cell Biology doi:10.1038/nrm.2015.2
【7】Engineering complex synthetic transcriptional programs with CRISPR RNA scaffolds.
Cell doi:10.1016/j.cell.2014.11.052
【8】CRISPR transcriptional repression devices and layered circuits in mammalian cells
Nature Methods doi:10.1038/nmeth.2969
Nature Biotechnology doi:10.1038/nbt.3199
【10】High-throughput mapping of regulatory DNA
Nature Biotechnology doi:10.1038/nbt.3468
【11】Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System
Cell doi:10.1016/j.cell.2015.09.038
【12】A light-inducible CRISPR-Cas9 system for control of endogenous gene activation
Nature Chemical Biology doi:10.1038/nchembio.1753
【13】CRISPR-Cas9-based Photoactivatable Transcription System
Chemistry & Biology doi:10.1016/j.chembiol.2014.12.011
【14】Photoactivatable CRISPR-Cas9 for optogenetic genome editing
Nature Biotechnology doi:10.1038/nbt.3245
【15】Inducible in vivo genome editing with CRISPR-Cas9
Nature Biotechnology doi:10.1038/nbt.3155
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
80
#CRISPR#
103
#基因编辑技术#
69