【Leukemia】三千例患者第二次异基因造血干细胞移植的结局及影响因素
2024-07-24 聊聊血液 聊聊血液 发表于上海
研究分析血液恶性肿瘤患者第二次alloSCT结局,结果显示其两年NRM 22%等,指出相关危险因素,与历史报告比结局改善,为临床决策提供依据。
第二次异基因移植
对于第一次异基因造血干细胞移植(alloSCT)后复发的血液恶性肿瘤患者,第二次alloSCT的指征尚无共识。而在历史报道中,其具有非常高的非复发死亡率(NRM,约40%),因此不支持进行第二次alloSCT。
但基于该领域的最新进展,可以认为第二次alloSCT后的NRM现在已经相当低。鉴于缺乏随机研究或近期全面分析,学者便基于EBMT数据集进行一项回顾性分析,收集了第二次alloSCT相关死亡率和其他主要结局参数的相关数据,如移植物抗宿主病(GVHD)的发病率、复发率和死亡原因,以及预处理及GVHD预防等,有助于血液恶性肿瘤考虑第二次alloSCT的治疗决策。研究结果近日发表于《Leukemia》。

研究结果
该研究使用EBMT注册组数据,纳入2011-2021期间接受第二次alloSCT的血液恶性肿瘤患者,包括急性白血病、慢性白血病、骨髓增生异常/骨髓增生性疾病、淋巴瘤和浆细胞疾病,但排除接受过自体移植的患者。
患者和治疗特征
共纳入3356例患者,其首次和第二次alloSCT的疾病和治疗特征见表1,基础疾病包括:AML 60%、ALL 15%、MDS 8%。
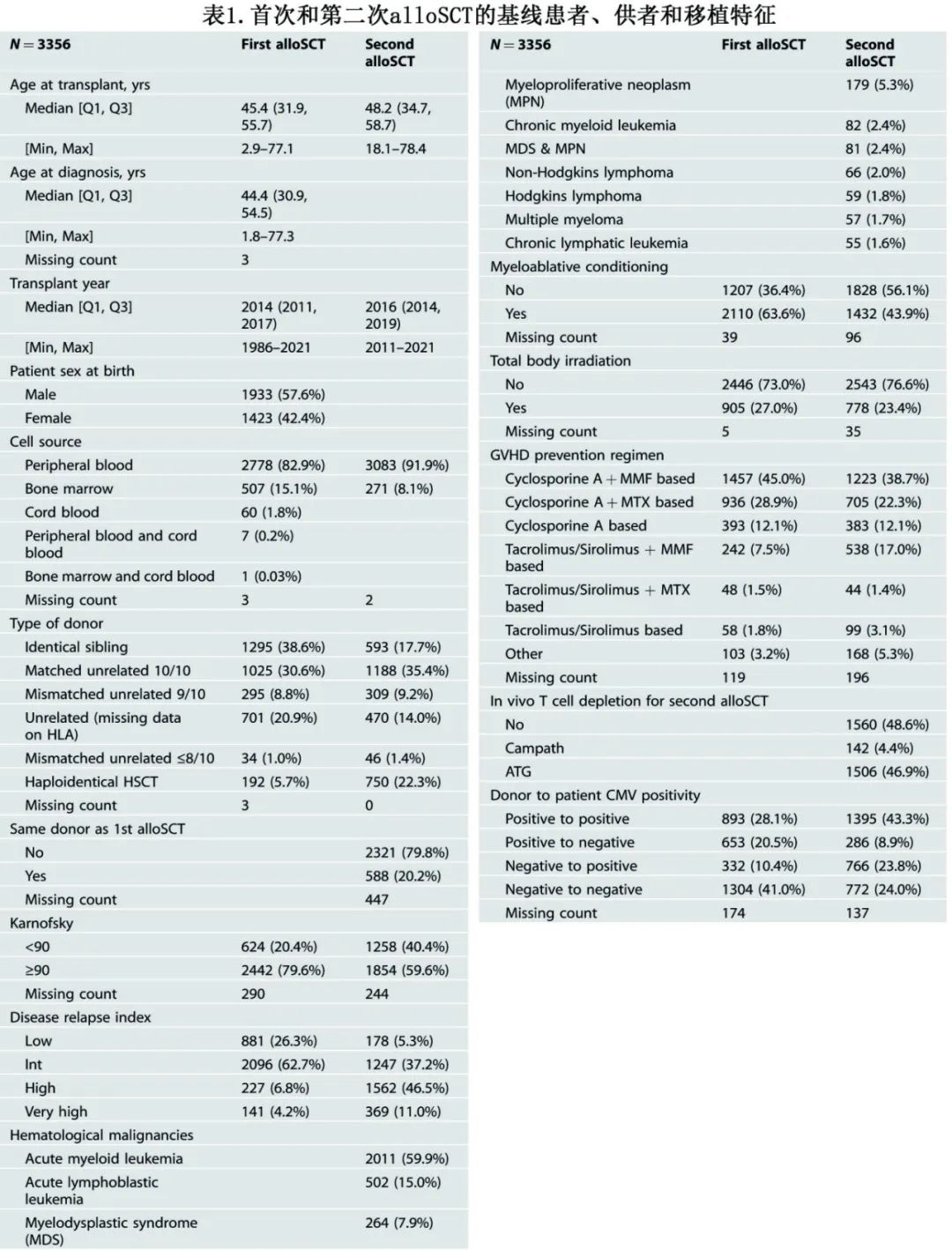
对于首次alloSCT,64%的患者使用清髓性预处理。最常见的供者类型是同胞(39%)、相合非亲缘供10/10(31%)和不全相合非亲缘9/10(9%)。表2为首次和第二次alloSCT之间的事件和时间轴。首次alloSCT后,急性GVHD II-IV级发生率为16%,慢性GVHD发生率为29%。从首次到第二次移植的中位时间为1.73年。首次移植后复发到第二次移植的中位时间为0.4年。
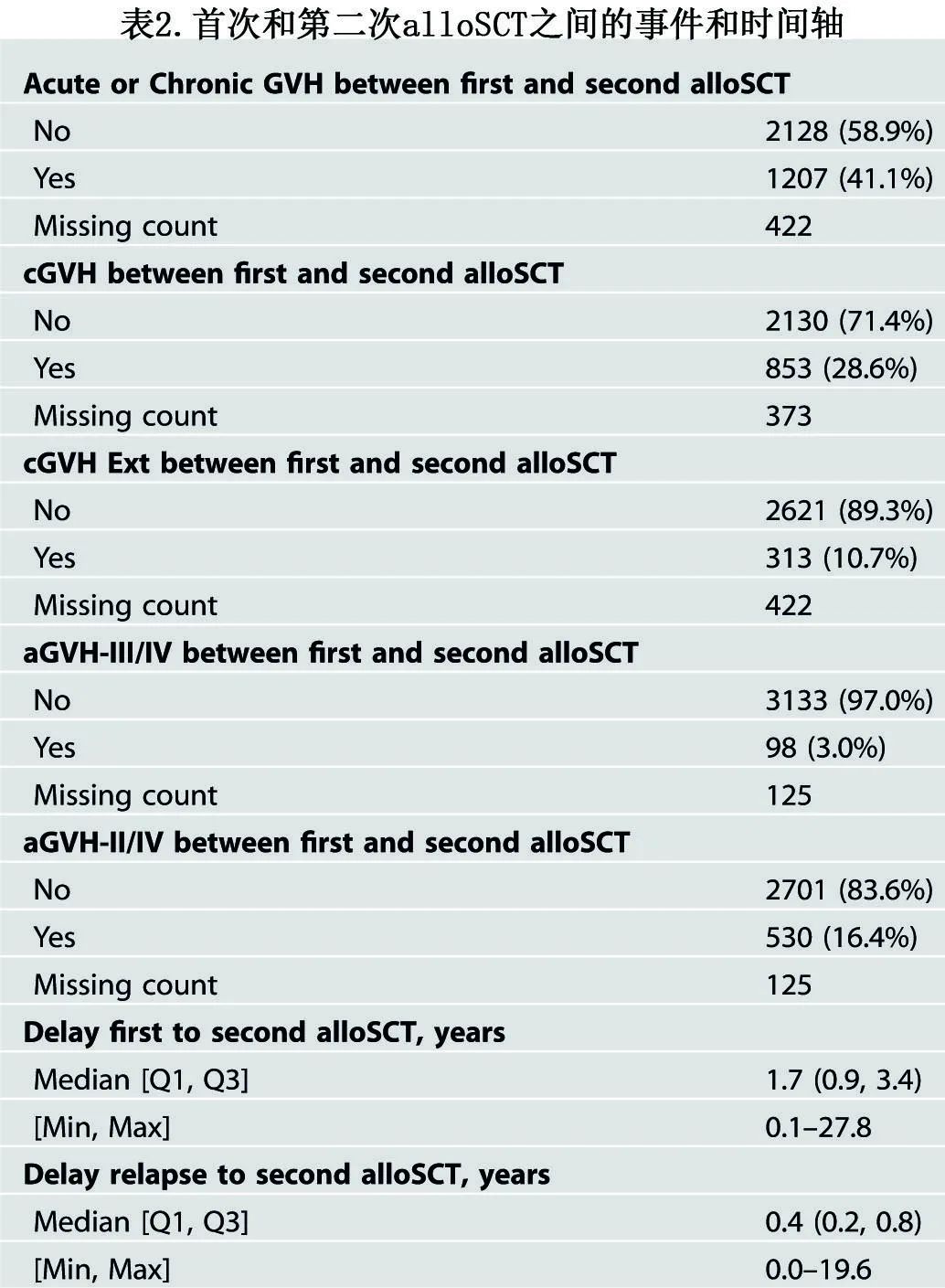
第二次alloSCT时的中位年龄为48岁。对于第二次alloSCT,44%的患者使用清髓性预处理。对于在首次alloSCT中接受了清髓性预处理的患者,大约49%在第二次alloSCT中未接受清髓性预处理;对于首次alloSCT中未接受清髓性预处理的患者,约32%在第二次alloSCT中接受清髓性预处理。最常见的供者类型为相合非亲缘10/10(35%)、单倍型(22%)和全相合同胞(18%)。第二次alloSCT后的中位随访时间为3.7年。GVHD预防方案见表1。接受第二次alloSCT的患者中有79.1%接受后置环磷酰胺作为GVHD预防。
第二次alloSCT后的NRM、生存和复发
单因素结果如图1和表3所示。表4总结多因素分析的结果。
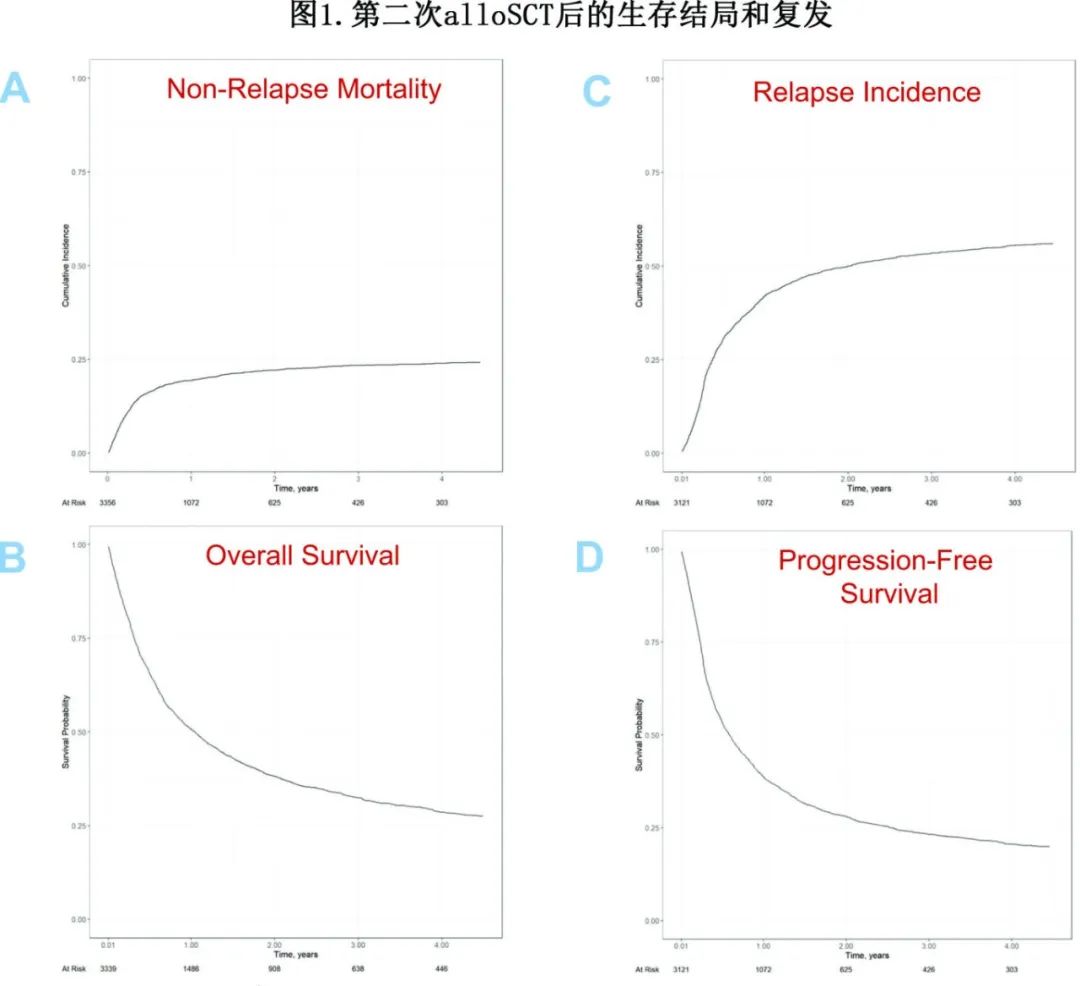
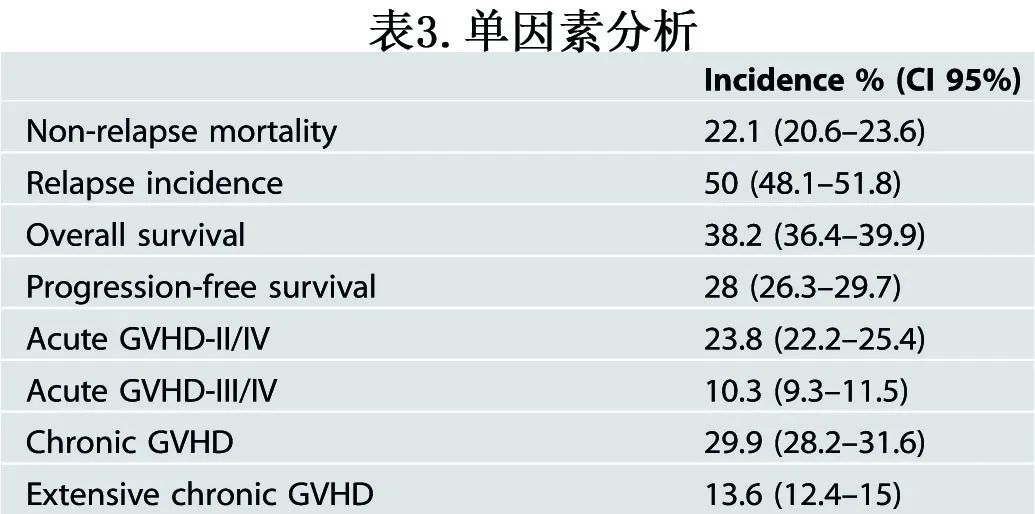
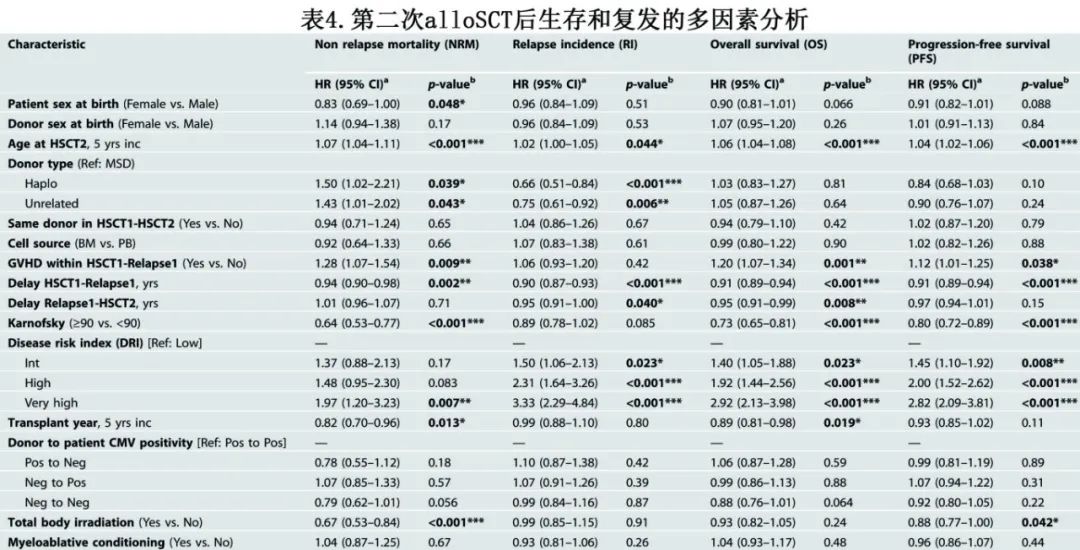
第二次alloSCT后2年NRM率为22%,多因素分析确定了NRM的多个危险因素:(a)第二次HSCT的年龄(每增加5岁),风险比(HR)为1.07(P<0.001);(b)低Karnofsky评分(≥90 vs <90;HR=0.64,P<0.001);(c)性别-女性的风险低于男性(HR=0.83,P=0.048);(d)供体类型-单倍型供者(HR=1.50,P=0.039)和非亲缘供者者(UD) (HR=1.43,P=0.043)与相合同胞供者相比的风险更高;(e)既往GVHD增加第二次alloSCT的NRM风险(HR=1.28,P=0.009);(f)极高DRI显著增加NRM风险(相对于低DRI[疾病风险指数],HR=1.97,P=0.007);(g)从首次alloSCT到复发的延迟较长与NRM风险降低相关(每年增加,HR=0.94,P=0.002),近年移植(每5年增长,HR=0.82,P=0.013);(h) TBI也与NRM风险降低相关(HR=0.67,P<0.001)。
第二次alloSCT后2年的复发率(RI)为50%,高DRI是复发的重要危险因素(极高vs低,HR=3.33,P<0.001;高vs低,HR=2.31,P<0.001)。第二次alloSCT后2年OS为38%、PFS为28% (图1,表3),第二次alloSCT后OS和PFS降低的危险因素与NRM大致相似(表4)。
第二次alloSCT后的恶性肿瘤复发是最常见的死亡原因,占总死亡人数的63% (n=1347)。第二次alloSCT后复发的中位时间为145天。NRM死亡原因包括:感染占总死亡的16% (n=334),GVHD占11% (n=232),其他alloSCT相关原因占7% (n=144)。继发性恶性肿瘤约占总死亡人数的0.5%。
第二次alloSCT后的GVHD
单因素结果如图2和表3所示。表5总结了多因素分析的结果。
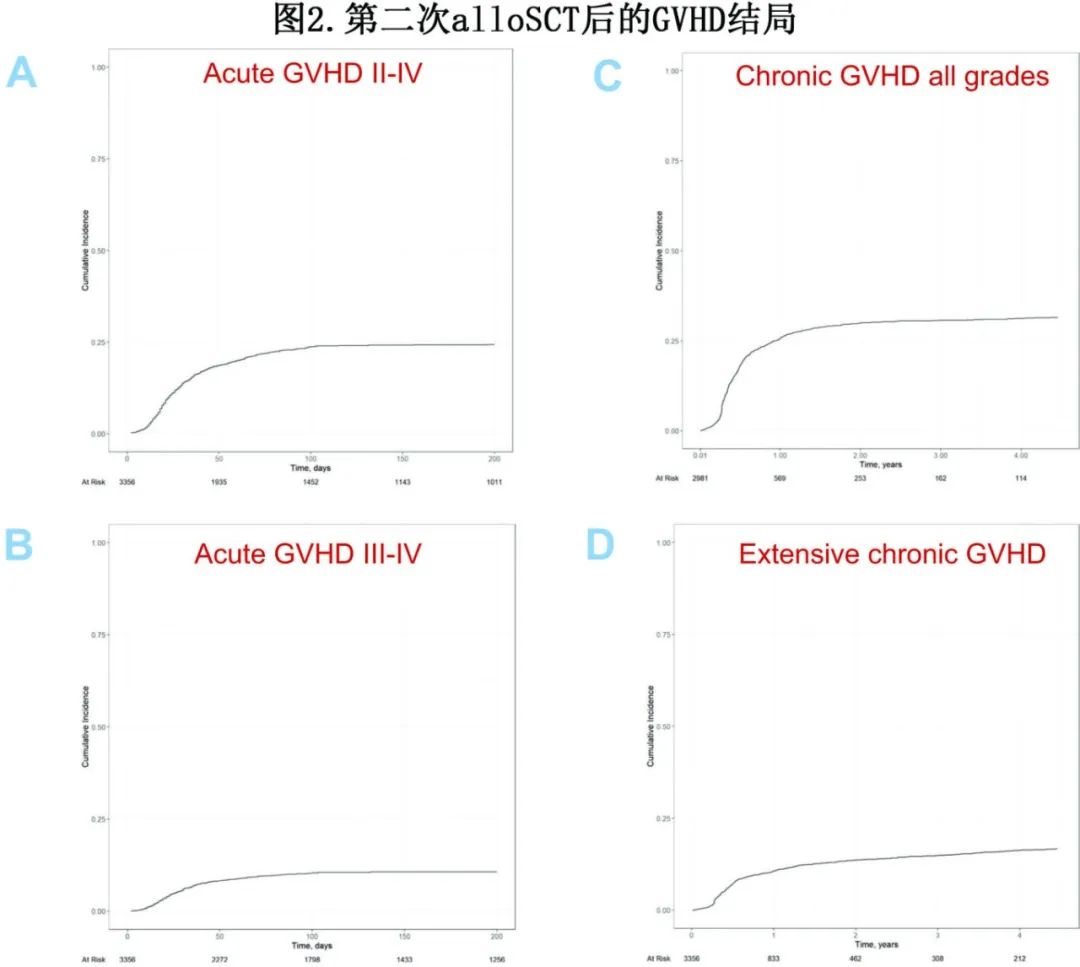
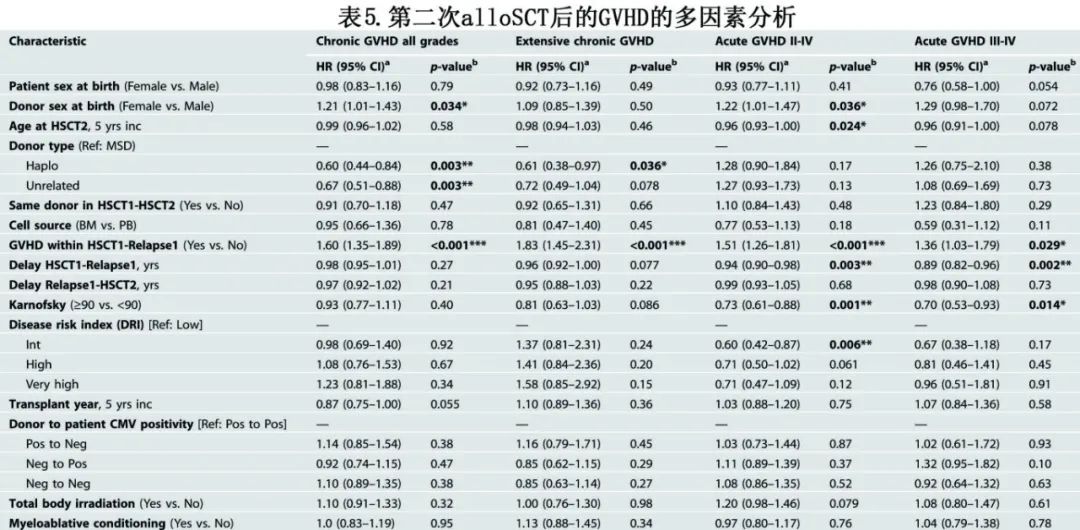
在第二次alloSCT后100天,II–IV度和III-IV度急性GVHD的累积发病率分别为24%和10%(图2,表3)。多因素分析确定了急性GVHD的多个危险因素:(a)首次alloSCT后发生任何类型GVHD(对于II/IV度,HR=1.51,p<0.001;对于III/IV度,HR=1.36,P=0.029);(b)首次alloSCT到首次复发的延迟较短(对于II/IV度,每年的HR=0.94,p=0.003;对于III/IV度,每年的HR=0.89,P=0.002);(c)低KPS评分(≥90 vs <90;对于II/IV度,HR=0.73,p=0.001;对于III/IV级度,HR=0.70,p=0.014)(表5)。
第二次alloSCT后2年的总体慢性GVHD和广泛性慢性GVHD的累积发病率分别为30%和14% (图2,表3)。多因素分析确定了慢性GVHD的危险因素:第二次alloSCT前发生GVHD显著增加慢性GVHD(HR=1.60,p<0.001)和广泛性慢性GVHD(HR=1.83,P<0.001)风险;此外供者类型也显著影响。
第二次alloSCT的供者选择
关于第二次alloSCT的供者选择,与相合同胞供者相比,单倍型和非亲缘供者都有获益。但HLA相合供者相比, HLA不全相合非亲缘供者的NRM较低。与使用相合同胞供者相比,使用单倍型供者与所有级别慢性GVHD的风险较低相关(HR=0.60,P=0.003),且该效应在广泛性慢性GVHD中一致(HR=0.61,p=0.036)。此外,与使用相合同胞供者相比,使用非亲缘供者与所有级别慢性GVHD的风险降低相关(HR=0.67,p=0.003)(表5)。非亲缘和单倍型供者的GVHD发生率较低可能是由于不同的GVHD预防方案:接受非亲缘第二次alloSCT的患者中66%与接受相合同胞第二次alloSCT的患者中21%接受了ATG(抗T细胞/抗胸腺细胞球蛋白)体内去T细胞。此外,大多数单倍型alloSCT接受了后置环磷酰胺。值得注意的是,供者年龄与供者类型密切相关:相合同胞供者的中位年龄为47.3岁,单倍型供者为38岁,而非亲缘供者为30.2岁。
20%的病例在首次和第二次alloSCT中使用相同的干细胞供者,而80%的病例选择不同供者。在多因素分析中,使用相同供者与不同供者相比,与任何生存终点或复发均无关(表4)。此外,使用相同供者或不同供者与GVHD的发病率或严重程度也无关(表5)。
总结
作者分析了2011-2021年在恶性血液病复发后进行第二次异基因造血干细胞移植的结局。第二次alloSCT后两年的结果为:NRM 22%,复发率50%,总生存率38%,无进展生存率28%。NRM增加的关键危险因素包括:年龄较大、体能评分低、疾病风险指数高、首次alloSCT后早期复发、非亲缘/单倍型供者、第二次alloSCT前发生GVHD。首次alloSCT后的任何类型GVHD也是第二次alloSCT后急性GVHD和慢性GVHD的重要危险因素。与首次alloSCT比,第二次alloSCT会优先使用不同的供者(80%);但在在多因素分析中,使用相同供者或不同供者与任何生存或GVHD终点均无关。
与历史报告相比,该研究显示患者结局显著改善,从而支持更广泛地使用第二次异基因造血干细胞移植,可作为第二次异基因造血干细胞移植临床决策的依据,也提供了需要考虑的NRM风险因素。
参考文献
Penack O, et al. How risky is a second allogeneic stem cell transplantation?Leukemia . 2024 Jun 25. doi: 10.1038/s41375-024-02318-3.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#血液恶性肿瘤# #第二次异基因造血干细胞移植# #NRM#
57