又一BRAF V600E突变非小细胞肺癌选择!恩考芬尼联合比美替尼获FDA批准
2023-10-21 苏州绘真医学 苏州绘真医学 发表于上海
PHAROS是一项开放标签、多中心、单臂II期研究,评估恩考芬尼联合比美替尼在初治和经治的BRAF V600E突变的非小细胞肺癌患者中的疗效和安全性。
2023 年 10 月 11 日,FDA批准恩考芬尼(Braftovi)联合比美替尼(Mektovi)用于治疗BRAF V600E突变的转移性非小细胞肺癌(NSCLC)成人患者。此项批准是基于PHAROS研究(NCT03915951)的结果。

▲FDA批准恩考芬尼联合比美替尼用于治疗BRAF V600E突变的转移性非小细胞肺癌
获批依据

▲恩考芬尼(左)和比美替尼(右)
此项获批得到了PHAROS研究(NCT03915951)结果的支持。PHAROS是一项开放标签、多中心、单臂II期研究,评估恩考芬尼联合比美替尼在初治和经治的BRAF V600E突变的非小细胞肺癌患者中的疗效和安全性。
研究设计
该研究对 98 名携带BRAF V600E突变的转移性NSCLC患者进行了疗效评估。入组患者应满足如下条件:组织学证实为IV期或复发性NSCLC;年满 18 岁;ECOG体能评分为 0 或 1;既往未接受BRAF或MEK抑制剂治疗。关键排除标准包括:携带其它驱动基因变异(例如EGFR突变、ALK重排或ROS1重排);存在未经治疗的有症状脑转移或软脑膜疾病。符合上述条件的患者被纳入两个队列:初治队列和经治队列。既往接受过一线含铂化疗或含铂化疗联合抗PD-1/PD-L1抑制剂治疗的患者被纳入经治队列。患者会持续接受恩考芬尼(450 mg,QD[每日一次])和比美替尼(45 mg,BID)治疗,直至出现疾病进展、不可接受的毒性、撤回同意、接受其它治疗或死亡。主要疗效终点是由独立审查委员会评估客观缓解率(ORR)和缓解持续时间(DoR)(基于RECIST v1.1标准)。
▲PHAROS研究(NCT03915951)
基线数据
共有 98 名患者参加了该试验:59 名患者既往未接受过治疗,39 名患者之前接受过系统性治疗。入组患者的中位年龄为 70 岁(范围 47-86 岁),其中约一半(53%)为女性。大多数患者是白人(88%),且不是西班牙裔或拉丁裔(99%)。13% 的患者是当前吸烟者(current smoker),57% 是既往吸烟者(former smoker)。此外,超过一半(73%)的患者的ECOG体能状态为 1,大多数患有腺癌(97%)。所有患者均出现转移,但仅有 8% 的患者存在基线脑转移。所有患者均携带BRAF V600E突变;经治队列中有一名患者同时携带BRAF V600E和BRAF V600D突变。在整个患者队列中,恩考芬尼的中位治疗持续时间为 9.2 个月(范围,0-35.1),比美替尼的中位治疗持续时间为 8.4 个月(范围,0-35.1)。在初治患者中,恩考芬尼的中位治疗持续时间为 15.1 个月(范围,0-35.1),比美替尼的中位治疗持续时间为 14.4 个月(范围,0-35.1)。在经治患者中,恩考芬尼和比美替尼的中位治疗持续时间均为 5.4 个月(范围,0.1-31.2)。
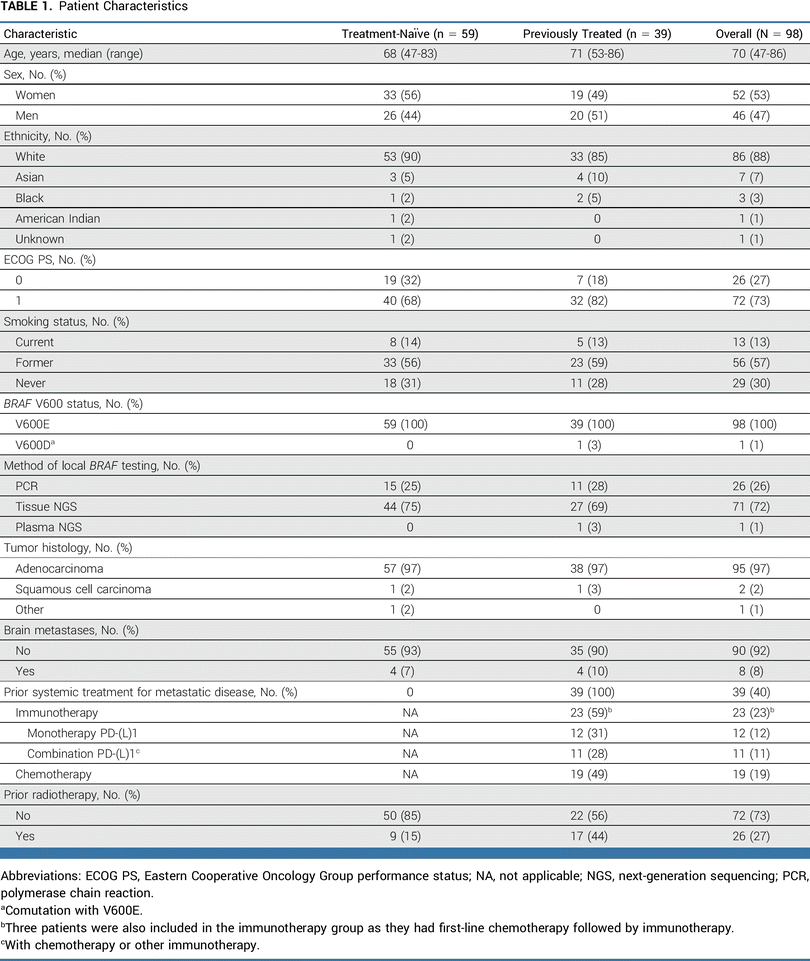
▲基线特征
研究结果
研究结果显示,在 59 名初治患者中,ORR为 75%(95%CI;62%-85%),其中 9 例CR(15%),35 例PR(59%)。中位DoR尚未达到(95%CI;23.1-NE)。在 39 名经治患者中,ORR为 46%(95%CI;30%-63%),其中 4 例CR(10%),14 例PR(36%)。中位DoR为 16.7 个月(95%CI;7.4-NE)。
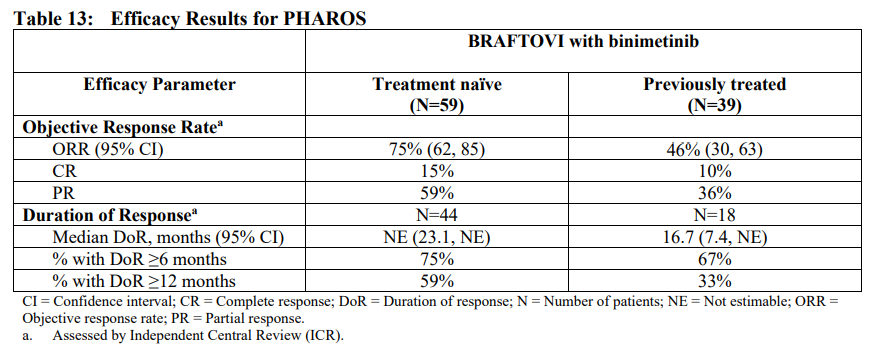
▲PHAROS研究疗效数据
独立分析显示,在初治患者中,当前吸烟者(n = 8)、既往吸烟者(n = 33)和从不吸烟者(n = 18)的ORR分别为 50%、76% 和 83%。在经治患者中,当前吸烟者(n = 5)、既往吸烟者(n = 23)和从不吸烟者(n = 11)的ORR分别为 20%、52% 和 46%。研究人员还发现,在基线脑转移患者中,所有 4 名初治患者均达到CR或PR,但 4 名经治患者均未达到客观缓解。在经治患者中,接受过免疫治疗的患者(n = 23)的ORR为 57%,而未接受过免疫治疗的患者(n = 16)的ORR为 31%。
安全性
最常见的不良反应(≥25%)是疲劳(所有级别 61%;3/4级 8%)、恶心(58%,3.1%)、腹泻(52%,7%)、肌肉骨骼疼痛(48%,4.1%)、呕吐(37%,1%)、腹痛(32%,1%)、视力障碍(29%,2%)、便秘(27%,0%)、呼吸困难(27%,8%)、皮疹(27%,3.1%)和咳嗽(26%,0%)。
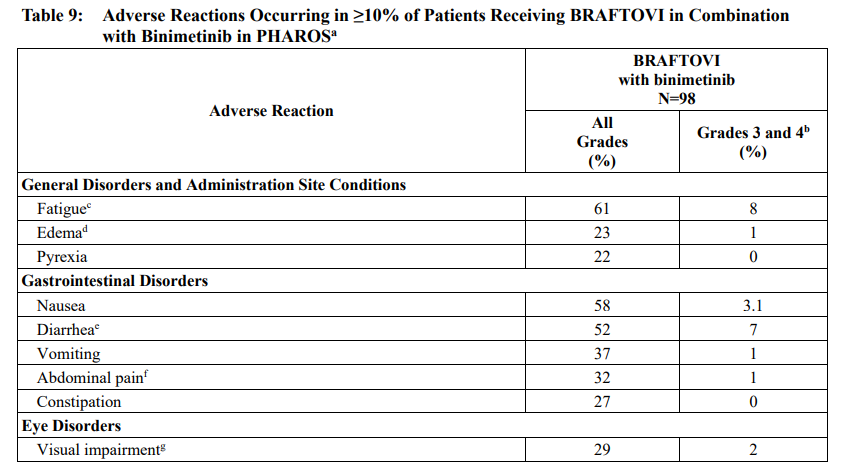
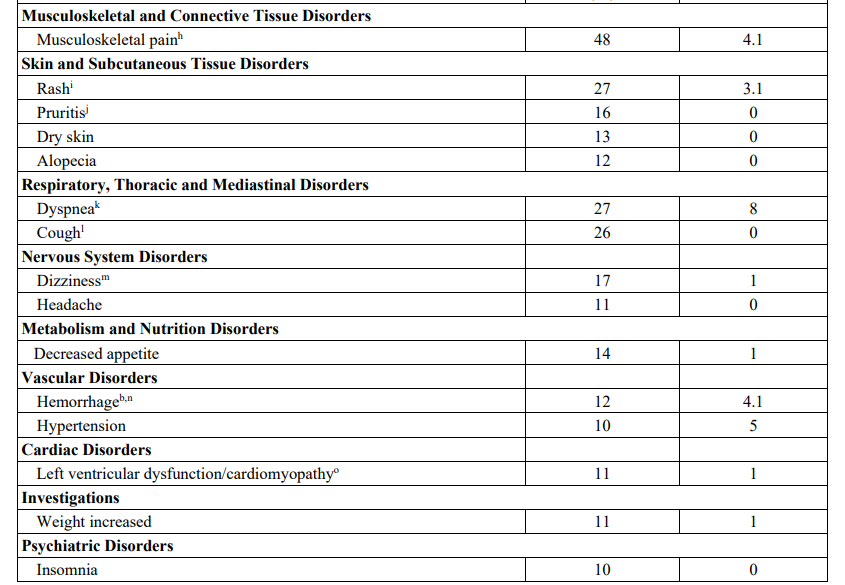
▲不良反应数据
不良反应(AE)导致 59% 的患者中断了恩考芬尼治疗,其中最常见的AE包括腹泻(17%)、恶心(13%)、肌肉骨骼疼痛(8%)、疲劳(8%)、天冬氨酸转氨酶升高(AST;7%)、丙氨酸转氨酶升高(6%)、贫血(6%)、出血(6%)、呕吐(6%)和急性肾损伤(5%)。还有 30% 的患者因AE减少了恩考芬尼的剂量,导致此原因的最常见AE是腹泻(8%)、恶心(8%)、AST升高(5%)和疲劳(5%)。接受恩考芬尼治疗的患者中有 16% 因AE永久停止治疗。
每日一次 450 mg 剂量恩考芬尼联合比美替尼治疗的患者中有 2% 发生致命毒副反应,包括颅内出血(1%)和心肌梗塞(1%)。
生物标志物分析
除了BRAF之外,基线期最常见的基因变异还包括SETD2(43%)、TP53(43%)、SMAD4(21%)、ATM(14%)、MLL2(14%)、CSF1R(14%)、SMARCA4(14%)和CDKN2A(11%)。
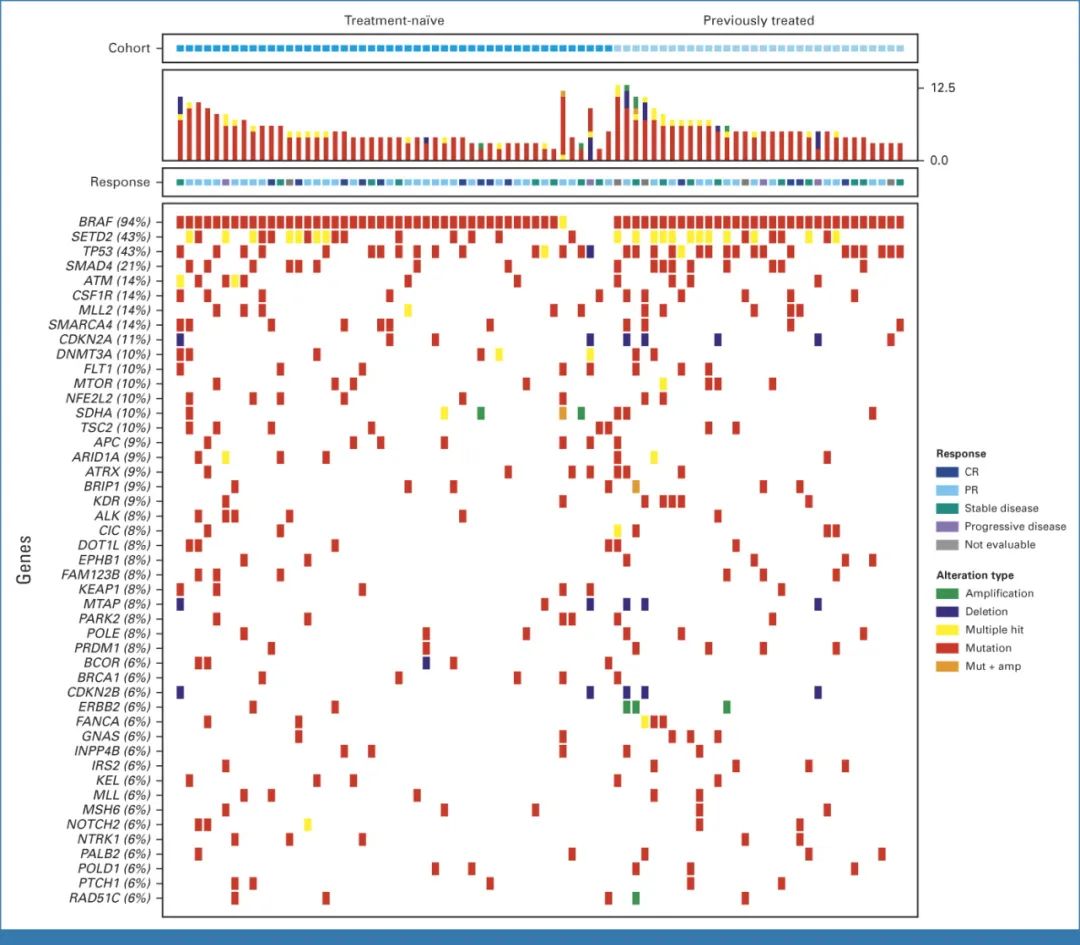
▲入组患者的基线期分子特征
总 结
目前,携带BRAF V600E突变的患者的靶向治疗选择有限——在恩考芬尼联合比美替尼获批前,达拉非尼联合曲美替尼是唯一获批用于BRAF V600E突变转移性非小细胞肺癌的靶向治疗。PHAROS研究的结果表明,恩考芬尼联合比美替尼具有治疗BRAF V600E非小细胞肺癌的活性,且耐受性良好,与批准的黑色素瘤适应证一致。恩考芬尼联合比美替尼的此次获批,意味着BRAF V600E突变转移性NSCLC患者有了新的治疗选择。
参考文献:
[1] FDA Approves Encorafenib Plus Binimetinib for BRAF V600E+ Metastatic NSCLC.https://www.onclive.com/view/fda-approves-encorafenib-plus-binimetinib-for-braf-v600e-metastatic-nsclc
[2] FDA approves encorafenib with binimetinib for metastatic non-small cell lung cancer with a BRAF V600E mutation.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-encorafenib-binimetinib-metastatic-non-small-cell-lung-cancer-braf-v600e-mutation
[3] NCT官网.https://classic.clinicaltrials.gov/
[4] Riely GJ, Smit EF, Ahn MJ, Felip E, Ramalingam SS, Tsao A, Johnson M, Gelsomino F, Esper R, Nadal E, Offin M, Provencio M, Clarke J, Hussain M, Otterson GA, Dagogo-Jack I, Goldman JW, Morgensztern D, Alcasid A, Usari T, Wissel P, Wilner K, Pathan N, Tonkovyd S, Johnson BE. Phase II, Open-Label Study of Encorafenib Plus Binimetinib in Patients With BRAFV600-Mutant Metastatic Non-Small-Cell Lung Cancer. J Clin Oncol. 2023 Jul 20;41(21):3700-3711. doi: 10.1200/JCO.23.00774. Epub 2023 Jun 4. PMID: 37270692.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









学习了,谢谢分享
54
真棒
64