Nat Commun:北京大学汪阳明团队开发新型线粒体碱基编辑器
2023-02-23 王聪 “生物世界”公众号 发表于上海
第一代基因编辑技术ZFN和第二代基因编技术TALEN,可以靶向含有特定基因突变的mtDNA,从而消除突变的mtDNA。但这两种方法都只能消除mtDNA,而不能引入特定的序列变化。
线粒体(mitochondrion),是细胞的“能量工厂”,线粒体内有一套独立于细胞核的遗传物质——线粒体DNA(mtDNA),人类mtDNA的长度为16569bp,拥有37个基因,编码13种蛋白,这些蛋白都参与细胞的能量代谢。
由于线粒体在能量稳态中的重要作用,mtDNA中的单碱基突变就可导致发育障碍、神经肌肉疾病、癌症进展等等多种人类疾病。因此,开发针对mtDNA的基因编辑工具一直是线粒体遗传学领域的长期目标。在mtDNA中精确诱导碱基突变,有助于解释这些突变在发病机制中的作用,也可作为相应的治疗方法。
第一代基因编辑技术ZFN和第二代基因编技术TALEN,可以靶向含有特定基因突变的mtDNA,从而消除突变的mtDNA。但这两种方法都只能消除mtDNA,而不能引入特定的序列变化。
第三代基因编辑技术CRISPR,包括Cas9、Base Editor、Prime Editor,需要gRNA引导Cas蛋白与目标DNA结合,但目前并无有效方法将外源RNA高效导入线粒体内,这导致基于CRISPR的基因编辑工具无法应用于线粒体基因编辑。
近日,北京大学未来技术学院汪阳明实验室在 Nature Communications 期刊发表了题为:DddA homolog search and engineering expand mitochondrial base editing 的研究论文。
该研究鉴定了多个来源于微生物中的双链DNA脱氨酶(DddA),并将其中一种改造成为线粒体碱基编辑器。

2018年,Joseph Mougous 教授实验室的博士后 Marco de Moraes 在伯克霍尔德菌中无意间发现了一种细菌毒素——DddA,DddA可以在DNA双链上催化胞嘧啶(C)转化为尿嘧啶(U),这是前所未见的。
此后,Joseph Mougous 教授与刘如谦团队合作,于2020年7月8日,在 Nature 期刊发表了题为:A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing 的研究论文。
该研究开发了一种不依赖CRISPR的碱基编辑器——DdCBE,能够实现对线粒体基因组(mtDNA)的精准编辑,为研究线粒体遗传病和治疗线粒体遗传病带来了前所未有的工具。该研究也被认为是“问鼎线粒体研究领域的圣杯”。
该研究基于DddA,它可以催化双链DNA(dsDNA)中胞苷的脱氨,将胞嘧啶(C)转化为尿嘧啶(U)。将DddA分裂半体与转录激活子样效应子阵列蛋白(TALE)和尿嘧啶糖基化酶抑制剂融合,产生无RNA的DddA衍生的胞嘧啶碱基编辑器——DdCBE,可催化人mtDNA中C?G到T?A的转化。

2022年4月4日,刘如谦团队在 Nature Biotechnology 期刊发表了题为:CRISPR-free base editors with enhanced activity and expanded targeting scope in mitochondrial and nuclear DNA 的研究论文。
刘如谦团队对线粒体碱基编辑器DdCBE进行了重要升级,通过噬菌体辅助连续进化(PACE)和噬菌体辅助非连续进化(PANCE)技术对DdCBE进行定向改造,开发出了两个升级版DdCBE,这两个升级版DdCBE不仅具有更高的编辑效率,还具有更广泛的序列编辑范围,除了编辑线粒体基因,还能编辑细胞核DNA。
这项研究为在人类线粒体中进行高效基因编辑提供了新工具,也大大提高了对全蛋白碱基编辑的有效性和适用性。

然而,刘如谦团队开发的这类线粒体碱基编辑器的序列兼容性较低,例如DdCBE只对T之后的C有较高的编辑效率,编辑后将C突变为U,该碱基将被识别为T。而他开发的升级版DdCBE能够编辑A,T和C之后的C,但能够编辑G之后C的线粒体碱基编辑器仍然缺乏。
在这篇发表于 Nature Communications 期刊的论文中,汪阳明实验室鉴定了多个来源于微生物中的双链DNA脱氨酶(DddA),并将其中一种改造成为线粒体碱基编辑器。
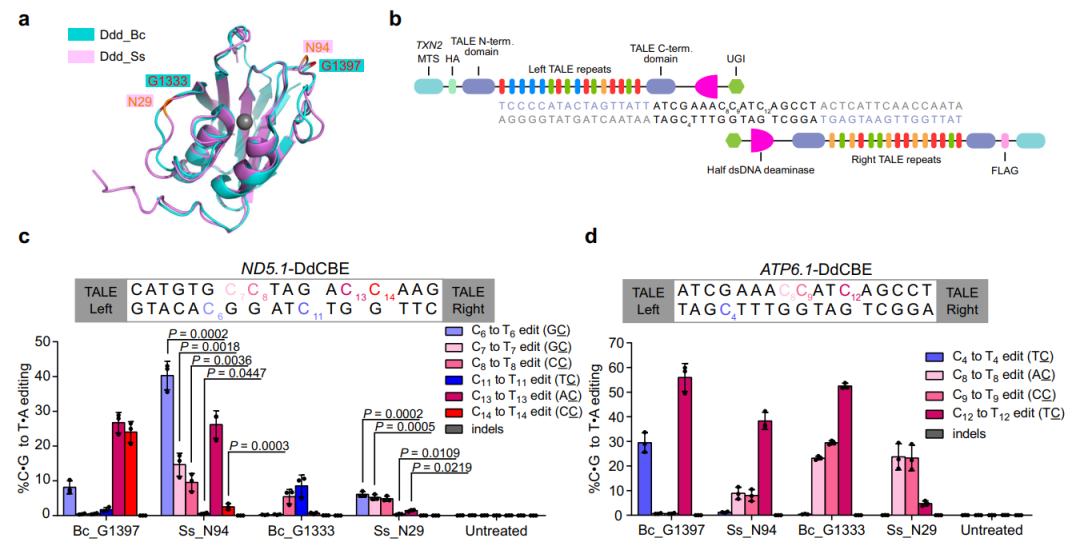
图1.思邈菌DddA衍生的线粒体碱基编辑器成功编辑多个线粒体基因组位点
汪阳明实验室米黎同学在研究伯克霍尔德菌DddA的序列和结构时,发现其羧基端存在一段序列,这些序列对于DddA的脱氨活性十分重要(图2a)。利用这一重要信息,结合PSI-BLAST生物信息学分析手段,研究团队在现有微生物的基因组序列中鉴定了多个与DddA同源的双链脱氨酶。进一步的细致分析发现,来源于思邈菌(Simiaoa Sunni;以中国唐代“药王”孙思邈命名)的DddA同源基因(Ddd_Ss),具有能够编辑A,T和G之后C的活性(图2b),从而有可能弥补目前线粒体碱基编辑器的缺口。
研究团队进一步利用Ddd_Ss构造的线粒体碱基编辑器,成功在多种细胞中实现了对14个线粒体基因组特定位点的编辑。通过引入 David Liu 等人之前发现的提高脱氨酶活性的突变,研究团队成功构建了模拟Leber遗传性视神经病变中的线粒体基因突变,发现这些突变会导致线粒体功能的减弱(图2c、d)。
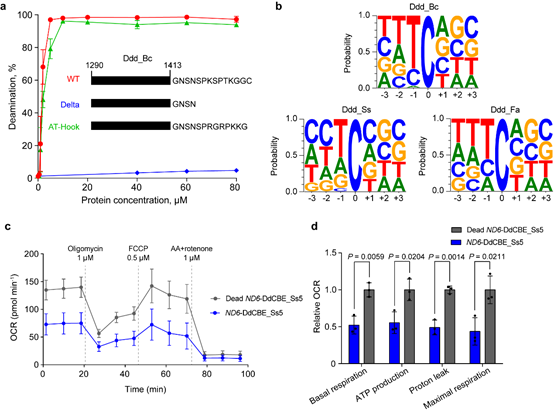
图2. DddA羧基端序列的重要性(a),三种不同来源的DddA的序列偏好(b),及经Dd_Ss衍生的线粒体碱基编辑器编辑后的细胞线粒体功能分析(c、d)。
有意思的是,反过来将Ddd_Ss中一个位点(N1370)引入到伯克霍尔德菌的DddA(Ddd_Bc)时,成功提高了Ddd_Bc衍生的线粒体碱基编辑器的活性和序列兼容性。这些研究拓展了线粒体碱基编辑器的序列兼容性,并为未来开发新的线粒体碱基编辑器提供资源和参考。
线粒体作为细胞的“能量工厂”,线粒体基因组(mtDNA)与人类的衰老、癌症,以及其他多种疾病有着密切关系,线粒体碱基编辑器的发明和改进,也为相关研究和疾病治疗带来了全新工具。
该研究拓展了线粒体碱基编辑器的序列兼容性,但并没有解决该领域目前广泛存在的脱靶问题,未来需要更多更精巧的设计来实现高效和高特异性的编辑;在此之前,线粒体碱基编辑器的应用仍然会面临挑战。
北京大学未来技术学院博士生米黎和北大-清华生命科学联合中心博士生石铭为该论文共同第一作者。北京大学未来技术学院王阳明研究员为该论文通讯作者。该研究得到了北京大学伊成器、高宁、魏文胜、程和平、王显花和陈良怡实验室的指导与帮助;研究由国家自然科学基金委和国家重点研发计划“干细胞研究与器官修复”专项资助,新发现的双链脱氨酶相关应用申请专利一项。
原始出处:
Mi, L., Shi, M., Li, YX. et al. DddA homolog search and engineering expand sequence compatibility of mitochondrial base editing. Nat Commun 14, 874 (2023). https://doi.org/10.1038/s41467-023-36600-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







不错,学习了。
69