新辅助免疫治疗:在非小细胞肺癌中的概念和未来
2020-06-15 MedSci MedSci原创
肺癌是全球癌症相关死亡的主要原因。可切除的非小细胞肺癌(NSCLC)患者通常采用手术和辅助化疗治疗。然而,这些患者仍然有很高的复发和死亡风险。
肺癌是全球癌症相关死亡的主要原因。可切除的非小细胞肺癌(NSCLC)患者通常采用手术和辅助化疗治疗。然而,这些患者仍然有很高的复发和死亡风险。不幸的是,在过去的几十年里,可切除的非小细胞肺癌的治疗进展甚微。新辅助治疗被认为是提高可切除非小细胞肺癌患者生存率的一种方法,是一个备受争议的话题。对涉及1万名患者的32项随机试验的系统回顾表明,术前和术后化疗的生存率没有差异。由于这样的结果,再加上理论上对可切除肿瘤在相对无效的新辅助化疗后进展为不可避免的担忧,新辅助化疗不再受欢迎,许多临床医生首选术后辅助化疗。
然而,在过去几年中,新辅助治疗被重新兴起,因为各种正在进行的试验的数据表明,新辅助免疫治疗可能具有显著的疗效,并可能提高可切除的非小细胞肺癌患者的生存率。在这篇综述文章中,我们讨论了支持新辅助免疫治疗在可切除的非小细胞肺癌多途径治疗中的作用的证据。我们总结了正在进行的临床试验的早期结果,并强调了采用“治疗成功”的统一定义所面临的挑战。为了寻求监管部门批准新辅助免疫疗法并将其确立为一种标准治疗方法,我们需要克服一些障碍。
要说目前免疫新辅助治疗最著名的突破,肯定是约翰·霍普金斯医学院团队开展的CheckMate-159试验,从ESMO 2016的惊艳亮相,到ASCO 2017的良好中期成果,再到2018年美国癌症研究协会(AACR)年会,论文直接登上《新英格兰医学杂志》……
这项试验的主角,是大家再熟悉不过的O药(Nivolumab)。试验总共入组了21名分期在I-IIIA期,可以进行根治手术的肺癌患者,在预定的手术前每两周注射一次O药(3mg/Kg)进行新辅助治疗,两次注射后进行手术。
试验的主要终点是病理学显著缓解,此外研究者们还对切除肿瘤的基因突变情况、患者体内的T细胞变化做了分析,毕竟免疫新辅助治疗还有许多未解之谜,能获得更多的数据肯定再好不过。
用研究主导者,约翰·霍普金斯医学院肿瘤免疫治疗研究所主任Drew Pardoll的话说,“我们都被惊呆了”。在手术完全切除肿瘤的20名患者中,9名患者的肿瘤已经实现显著病理学缓解,甚至有两例肿瘤中完全见不到癌细胞!
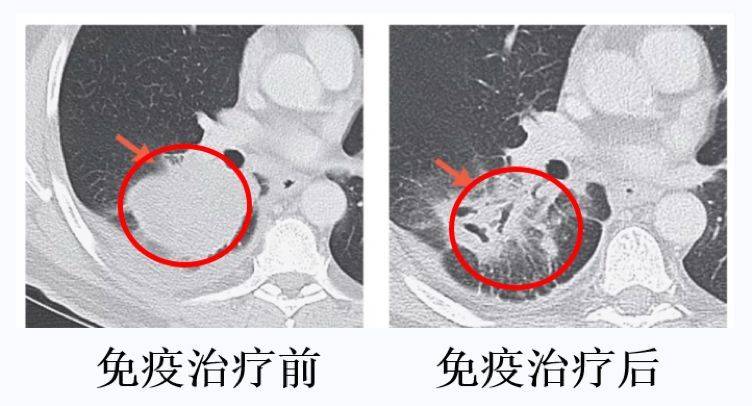
更神奇的是,医生手术后把右边的“肿瘤”取出来,放到显微镜下一看,发现全是免疫细胞和别的正常细胞,已经几乎看不到任何肿瘤细胞了!
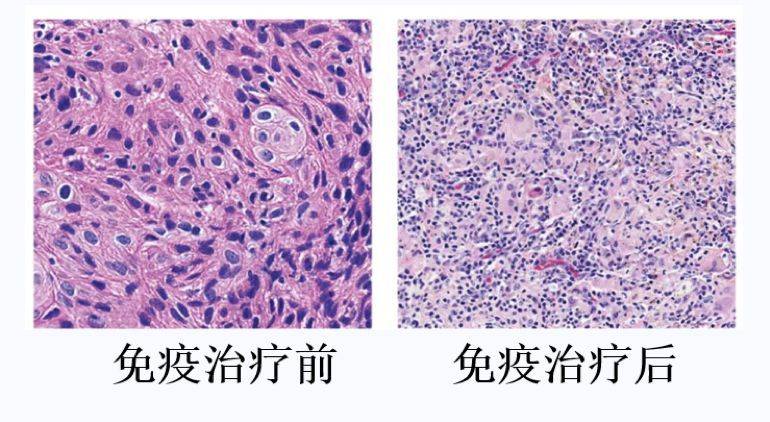
图:一个蓝色的点代表一个细胞核。可以看出,免疫治疗前,显微镜下看到的都是个头特别大的肿瘤细胞,而治疗后,几乎全部被小个子的免疫细胞所替代了。
新辅助治疗的安全性也非常好,并没有因为副作用导致手术延期。从手术后的随访来看,20名患者中只出现了3例复发,随访18个月时,患者整体的PFS率是73%,这可比历史数据50%的复发率,好看多了。
而手术前使用O药,确实调动了患者体内的T细胞进入抗肿瘤免疫状态,病理切片也证实,大量的T细胞和巨噬细胞浸润到了肿瘤当中。患者的肿瘤突变负荷(TMB),则有望作为预估疗效的生物标记物。
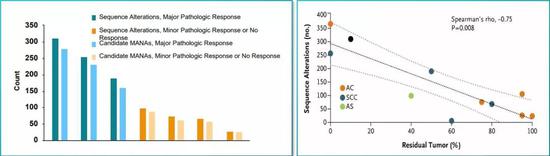
O药配合起现有的新辅助化疗方案,效果就更上一层楼了。
早期肿瘤能从免疫疗法获益,并不奇怪,因为即使很早期的肿瘤,也肯定伴随着免疫系统的失调,通过逆转免疫抑制,有可能帮助清除肿瘤,防止复发。
相比手术后再用,手术前就使用PD-1类免疫治疗,理论上有一个很大的优势,那就是手术前肿瘤本身还在!
对免疫新辅助治疗来说,大肿瘤新抗原多就是目标啊
肿瘤还在为啥重要?因为它能提供更多训练免疫细胞需要的靶子!
训练免疫细胞就像训练士兵一样,首先就要让免疫细胞知道敌人是谁。这样训练出来的战士才能明确目标,做到有的放矢。
手术前癌细胞比较多,免疫系统被激活后,就可能训练出更多针对性杀灭癌细胞的免疫细胞。这样,即使手术后还残留了肉眼不可见的癌细胞,也很可能被这些训练有素的免疫细胞干掉!
反之,如果先做手术,那残余癌细胞就很少了,这时训练免疫细胞产生的针对性可能会大打折扣。
免疫治疗还可以利用手术前肿瘤体积大,新抗原多的特点,充分增强体内抗肿瘤免疫T细胞的活性,让它们分散到全身,清除微小的癌症转移灶,这比在辅助治疗时使用效果更好,优势已经在临床前期的动物实验中得到证实[5]。如果等到手术后再来做免疫治疗,随着免疫环境的变化,这些好处可能就减弱了。
从科研角度来说,免疫新辅助治疗之后再做手术,还能把手术中切除的肿瘤组织,作为进一步抗癌研究的材料。让免疫疗法担任新辅助治疗的角色,和手术可以说是强强联手,在乳腺癌和黑色素瘤的治疗中都已经有了成功的先例。
另外,如果采用的是免疫+化疗这样的组合疗法,手术前使用还有另一个优势,那就是患者身体状态更好,对副作用耐受更强,顺利完成治疗的概率更高。
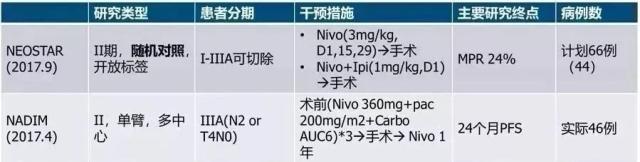
在II期对照试验中(代号为NEOSTAR),44名早中期(I到ⅢA期,可手术)的非小细胞肺癌患者,在手术前先接受了免疫治疗。其中23名单独使用O药,21名使用O药+ CTLA4抑制剂伊匹木单抗的联合治疗。
初步数据证明,新辅助免疫疗法是有前景的。

1:整体来看,新辅助治疗副作用可控。重要的是,手术前加入免疫治疗,并没有导致手术延期。
2:免疫治疗前后对比,发现治疗后,进入肿瘤内的免疫细胞增加了。
3:整体来看, 25%的患者使用免疫治疗后达到了“主要病理缓解(MPR)”。这意味着手术切下来的肿瘤或淋巴里,癌细胞所占比例只剩下不超过10%。甚至有8位患者的“肿瘤”切下来,发现完全没有癌细胞了!这种情况被称为“完全病理缓解(pCR)”。
4:联合治疗看起来效果更好。O药单药组主要病理缓解(MPR)率为19%,而联合治疗组达到44%。
更让人兴奋的数据来自O药另一项的研究(代号为NADIM)。
这项46位患者参与的研究中,新辅助治疗的用药是“O药+化疗“的组合疗法。结果非常惊人,这个方案用于可手术的ⅢA期非小细胞肺癌患者时,高达85%的患者获得了“主要病理缓解”,其中71%都是“完全病理缓解”。

图:NADIM临床试验中的病理缓解结果
这个数据,比单独使用化疗,或单独使用免疫疗法都要好得多,说明联合疗法有可能实现1+1>2的目标。
如果后续三期临床试验还能重复这个数据,尤其是如果证明能降低复发率,让患者活得更久,那“免疫+化疗”的新辅助治疗,将革命性改变部分可手术肺癌患者的治疗方案。
主要病理缓解还是客观响应率?
前面提到了一个新辅助治疗里的重要概念:“主要病理缓解”。很多人不太熟悉,这里解释一下。
很多人可能更熟悉另一个判断标准:“客观响应率(ORR)”。它描述的是用药后,肿瘤显著缩小的患者比例。对于化疗药和靶向药,ORR这个标准比较好用,因为这些药物功能是直接杀死癌细胞,一般起效后肿瘤就会迅速缩小。
但在免疫治疗的时候,光看肿瘤是否缩小就有点问题了。因为免疫治疗起效后一般伴随着大量免疫细胞进入肿瘤。虽然肿瘤细胞少了,但免疫细胞多了。
这时看CT影像的话,“肿瘤”有可能并没有缩小,有时甚至可能变大了,这就可能导致误判。就像本文最开始那张图,其实免疫细胞已经干掉了几乎所有癌细胞,但CT上依然能看到东西。
新辅助免疫治疗后,用计算机断层扫描(CT)对治疗反应的放射学评估可能并不准确。治疗后CT最常见的是显示稳定的疾病或 "伪进展",这与治疗初期的T细胞浸润和腹膜炎症有关。因此,有些患者在最初的放射学肿瘤没有缩小的情况下,就能从免疫治疗中获得临床获益。这一过程的发生是因为免疫细胞浸润到肿瘤中,而不是真正的肿瘤生长。正如临床前研究所支持的那样,新辅助PD-L1阻断可能会增强抗肿瘤T细胞的全身引物,从而有可能消除微转移癌,否则可能导致手术后复发。
在决定化疗时机时,应考虑患者在诊断时是否适合手术。男性和女性在先天性和适应性免疫反应方面的相关差异可以解释自身免疫性和感染性疾病以及多种类型癌症的不同患病率和死亡率。因此,试验免疫治疗的入组和设计最好对男性和女性患者分别进行,并对两者进行适当的样本量规划。
NEOSTAR的临床数据也证明了这一点。在达到“主要病理缓解”的患者中,只有60%的患者在影像上看起来“肿瘤显著缩小”。
因此,如果用“客观响应率”,可能会低估免疫药物作为新辅助治疗的效果。
正因为如此,在多个免疫治疗用于新辅助治疗的试验中,都把“主要病理缓解”,而不是“客观响应率”,作为主要标准。
“主要病理缓解”这个指标,能不能广泛用于临床,还需要看它到底能否预测患者的总生存期,也就是说,达到“主要病理缓解”的患者,是不是比没有达到的活得更久?
在乳腺癌和前列腺癌等类型中,已经有数据证明这一点,但肺癌的数据还需要等待。相信随着研究越来越多,“主要病理缓解”的应用场景会越来越广泛。
2019年ASCO上进一步公布的LCMC3研究、NEOSTAR研究以及NADIM研究,作为早期和局部晚期肺癌新辅助免疫治疗的代表,让人印象深刻。

LCMC3研究
LCMC3研究旨在评估阿特珠单抗用于ⅠB-ⅢA期NSCLC患者新辅助治疗的疗效与安全性。
主要研究终点为MPR(MajorPathological Response,病理学显著缓解,定义为切除标本中的存活肿瘤细胞≤10%)。
次要研究终点包括安全性、PD-L1表达水平与疗效的相关性,肿瘤突变负荷(TMB)以及基因表达特征。
结果显示MPR为19%,pCR为5% ;安全性方面,101例患者中仅6例出现3~4级的治疗相关不良反应。
此外,亚组分析发现病理缓解及MPR的疗效与PD-L1表达、TMB高低无相关。
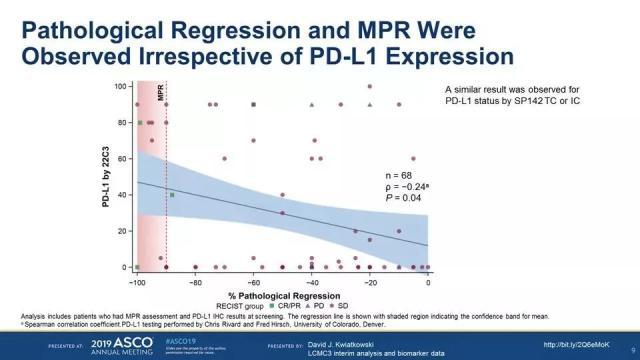

尽管MPR仅为19%,但阿特珠单抗单药新辅助治疗的整体安全性良好。只是MPR率似乎与PD-L1表达、TMB没有什么明显关联。
综合LCMC3、NEOSTAR以及NADIM研究来看,由于以上研究样本量较小,免疫治疗该是用什么方案、如何联用等问题的解决与确定,仍需要更高级别的循证医学证据进行进一步的论证(如Checkmate-861的III期临床研究,Impower030的III期一项临床研究等)。
此外,MPR作为主要研究终点的肺癌新辅助免疫治疗,必然如PD-L1表达的检测一样,存在标准不一、主观判断层次不齐等问题,因此也给病理科医生提出了更高的挑战。
如何保证MPR的评估标准一致,有没有更好的客观的指标可以替代MPH,都是肺癌新辅助治疗发展过程中无法避免的问题,任重而道远。
新辅助免疫治疗的标志物
液体活检中有许多潜在的免疫治疗生物标志物,然而,目前还没有发现任何一种生物标志物足够可靠,特别是关于其效率的评估,甚至是耐药后的选择。较高的基线中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值已显示出与较差的生存结果有显著关系。最近的一项荟萃分析已经证明了癌胚抗原(CEA)和CYFRA21-1在一线化疗期间监测肿瘤反应的作用,但它们作为免疫治疗反应的预测或 "治疗监测 "标志物的作用尚未阐明[12]。是否有人应该接受一线免疫治疗?是否存在阴性选择特征,应确定哪些患者不应接受PD-L1阻滞剂作为一线治疗的一部分?一线使用PD-L1抑制剂有一些绝对的禁忌症:严重和/或有症状的自身免疫性疾病患者、器官功能可以支持的患者(如透析)。PD-L1阻断剂在肺纤维化和间质性肺病患者中的安全性和获益大多研究不足,但应予以明确
小结
我们对于免疫治疗的研究才刚刚开始,对它作用原理的理解还还远远不够。大量研究显示,使用免疫药物的时候,不同药物,不同剂量,不同次数,不同的使用方法,都可能带来截然不同的疗效。
新辅助免疫治疗,有可能帮助提高治疗的整体效果,因此将成为研究热点之一。当然,具体怎么用最好,性价比最高,只有客观研究数据,才能给我们带来答案。
内容来自于网络,bioArt等
原始出处:
Uprety D, Mandrekar SJ, Wigle D, Roden AC, Adjei AA. Neoadjuvant Immunotherapy for Non-Small Cell Lung Cancer - Current Concepts and Future Approaches. J Thorac Oncol. 2020 Jun 6;S1556-0864(20)30425-1. doi: 10.1016/j.jtho.2020.05.020.
Benitez JC, Remon J, Besse B. Current panorama and challenges for neoadjuvant cancer immunotherapy. Clin Cancer Res. 2020 May 20:clincanres.3255.2020. doi: 10.1158/1078-0432.CCR-19-3255.
O'Donnell JS, Hoefsmit EP, Smyth MJ, Blank CU, Teng MWL. The Promise of Neoadjuvant Immunotherapy and Surgery for Cancer Treatment.Clin Cancer Res. 2019 Oct 1;25(19):5743-5751. doi: 10.1158/1078-0432.CCR-18-2641.
Sholl LM.Understanding patterns of pathologic response following neoadjuvant immunotherapy for solid tumors. Ann Oncol. 2018 Aug 1;29(8):1630-1632. doi: 10.1093/annonc/mdy227.
Niknafs N, Smith KN, Velez MJ, Sauter JL, Isbell JM, Jones DR, Battafarano RJ, Yang SC, Danilova L, Wolchok JD, Topalian SL, Velculescu VE, Pardoll DM, Brahmer JR, Hellmann MD, Chaft JE, Cimino-Mathews A, Taube JM.Pathologic features of response to neoadjuvant anti-PD-1 in resected non-small-cell lung carcinoma: a proposal for quantitative immune-related pathologic response criteria (irPRC). Ann Oncol . 2018 Aug 1;29(8):1853-1860. doi: 10.1093/annonc/mdy218.
Parra ER, Villalobos P, Behrens C, Jiang M, Pataer A, Swisher SG, William WN Jr, Zhang J, Lee J, Cascone T, Heymach JV, Forget MA, Haymaker C, Bernatchez C, Kalhor N, Weissferdt A, Moran C, Zhang J, Vaporciyan A, Gibbons DL, Sepesi B, Wistuba II.Effect of neoadjuvant chemotherapy on the immune microenvironment in non-small cell lung carcinomas as determined by multiplex immunofluorescence and image analysis approaches. J Immunother Cancer . 2018 Jun 6;6(1):48. doi: 10.1186/s40425-018-0368-0.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#非小细胞#
0
#新辅助#
72
学习了,感谢
139
#新辅助免疫治疗#还有很多现实难题
213