国际会议:2023 WCLC:肺癌重点研究摘要速览!
2023-08-18 e路新干线 e路新干线 发表于上海
2023年世界肺癌大会(WCLC)将于9月9日至12日在新加坡举行。作为全球权威的致力于肺癌和其他胸部恶性肿瘤的学术会议,届时将披露众多国际前沿临床科研成果和数据。
前言
2023年世界肺癌大会(WCLC)将于9月9日至12日在新加坡举行。作为全球权威的致力于肺癌和其他胸部恶性肿瘤的学术会议,届时将披露众多国际前沿临床科研成果和数据。
目前WCLC官网在线发布了入选研究的摘要信息,e路新干线小编第一时间整理了药物治疗重点研究(PL尚未公布),包括的报告类型有:Oral(OA)和Mini Oral(MO),以飨读者。
全体大会(PL)摘要暂未公布,完整终版的摘要全文将在研究演示当天在线发布
摘要号:PL03.13
Osimertinib With/Without Platinum-Based Chemotherapy as First-line Treatment in Patients with EGFRm Advanced NSCLC (FLAURA2)
FLAURA2:奥希替尼±含铂化疗一线治疗EGFR突变晚期NSCLC
报告人:P. Janne
01 早期NSCLC
摘要号:OA12.06
围术期度伐利尤单抗+新辅助化疗治疗可切除NSCLC疗效显著
题目:AEGEAN:新辅助度伐利尤单抗+化疗治疗后辅助度伐利尤单抗治疗可切除EGFR突变NSCLC
报告人:赫捷 院士(中国医学科学院肿瘤医院)
背景
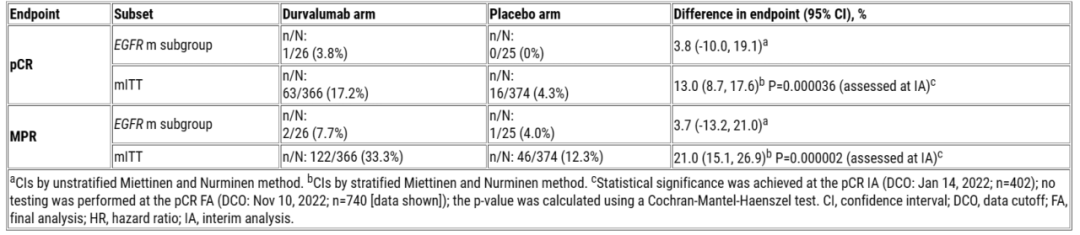
在3期AEGEAN试验中,围术期度伐利尤单抗+新辅助化疗与单独新辅助化疗相比,显著提高了可切除NSCLC患者的无事件生存期(EFS)和病理完全缓解率(pCR),且具有可控的安全性。然而,EGFR/ALK突变的患者从改良意向治疗(mITT)人群的疗效分析中被排除,因此本次报道了AEGEAN研究中对可切除EGFR突变NSCLC患者的探索性分析。
方法
AEGEAN是一项安慰剂对照研究,纳入标准为≥18岁既往未经治疗的可切除NSCLC(Ⅱ-ⅢB期[N2];AJCC第8版)和ECOG PS 0/1。患者按1:1的比例随机接受术前新辅助含铂化疗+度伐利尤单抗或安慰剂IV(Q3W,4个周期),随后接受术后度伐利尤单抗或安慰剂IV(Q4W,最多12个周期)。随机分组根据疾病分期(Ⅱ期 vs. Ⅲ期)和PD-L1表达(<1% vs. ≥1%;Ventana SP263)进行分层。对EGFR突变状态进行中央评估。主要终点是BICR中央评估的mITT人群EFS(RECIST v1.1)和pCR。次要终点包括中央评估的mITT人群主要病理缓解(MPR)以及接受≥1次研究治疗剂量的患者的安全性,在EGFRm患者中进行结果评估。研究结果见下表。
疗效总结表
02 晚期/转移性NSCLC免疫治疗
摘要号:OA09.04
度伐利尤单抗+曲美木单抗+化疗治疗使用EGFR抑制剂后进展的EGFR突变NSCLC显示出良好的抗肿瘤活性
题目:ILLUMINATE:度伐利尤单抗+曲美木单抗+化疗治疗使用EGFR抑制剂后进展的EGFR突变NSCLC的疗效和安全性
报告人:C. Lee
背景
在酪氨酸激酶抑制剂(TKI)治疗后疾病进展的晚期EGFR突变型肺癌中,免疫检查点抑制剂(ICI)的作用仍不明确,虽然ICI单药治疗的疗效较差,但ICl联合化疗已被证明与单独化疗相比更能提高该类患者人群的生存率。研究者进行了一项2期研究,旨在评估双ICl度伐利尤单抗和曲美木单抗联合铂类-培美曲塞化疗在EGFR TKI治疗后进展的转移性EGFR突变肺癌患者中的疗效和耐受性。
方法
这项国际性、非比较性、双队列研究纳入了来自澳大利亚10个地区和台湾6个地区的成年患者。符合条件的受试者被分配到研究队列1(组织和血浆检测EGFR 20外显子T790M阴性);奥希替尼一线治疗或第1/2代TKI单线治疗后进展)或队列2(组织和/或血浆检测T790M阳性;包括奥希替尼在内的≥1线TKl治疗后进展)。患者接受度伐利尤单抗 1500 mg+曲美木单抗 75 mg+铂类-培美曲塞化疗,Q3W,4个周期,随后接受度伐利尤单抗 1500 mg和培美曲塞500 mg/m2维持治疗,Q4W,直至疾病进展或无法耐受治疗。主要终点为客观缓解率(ORR)。次要终点包括疾病控制率(DCR)、无进展生存期(PFS)、12个月PFS率(PFS12)和不良事件(AE)。
结果
在2019年4月至2022年11月期间,100例受试者入组,每个研究队列分别有50人。所有符合条件的受试者均接受了研究治疗。1例不符合条件的受试者被排除在分析之外。大多数患者为女性(n=64,64%),PS为1(51%),中位年龄为60岁(32-77岁)。大多数受试者是亚裔(77%)且从不吸烟(73%)。57%的受试者EGFR 19外显子缺失,42%为EGFR 21外显子L858R。中位随访22个月后(四分位数范围,15-31个月),队列1和队列2的ORR分别为15/48(31%,95%CI 20-45)和10/48(21%,95%CI 12-34)。队列1和队列2的DCR分别为42/48(88%,95%CI 75-94)和36/48(75%,95%CI 61-85)。队列1中位PFS (mPFS)为7.0个月(IQR,4.6-17个月),PFS12为35%(95% Cl,23%-53%)。队列2的mPFS为4.9个月(IQR,2.9-8.4个月),PFS12为13%(95% Cl,6.4%-28%)。在可评估PD-L1的队列1中,PD-L1<50%(N=9)受试者的PFS优于PD-L1≥50%(N=20)(mPFS:9.8 vs. 4.6个月)。在每个研究队列中,19外显子缺失与21外显子L858R之间的PFS无显著差异。未发生5级免疫相关不良事件(irAE),17例(17%)报告了3-4级irAE,包括结肠炎(8%)、肝炎(4%)、肾上腺功能不全(2%)和肺炎(1%)。6例(6%)患者的irAE导致研究治疗停止。两个队列3-4级irAE发生率无显著差异(10% vs. 18%,p=0.40)。
结论
度伐利尤单抗和曲美木单抗联合化疗显示出良好的抗肿瘤活性,特别是在EGFR T790M阴性患者中,安全性结果与晚期肺癌化疗免疫治疗已知的不良事件一致。
摘要号:OA09.05
斯鲁利单抗+化疗一线治疗显著改善鳞状NSCLC患者生存
题目:ASTRUM-004:斯鲁利单抗+化疗一线治疗鳞状NSCLC的3期研究
报告人:周彩存 教授(上海市肺科医院)
背景
既往鳞状非小细胞肺癌(sNSCLC)的治疗主要基于化疗。在未经选择的晚期或转移性sNSCLC患者的一线治疗中,化疗联合PD-1/PD-L1抑制剂的疗效优于单独化疗,然而在全球范围内,对于晚期sNSCLC患者,具有良好获益-风险比的首选治疗方案仍然有限。在此报告了一项斯鲁利单抗(一种新型抗PD-1抗体)+化疗(卡铂和白蛋白紫杉醇)治疗既往未经全身治疗的局部晚期或转移性sNSCLC的3期研究结果。
方法
在这项随机、双盲、国际多中心3期研究中,既往未接受过全身治疗、组织学或细胞学确诊的ⅢB/ⅢC或Ⅳ期sNSCLC患者按2:1比例随机接受斯鲁利单抗4.5 mg/kg IV或安慰剂(最多35个周期)+化疗(卡铂和白蛋白紫杉醇,4-6个周期),Q3W。分层因素为PD-L1表达水平(TPS≥50% vs. 1%≤TPS<50% vs. TPS<1%)、种族(亚洲 vs. 非亚洲)和疾病分期(ⅢB/ⅢC期 vs. Ⅳ期)。主要终点是独立影像审查委员会(IRRC)根据RECIST v1.1评估的无进展生存期(PFS)。次要终点包括其他疗效指标、安全性和生物标志物探索。
结果
在此报告了预先指定的总生存期(OS)最终分析的结果,同时也是PFS和安全性的最新分析。截至2023年1月31日,共有537例受试者被随机分配至斯鲁利单抗+化疗组(n=358)或安慰剂+化疗组(n=179)。入组受试者的中位年龄为63.0岁,90.9%的患者为男性。中位随访31.1个月,斯鲁利单抗+化疗组 vs. 安慰剂+化疗组的PFS获益得以维持(IRRC评估,中位PFS:8.3 vs. 5.7个月;HR=0.55,95% CI 0.43-0.69)。在预先指定的亚组中,PFS的HR始终倾向于斯鲁利单抗+化疗组。随着斯鲁利单抗的加入,OS显著延长(中位OS:22.7 vs. 18.2个月;HR=0.73,95% Cl 0.58-0.93;p=0.010,跨越显著性界值0.046)。两组分别报告了127例(35.5%)和57例(31.8%)与斯鲁利单抗或安慰剂相关的≥3级不良事件,最常见的是中性粒细胞计数减少(14.8% vs. 14.5%)、贫血(12.0% vs. 10.6%)、白细胞计数减少(10.1% vs. 11.2%)。106例(29.6%)和31例(17.3%)患者报告了irAE,最常见的是甲状腺功能减退(6.4% vs. 0.6%)、皮疹(5.0% vs. 1.1%)和免疫介导的肺部疾病(4.2% vs. 0.6%)。
结论
与安慰剂相比,斯鲁利单抗显著改善了既往未经治的局部晚期或转移性sNSCLC患者的生存且安全性可控,斯鲁利单抗+化疗可能是这类患者的一种有前景的治疗选择。
摘要号:OA09.06
阿替利珠单抗+贝伐珠单抗+化疗一线治疗转移性非鳞状NSCLC患者(中国人群数据)未达主要终点
题目:IMpower151:阿替利珠单抗+贝伐珠单抗+化疗一线治疗转移性非鳞状NSCLC的3期研究
报告人:周彩存 教授 (上海市肺科医院)
背景
在IMpower150(NCT02366143)研究中,一线阿替利珠单抗(抗PD-L1)+贝伐珠单抗(抗VEGF)+卡铂+紫杉醇与贝伐珠单抗+卡铂+紫杉醇相比,显著改善无EGFR/ALK突变的转移性非鳞状NSCLC(nsqNSCLC)的PFS和OS,这使得阿替利珠单抗联合贝伐珠单抗和化疗一线治疗转移性nsqNSCLC获得了全球批准。为了解决患者基因组(如EGFR突变发生率)和临床实践(如培美曲塞的使用)的区域差异,研究者在中国进行了3期IMpower151 (NCT04194203)研究,以评估阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇或培美曲塞(ABCP) vs. BCP一线治疗转移性nsqNSCLC的有效性和安全性。
方法
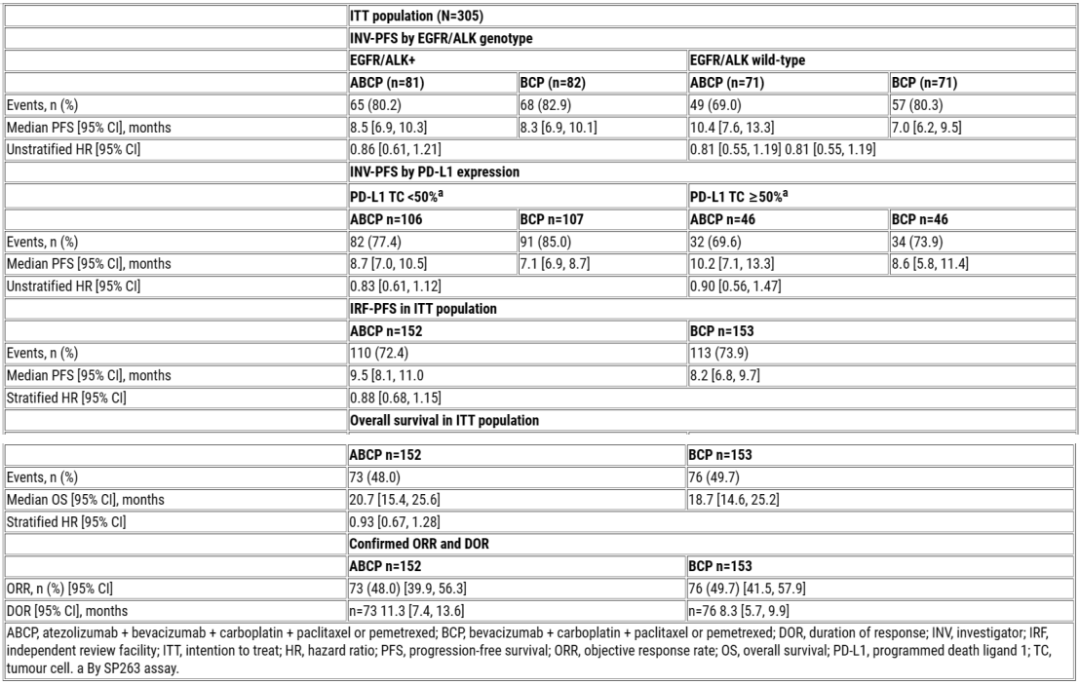
未经化疗的转移性nsqNSCLC患者按1:1随机分配接受阿替利珠单抗/安慰剂(1200 mg)+贝伐珠单抗(15 mg/kg)+卡铂(AUC 6)+紫杉醇(175 mg/m2)或培美曲塞(500 mg/m2)IV Q3W,持续4个周期,随后阿替利珠单抗/安慰剂维持治疗直至出现不可耐受的毒性或无临床获益,贝伐珠单抗和培美曲塞(如果在诱导期间给予)治疗直至疾病进展(RECIST 1.1)。分层因素为EGFR/ALK基因型(突变 vs. 野生型,上限为50%野生型)和PD-L1表达(TC<50% vs. ≥50% SP263检测)。主要终点为研究者(INV)-PFS (ITT人群)。次要终点包括EGFR/ALK+人群的INV-PFS、PD-L1亚组的INV-PFS、独立评估机构(IRF)-PFS、OS、ORR和DOR。
结果
截至数据截止日期(2023年2月2日),中位随访时间为14个月,305例随机患者(ITT人群)中,297例(97.4%)使用培美曲塞;239例发生PFS事件。ABCP vs. BCP的中位INV-PFS为9.5个月 vs. 7.1个月(分层HR=0.84;95% Cl: 0.65, 1.09;p=0.1838)。INV-PFS与IRF-PFS一致。EGFR/ALK+亚组的PFS在两组之间相似,而在野生型亚组中显示出数值差异(10.4个月 vs. 7.0个月)。无PD-L1依赖性PFS差异。其他疗效数据见表。所有AE发生率为99.3% (ABCP 3/4级,66.4%)和100% (BCP 3/4级,61.4%),导致停止任何治疗AE发生率分别为23.0%和15.0%。所有5级AE发生率为7.9% (ABCP 治疗相关,5.9%)和7.8% (BCP 治疗相关,6.5%)。特别关注不良事件(AESI)发生率为67.8% (ABCP 3/4级,11.2%)和71.2% (BCP 3/4级,7.2%)。
疗效总结表
结论
IMpower151在转移性nsqNSCLC中未达到其主要终点INV-PFS,与BCP相比,ABCP组PFS和OS在数值上有所改善。ABCP一般耐受性良好,没有观察到新的安全信号。
靶向治疗
摘要号:OA05.03
HER3-DXd治疗EGFR TKI和含铂化疗后进展的EGFR突变NSCLC安全有效
题目:HERTHENA-Lung01:patritumab deruxtecan(HER3-DXd)治疗EGFR TKI和含铂化疗后进展的EGFR突变NSCLC
报告人:H.A. Yu
背景
对于EGFR突变的NSCLC患者,EGFR TKI和含铂化疗(PBC)后需要安全有效的新疗法。HER3-Dxd(patritumab deruxtecan,U3-1402)是一种抗体药物偶联物,由人源化抗HER3 单克隆抗体与拓扑异构酶Ⅰ抑制剂有效载荷,通过可裂解四肽连接子组合而成。在一项1期研究(NCT03260491)中,HER3-DXd在EGFR TKI和PBC治疗后的晚期EGFR突变NSCLC患者中显示出有希望的疗效和可控的安全性。在此报告2期HERTHENA-Lung01试验结果(NCT04619004)。
方法
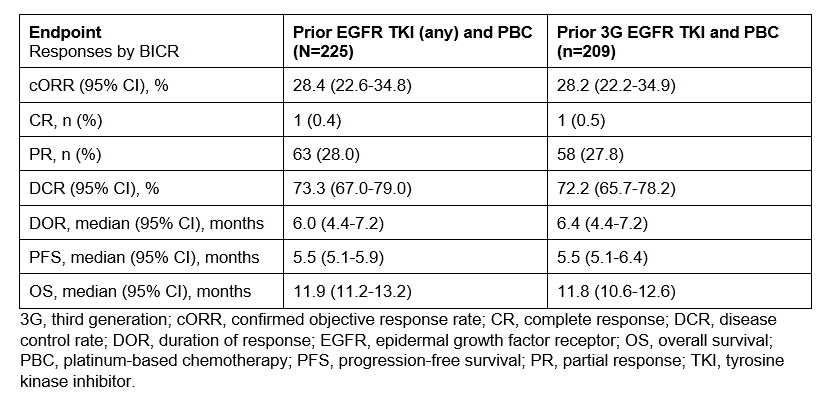
这项开放标签研究随机纳入了既往经EGFR TKI和PBC治疗的晚期EGFR突变NSCLC患者。患者接受HER3-DXd两种剂量方案中的一种:5.6 mg/kg IV Q3W或升级方案(3.2-4.8-6.4 mg/kg)。基于1期数据的获益-风险评估,升级组的入组提前结束,5.6 mg/kg组的入组完成。主要终点为盲态独立中心评估(BICR)根据RECIST 1.1确认的ORR。
结果
在5.6 mg/kg组中,225例患者接受HER3-DXd治疗。截至2022年11月21日,中位研究持续时间为13.1个月(范围,9.0-21.6),中位治疗持续时间为5.5个月(范围,0.7-18.2)。BICR确认的ORR为28.4%;中位DOR为6.0个月;中位PFS为5.5个月;中位OS(初步)为11.9个月。既往使用过奥希替尼的患者也有类似的结果(见下表)。在治疗前广泛的HER3膜表达和不同的EGFR TKI耐药机制中观察到了临床活性。在基线时未放疗的脑转移患者中(n=30), BICR根据RECIST确认的CNS ORR为36.7% (95% Cl,19.9%-56.1%;10/30完全缓解,1/30部分缓解)。AE是可控和可耐受的,与既往观察结果一致:10例患者(4.4%)发生药物相关导致停止治疗的AE,4例患者(1.8%)发生药物相关死亡;45.3%的患者发生≥3级药物相关AE;12例患者(5.3%)有独立诊断的药物相关性间质性肺疾病(1/2级,n=9;3级,n=2;5级,n=1)。
疗效总结表
结论
在该治疗需求未满足和治疗选择有限的患者群体中,HER3-DXd显示出有临床意义的疗效,此外,本研究首次报道了HER3-DXd在中枢神经系统中的疗效,安全性是可控的。总的来说,HER3-DXd对于既往经治的EGFR突变NSCLC是一种很有希望的治疗方法。一项在EGFR TKI治疗后进展的EGFR突变NSCLC患者中开展的3期研究正在进行中(HERTHENA-Lung02;NCT05338970)。
ALK
摘要号:OA03.05
伊鲁阿克显著改善了局部晚期或转移性ALK+ NSCLC的PFS
题目:伊鲁阿克(WX-0593) vs. 克唑替尼治疗局部晚期或转移性ALK+ NSCLC的随机3期研究
报告人:石远凯 教授(中国医学科学院肿瘤医院)
背景
伊鲁阿克(WX-0593)是一种间变性淋巴瘤激酶(ALK)/c-ros癌基因1 (ROS1)酪氨酸激酶抑制剂(TKI),在克唑替尼治疗后进展的晚期ALK + NSCLC的2期临床研究中显示出临床活性。这项3期研究(NCT04632758)是一项开放标签、随机、多中心的研究,旨在评估伊鲁阿克 vs. 克唑替尼治疗未经ALK TKI治疗的局部晚期或转移性ALK + NSCLC的疗效。在此报告预先计划的期中结果分析(IA)。
方法
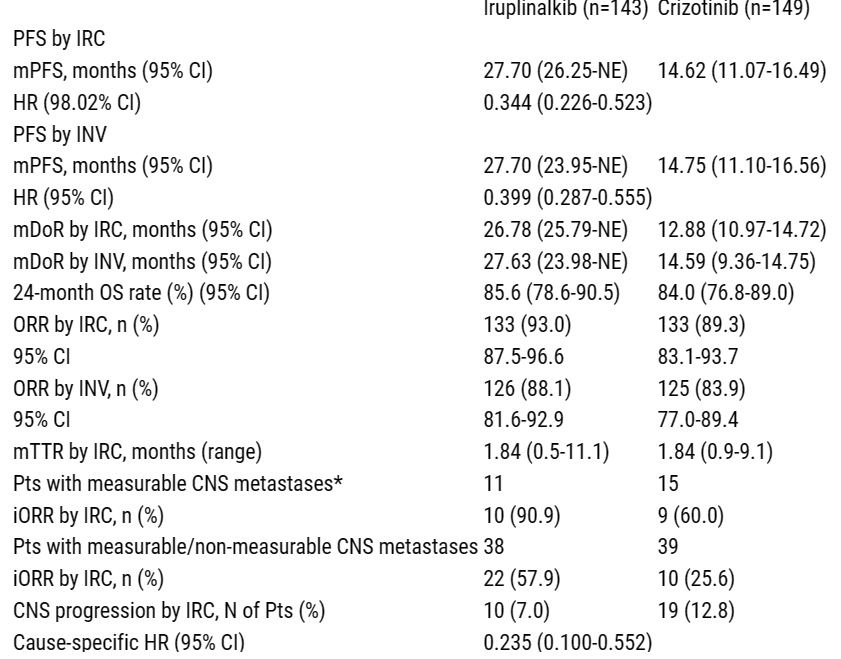
既往未经ALK TKI治疗的ⅢB/Ⅳ期ALK+ NSCLC患者随机(1:1)分为口服伊鲁阿克 180 mg QD (7天导入期60 mg QD)或克唑替尼250 mg BID,分层因素为既往化疗线数、基线中枢神经系统(CNS)转移和既往针对CNS转移进行的放射治疗。主要终点是由独立审查委员会(IRC)根据RECIST 1.1评估的无进展生存期(PFS)。次要终点包括研究者(INV)评估的PFS 、客观缓解率(ORR)、至缓解时间(TTR)、缓解持续时间(DoR)、颅内ORR (iORR)及IRC和INV评估的至CNS进展的时间、总生存期(OS)和安全性。在192起预期PFS事件中,145起(76%)发生时进行计划的IA。
结果
2019年9月4日至2020年12月2日,292例患者随机接受治疗(伊鲁阿克/克唑替尼,n=143/149)。61例(20.9%)患者既往接受过化疗(伊鲁阿克/克唑替尼,20.3%/21.5%)。至IA数据截止日期2022年11月13日,IRC评估的PFS中位随访时间为23.98个月(伊鲁阿克)和24.54个月(克唑替尼)。IRC评估的中位PFS为27.70个月(伊鲁阿克)和14.62个月(克唑替尼)(HR=0.344[98.02% CI,0.226-0.523];分层单侧log-rank p<0.0001)。其他疗效结果见表。3/4级AE发生率为58.7%(伊鲁阿克)和55.0%(克唑替尼)。伊鲁阿克组最常见的3/4级AE是高血压。
疗效总结表
结论
与克唑替尼相比,伊鲁阿克显著改善了PFS、ORR和iORR。伊鲁阿克可能是未经ALK TKI治疗的晚期ALK+ NSCLC患者的一种新的治疗选择。
HER2
摘要号:MA13.10
德曲妥珠单抗治疗HER2突变转移性NSCLC显示持久缓解
题目:德曲妥珠单抗治疗HER2突变转移性NSCLC:DESTINY-Lung02研究的主要结果
报告人:P. Janne
背景
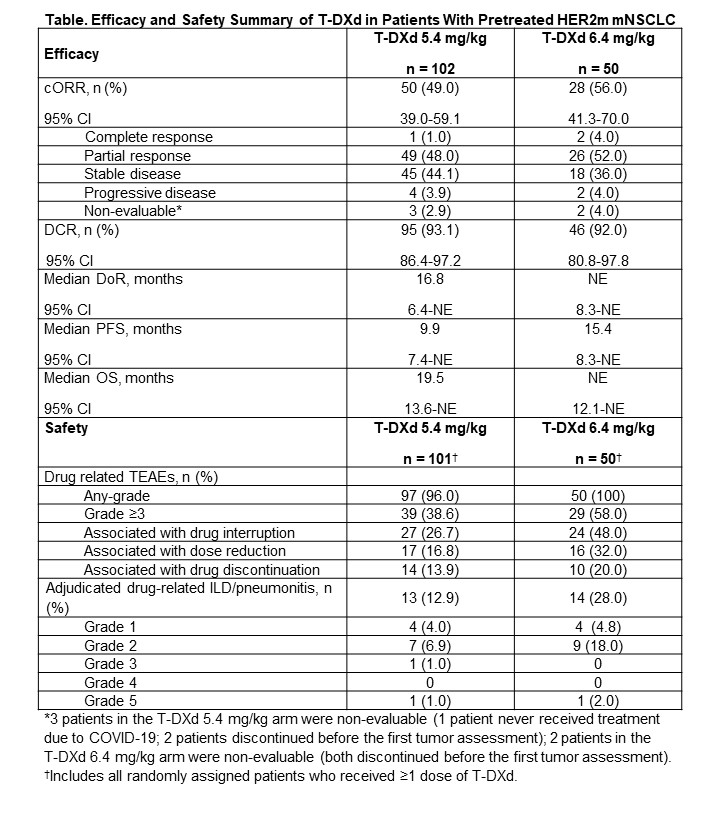
在DESTINY-Lung01研究中,德曲妥珠单抗(T-DXd)6.4 mg/kg在HER2(ERBB2)突变(HER2m)转移性非小细胞肺癌(mNSCLC)患者中显示出强大而持久的疗效。DESTINY-Lung02 (NCT04644237)评估了2种剂量的T-DXd。期中结果显示,在该患者群体中T-DXd 5.4 mg/kg和6.4 mg/kg具有临床意义的活性。这些数据联合DESTINY-Lung01的数据使得T-DXd 5.4 mg/kg治疗既往经治的HER2m mNSCLC在美国获得加速批准。在此报告DESTINY-Lung02研究的主要分析结果。
方法
在这项盲态、非比较性、2期试验中,既往经治的HER2m mNSCLC患者被随机分配(2:1)接受T-DXd 5.4 mg/kg或6.4 mg/kg Q3W。主要终点为盲态独立中心评估(BICR)确认的客观缓解率(cORR),关键次要终点包括缓解持续时间(DoR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)和安全性。通过比较cORR 95% Cl的下限与ORR基准26.4%来进行统计学假设检验。本研究的统计学功效不足以比较两种剂量。
结果
至数据截止日期(2022年12月23日),102例和50例患者分别被随机分配到T-DXd 5.4 mg/kg组或6.4 mg/kg组。T-DXd 5.4 mg/kg组的中位随访时间为11.5个月(范围1.1-20.6),T-DXd 6.4 mg/kg组的中位随访时间为11.8个月(范围0.6-21.0)。在T-DXd分别为5.4和6.4 mg/kg组中,BICR评估的cORR分别为49.0% (95% Cl,39.0%-59.1%)和56.0% (95% Cl,41.3%-70.0%), 中位DoR为16.8个月(95% Cl,6.4-不可估计[NE])和NE (95% CI,8.3-NE), 中位PFS分别为9.9个月(95% CI,7.4-NE)和15.4个月(95% Cl,8.3-NE)(表)。T-DXd 5.4 mg/kg组的中位治疗持续时间为7.7个月(范围0.7-20.8),T-DXd 6.4 mg/kg组为8.3个月(范围0.7-20.3)。接受T-DXd 5.4 mg/kg和6.4 mg/kg治疗的患者中,分别有39/101(38.6%)和29/50(58.0%)发生了≥3级药物相关治疗不良事件(见下表),分别有13/101(12.9%)和14/50(28.0%)发生了确诊的药物相关性ILD/肺炎。
疗效和安全性总结表
结论
T-DXd 5.4和6.4 mg/kg在既往经治的HER2m mNSCLC患者中继续表现出强大和持久的缓解以及可耐受且通常可控的安全性。与6.4 mg/kg剂量相比,5.4 mg/kg剂量具有更有利的安全性和更低的ILD/肺炎发生率。
Trop2
摘要号:OA05.04
戈沙妥珠单抗+帕博利珠单抗一线治疗转移性NSCLC初显疗效
题目:戈沙妥珠单抗+帕博利珠单抗一线治疗转移性NSCLC:EVOKE-02研究的初步结果
报告人:B.C. Cho
背景
基于程序性死亡(配体)1 (PD-[L]1)抑制剂的方案是转移性非小细胞肺癌(mNSCLC)的标准一线治疗方案,目前需要新的联合方案来进一步改善预后。戈沙妥珠单抗 (SG)是一种靶向Trop-2的抗体药物偶联物,在经治的mNSCLC患者中显示出临床活性和可控的安全性。正在进行的全球、开放标签、多队列2期EVOKE-02研究(NCT05186974)正在评估SG+帕博利珠单抗(pembro)±铂类一线治疗mNSCLC的疗效。在此报告了队列A和队列B接受SG+pembro治疗的患者的初步结果。
方法
队列A和队列B的纳入标准为既往未经治疗的、无可操作的基因突变、ECOG PS为0或1的成人mNSCLC患者。PD-L1 TPS≥50%(队列A)和PD-L1 TPS<50%(队列B)的患者接受SG 10 mg/kg d1、8+ pembro 200 mg d1,21天为一个周期。试验终点包括客观缓解率(ORR,根据RECIST v1.1)、无进展生存期、缓解持续时间、疾病控制率、总生存期和安全性。在本次初步报告中,我们报告了接受≥1剂研究治疗的安全性可评估患者的安全性结果,以及随访≥13.0周的疗效可评估患者的疗效结果。
结果
截至2023年1月13日,44例患者(队列A,n=16;队列B,n=28)入组并接受了SG+pembro治疗。中位年龄为68岁(47-80岁);64%的患者为非鳞状组织学;77%的ECOG PS为1。在疗效可评估的患者中(队列A,n=8;队列B,n=18),研究者评估的队列A的ORR为75%(5例确认的部分缓解[PR]和1例待确认的PR),队列B的ORR为44%(7例确认的PR和1例待确认的PR)(见下表)。在安全性可评估的患者(n=44)中,任何级别TEAE的发生率为96%(3/4级,52%)。最常见的任何级别的TEAE为腹泻(50%)、贫血(41%)、虚弱(36%)和中性粒细胞减少症(32%)。导致SG停药的TEAE发生率为7%。报告了3例(7%)导致死亡的TEAE,仅1例(2%)患者被认为与研究治疗相关。
疗效总结表
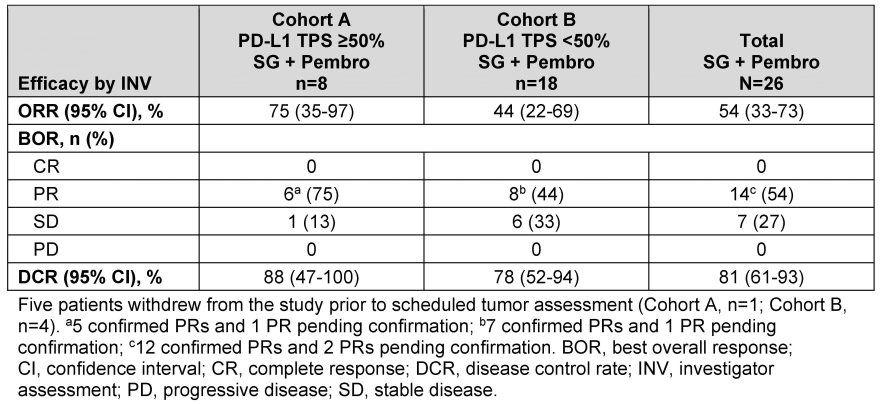
结论
在队列A和队列B中,SG+pembro在既往未经治疗的mNSCLC中显示出令人鼓舞的早期疗效和可控的安全性,其安全性与每个单独药物的已知的安全性一致。研究将在更多患者和更长时间随访中获得更多结果。
03 SCLC
摘要号:OA01.06
替雷利珠单抗+化疗一线治疗广泛期SCLC具有显著的临床获益
题目:替雷利珠单抗±化疗一线治疗广泛期SCLC:3期RATIONALE-312研究
报告人:程颖 教授(吉林省肿瘤医院)
背景
在2期BGB-A317-206研究中,抗程序性细胞死亡蛋白1单克隆抗体替雷利珠单抗联合化疗一线治疗的广泛期小细胞肺癌(ES-SCLC)患者显示出有希望的抗肿瘤活性。在此研究者报告了随机、双盲、安慰剂对照的3期RATIONALE-312研究(NCT04005716)的最终分析,该研究比较了替雷利珠单抗+化疗 vs. 安慰剂+化疗一线治疗ES-SCLC患者的疗效和安全性。
方法
符合纳入标准、既往未经治疗的中国ES-SCLC患者按1:1随机分组接受替雷利珠单抗200 mg或安慰剂+依托泊苷+卡铂或顺铂 IV Q3W 4个周期,随后替雷利珠单抗200 mg 或安慰剂维持治疗直至疾病进展、无临床获益、不可耐受的毒性或撤回知情。主要终点是意向治疗分析集的总生存期(OS)。关键次要终点包括研究者评估的无进展生存期(PFS)、客观缓解率(ORR)和持续缓解时间(DoR)(根据RECIST v1.1)以及安全性结果。
结果
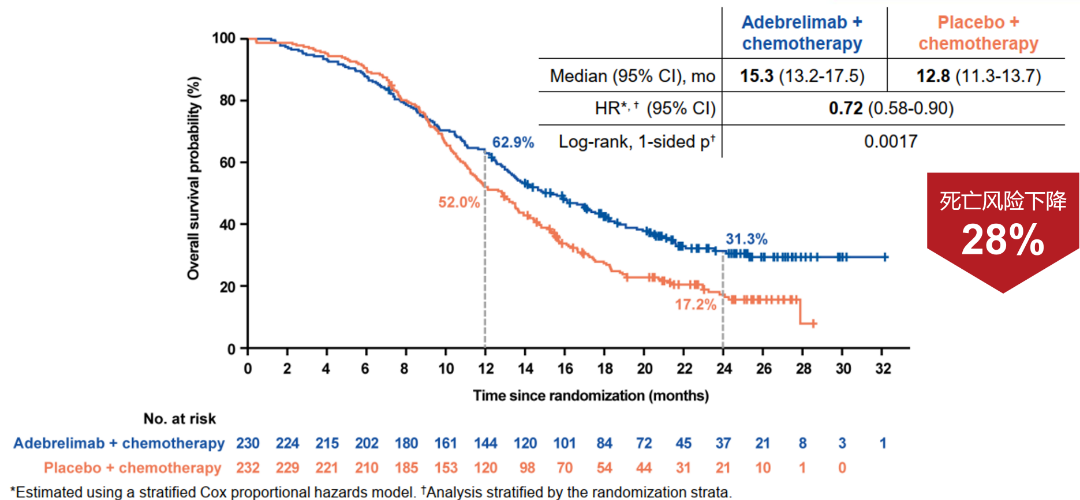
在2019年7月22日至2021年4月22日期间,457例患者被随机分配(替雷利珠单抗组,n=227;安慰剂组,n=230)。治疗组之间基线人口统计特征总体平衡。与安慰剂组相比,替雷利珠单抗组在基线时观察到更高的肿瘤负荷;更多的患者患有晚期疾病(AJCC Ⅳ期:91.2% vs. 87.4%)和≥3个转移性病灶(80.6% vs. 71.3%)。至最终数据截止日期(2023年4月19日),中位随访时间为14.2个月(0.1-44.9)。与安慰剂+化疗相比,替雷利珠单抗+化疗显示出具有统计学意义的显著OS获益(分层HR=0.75[95%Cl:0.61,0.92];P=0.0035;中位OS:15.5 [95% Cl:13.5,17.1] vs. 13.5个月[95% Cl:12.1,14.9])。替雷利珠单抗组的1年、2年和3年的OS率分别为62.7%、33.2%和25.0%,安慰剂组分别为58.4%、22.4%和9.3%。与安慰剂+化疗相比,替雷利珠单抗+化疗显著改善PFS(分层HR=0.63 [95% Cl:0.51,0.78];P<0.0001;中位PFS:4.8 [95% Cl:4.3,5.5] vs. 4.3个月[95% Cl:4.2,4.4])。此外,与安慰剂组相比,替雷利珠单抗组观察到改善的确认ORR(68.3% vs. 61.7%)和更持久的缓解(中位DoR 4.3 vs. 3.7个月)。在替雷利珠单抗组中,59.9%的患者接受了≥1次后续全身抗癌治疗,而安慰剂组为73.9%。在安全性分析集中,替雷利珠单抗组中有85.5%的患者发生了≥3级TRAE,安慰剂组为86.0%,其中最常见(≥10%患者)的是血液学毒性。在替雷利珠单抗组中,31.3%的患者发生了严重TRAE,安慰剂组为17.9%。免疫介导不良事件(imAE)的发生率在替利单抗组为38.3%,在安慰剂组为17.9%。大多数imAE可以通过全身类固醇或激素治疗来控制。
结论
与安慰剂+化疗相比,替雷利珠单抗+化疗一线治疗既往未经治疗的ES-SCLC具有显著的临床获益和可控的安全性。
在线摘要网址:https://cattendee.abstractsonline.com/meeting/10925?view=appendToCards&initialSearchId=3&searchId=10
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言