盘点:梳理白血病干细胞研究重大进展
2016-07-24 佚名 生物谷
白血病是一类造血干细胞恶性克隆性疾病。克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他组织和器官,同时正常造血受抑制。临床可见不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛。据报道,我国各地区白血病的发病率在各种肿瘤中占第六位。按起病的缓急可分为急、慢性白血病。急性白血病细胞分化停滞在早期阶段,以原始及早幼细胞为主,疾病发展迅
白血病是一类造血干细胞恶性克隆性疾病。克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他组织和器官,同时正常造血受抑制。临床可见不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛。据报道,我国各地区白血病的发病率在各种肿瘤中占第六位。
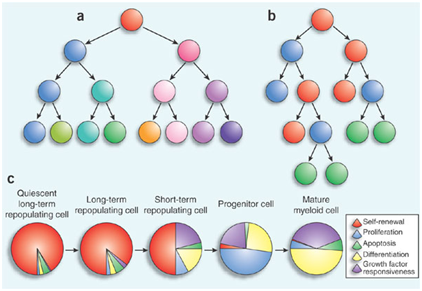
按起病的缓急可分为急、慢性白血病。急性白血病细胞分化停滞在早期阶段,以原始及早幼细胞为主,疾病发展迅速,病程数月。慢性白血病细胞分化较好,以幼稚或成熟细胞为主,发展缓慢,病程数年。
急性白血病分为急性淋巴细胞性白血病(ALL)和急性非淋巴细胞性白血病(ANLL)两大类,结果如下: ①ANLL分为8个亚型:急性髓性白血病微分化型(M0)、粒细胞白血病未分化型(M1)、粒细胞白血病部分分化型(M2)、早幼粒细胞型(M3)、粒-单核细胞型(M4)、单核细胞型(M5)、红白血病(M6)、巨核细胞型(M7); ②ALL分为三个亚型:FAB分型:L1、L2和L3型。
近年来又根据细胞的免疫学特点,ALL根据免疫表型不同可分为B-细胞和T-细胞两大类。2000年,WHO将急性淋巴细胞白血病(ALL)分为三种亚型:(1)前体B细胞急性淋巴细胞白血病;(2)前体T细胞急性淋巴细胞白血病(T—ALL);(3)Burkitt细胞白血病。FAB分型中的急淋形态学亚型分型方法,因可重复性较差,现已基本放弃,不再把急性淋巴细胞白血病分为L1、L2、L3。
慢性白血病可分为:慢性淋巴细胞白血病;慢性粒细胞白血病;慢性粒-单核细胞白血病;单核细胞;红血病。
此外,还存在特殊类型白血病,可分为:慢粒急变;低增生性;淋巴肉瘤;组织细胞肉瘤;浆细胞;多毛细胞;嗜酸性粒细胞;嗜碱性粒细胞;组织嗜碱细胞;巨核细胞;未分化型急性白血病。
在过去15年多以来,越来越多的科学家发现不同类型的白血病中存在白血病干细胞,而且发现白血病干细胞是白血病发作和难以治疗的根源。为此,小编针对过去15年多以来这方面的研究进展,针对白血病干细胞进行一番详细盘点,希望有助于大家。
1. Cell Stem Cell:白血病干细胞借助脂肪组织躲避化疗药物杀伤
Cell Stem Cell, doi:10.1016/j.stem.2016.06.001
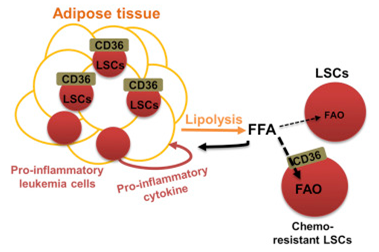
近日,来自美国科罗拉多大学的研究人员在国际学术期刊Cell Stem Cell上发表了一项最新研究进展,他们发现白血病干细胞能够在性腺旁脂肪组织中产生代谢适应性变化,从而抵抗化疗药物的杀伤作用,这项研究为解决白血病的耐药问题提供了重要的理论基础。
在这项最新研究中,研究人员发现一个白血病干细胞的亚群能够利用性腺旁脂肪组织作为一个合适环境支撑癌细胞代谢从而躲避化疗药物的杀伤。他们建立了一个慢性髓系白血病急变期小鼠模型,通过研究发现驻留在脂肪组织中的白血病干细胞呈现出促炎症表型,同时能够诱导性腺旁脂肪组织的脂质分解。
研究人员发现脂肪组织的脂质分解过程能够为白血病干细胞的脂肪酸氧化代谢提供燃料,特别是对于表达脂肪酸转运蛋白CD36的细胞亚群来说这种现象更加活跃。经过分析,CD36+的白血病干细胞具有独特的代谢特性,并且在脂肪组织中特别丰富,性腺旁脂肪组织提供的微环境也帮助这群白血病干细胞躲避了化疗药物的杀伤作用。
这些发现都表明白血病细胞与脂肪组织之间的相互作用能够为白血病干细胞创造一个独特的微环境,满足白血病细胞的代谢需求,同时也能够支持CD36+白血病干细胞亚群的生存。该研究为解决白血病耐药问题,找到新的治疗方法提供了重要的理论基础。
2. Cell Stem Cell:揭示利用ADAR1基因编辑系统产生白血病干细胞机制
Cell Stem Cell, doi:10.1016/j.stem.2016.05.004
肿瘤干细胞就像僵尸---即便肿瘤被破坏,它们也能够不断产生。这些细胞具有无限的自我再生能力,制造更多的肿瘤干细胞和更多的肿瘤。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校等机构的研究人员揭示出前白血病白细胞前体(pre-leukemic white blood cell precursor)如何变成白血病干细胞(一种肿瘤干细胞)。这项研究利用人细胞确定了RNA编辑酶ADAR1在白血病中发挥的作用,并且找到一种阻止它的方法。相关研究结果于2016年6月9日在线发表在Cell Stem Cell期刊上,论文标题为“ADAR1 Activation Drives Leukemia Stem Cell Self-Renewal by Impairing Let-7 Biogenesis”。
在这项研究中,酶ADAR1能够对微RNA(microRNA, miRNA)序列进行编辑。通过仅仅将一种miRNA中的一个碱基交换为另一个碱基,ADAR1能够改变细胞利用这种精心打造的系统控制哪些基因在哪些时间开启或关闭。
已知ADAR1促进癌症发展和产生耐药性。在这项研究中,Catriona Jamieson团队利用人急性转化期(blast crisis)慢性粒细胞白血病(chronic myeloid leukemia, CML)干细胞和接种这些细胞的小鼠,确定了ADAR1在控制白血病干细胞中的作用。
研究人员发现一系列分子事件。首先,携带促进白血病的基因突变的白细胞变得对炎性信号更加敏感。这种炎性反应激活ADAR1。接着,高度活化的ADAR1编辑系统对被称作let-7的miRNA进行编辑。最终,这种活性增加细胞再生或者说自我更新的能力,将白细胞前体转化为白血病干细胞。白血病干细胞促进一种侵袭性的耐药性的急性转化期CML产生。
在了解ADAR1编辑系统如何工作后,Jamieson团队寻找一种阻止它的方法。通过利用小分子化合物抑制对炎性信号的敏感性或抑制ADAR1,研究人员能够抵消ADAR1对白血病干细胞自我更新的影响,因而能够恢复let-7的作用。当利用一种被称作8-Aza的小分子对急性转化期CML干细胞处理时,相比于未经处理的CML干细胞,这些细胞的自我更新能力下降了大约40%。
3. Nature:靶向攻击p53和c-MYC可选择性清除白血病干细胞
Nature, doi:10.1038/nature18288
在一项新的研究中,来自英国格拉斯哥大学、曼彻斯特大学和澳大利亚墨尔本大学的一个跨学科研究团队揭示出慢性粒细胞白血病(chronic myeloid leukaemia, CML)的阿喀琉斯之踵(即致命弱点),并且发现在小鼠体内成功地靶向攻击这种弱点和根除这种疾病的药物。相关研究结果于2016年6月8日在线发表在Nature期刊上,论文标题为“Dual targeting of p53 and c-MYC selectively eliminates leukaemic stem cells”。该团队在6年多的时间里一直在开展这项研究。
这项研究分析了慢性粒细胞白血病干细胞(CML干细胞,是一种肿瘤干细胞)和正常的造血干细胞,发现两种蛋白是CML干细胞存活的关键。研究人员随后开发出一种药物组合,这种组合同时靶向作用于这两种关键性的蛋白,杀死这些肿瘤干细胞,同时在很大程度上不会伤害正常的造血干细胞。
这个由格拉斯哥大学教授Tessa Holyoake和曼彻斯特大学教授Tony Whetton领导的跨学科研究团队利用一系列技术证实这两种蛋白(p53和c-Myc)在CML中发挥关口控制器的作用。
依据精准医疗的概念(合适的药物在合适的时间在病人体内发挥合适的效果),研究人员利用CML的这种关键性的弱点,设计出一种新的治疗方法。利用移植到小鼠体内的CML干细胞开展研究,研究人员证实靶向这两种蛋白的药物组合杀死这些导致白血病的CML干细胞,有效地根除这种疾病。
这些结果对治疗急性髓性白血病(AML)和脑瘤等其他癌症产生潜在的重要影响。研究人员如今渴望在耐药性CML病人体内开展临床试验。Holyoake教授说,“我当然对这项研究中表现出的结果感到激动人心。这项研究---精准医疗起作用的一个绝佳例子---虽然处于初期阶段,但是我们获得的数据揭示出CML的两个弱点和一种潜在的药物组合疗法根除这些关键性的CML干细胞。”
4. Cell:重大发现!破坏白血病干细胞生物钟有望治疗白血病
Cell, doi:10.1016/j.cell.2016.03.015
根据一种说法,“时间就是一切。”对急性骨髓性白血病(acute myeloid leukemia, AML)而言,这种格言可能是真的。在一项新的研究中,由来自美国麻省理工学院-哈佛大学布罗德研究所、哈佛大学医学院和布莱根妇女医院的研究人员领导的一个国际团队报道AML干细胞---产生一种侵袭性血癌---不能够在其内部的昼夜节律失常时存活下来。相关研究结果发表在2016年4月7日那期Cell期刊上,论文标题为“Core Circadian Clock Genes Regulate Leukemia Stem Cells in AML”。
医学界早就意识到这种昼夜节律的存在。在过去50年,科学家们已经发现这种昼夜节律运行的一些基因回路(genetic circuitry)。但是一直并不清楚这种回路是否在每个细胞中都是有活性的,或者这种活性在癌细胞和健康细胞之间存在多大程度的差异。
在这项新的研究中,研究人员发现这种生物钟回路在健康的造血干细胞和癌变的AML造血干细胞中都起作用。然而,有趣的是,破坏这种回路---实际上就是破坏这种生物钟的运转---损害AML干细胞的活性,同时让健康的造血干细胞相对不受伤害。
论文通信作者、布罗德研究所研究员Benjamin Ebert说,“布罗德研究所卡拉曼细胞观察台(Klarman Cell Observatory)的一个项目就是研究白血病干细胞的这种生物钟回路。我们与布罗德研究所基因扰动平台(Genetic Perturbation Platform)合作开展基因筛选,目标就是鉴定出AML干细胞存活所必需的一组基因。”
令研究人员吃惊的是,在这种筛选中脱颖而出的两种基因是Clock和Bmal1---已知它们一起发挥作用,调节体内生物钟。
利用其它的方法(包括短发夹RNA、CRISPR/Cas9和小分子化学物)证实这些发现后,研究人员利用一种仅在血细胞内剔除Bmal1基因的基因敲除模式小鼠开展研究。他们发现尽管AML干细胞的生长需要Bmal1,但是正常的造血干细胞即便在Bmal1基因不表达时也能够存活。
5. Blood:抑制细胞周期蛋白依赖性激酶CDK6,让白血病干细胞沉睡
Blood, doi:10.1182/blood-2014-06-584417
尽管现在白血病的治疗得到了很大的进步,不过仍有许多患者会出现复发。白血病干细胞在白血病复发起到了关键的作用,而且许多研究提出只要消除白血病干细胞,白血病就可能得到完全的缓解。近日发表在Blood上一篇研究表示,已经找到能激活白血病干细胞的关键因子。
来自维也纳大学的这群研究人员从小鼠中分离干细胞,详细研究白血病干细胞和健康的干细胞到底存在哪些差别。他们随后关注到细胞周期蛋白依赖性激酶CDK6的特殊性。CDK6已知能调节细胞周期,实验发现CDK6参与白血病干细胞的激活。Cdk6缺乏的造血干细胞在骨髓移植后不能有效的增殖。将改造过的白血病干细胞抑制到健康小鼠,对比Cdk6+/+组小鼠20天0存活率,将Cdk6−/−的白血病干细胞移植后,小鼠60天存活率达100%,关键是未发展出白血病。究其背后的分子机制,CDK6其实是一个转录调节因子,它能抑制白血病干细胞和造血干细胞内的Egr1的表达,从而导致干细胞的激活。Egr1也是一个转录调节因子,参与细胞应激反应,细胞生长和细胞凋亡,Egr1的表达量在肿瘤细胞中普遍降低。研究人员通过In Vivo实验也证实了Cdk6-Egr1的调节对于细胞转化和增殖的影响。
考虑到在稳态下,白血病干细胞激活对于CDK6依赖性比正常干细胞更强烈—因为CDK6在应激条件下作用更明显,CDK6抑制剂或可能用于未来抑制白血病复发的治疗。不过对于相关的实用性和可能的副作用还需要更多的研究来探明。
6. Cell Stem Cell:协同响应基因调节白血病干细胞增殖和存活
Cell Stem Cell, doi:10.1016/j.stem.2012.05.024
白血病干细胞(LSCs)代表骨髓性白血病细胞中独特的一部分肿瘤细胞。它们细胞周期活性低,针对治疗的抵抗性强。为了更好地探究LSCs的主要特性,本研究基于不同癌基因之间的协同效应对白血病干细胞进行了综合分析。
研究者推测,被称为"协同响应基因(CRGs)"的一群基因可能调节LSCs的增长和存活。应用原代小鼠模型和人类白血病标本为研究对象,研究者发现,CRGs包括以往研究所没有发现的若干重要基因。这些基因在白血病发病过程的多种信号途径中调节LSCs的生物活性。
此外,研究结果还表明,CRG表达谱可用于作为药物开发的工具,研发选择性地针对LSCs亚群白血病细胞的化合物。
总之,以CRG为基础的分析,为阐明LSCs的生物学行为以及促进靶向治疗研发提供了强有力的手段。
7. Blood:植物衍生物攻击白血病根源
Blood, doi:10.1182/blood-2004-10-4135
在一项新的研究中,Rochester大学医学中心James P. Wilmot癌症中心的研究人员发现一种在北美广泛栽种的菊科植物是一种能够杀死人类白血病干细胞药剂的天然来源。他们的这些发现公布在《血液》杂志的网络版上。
Parthenolide是菊科植物的重要成分,而要想由它制造出可用的药物还需要花费数月的时间。UR的干细胞专家Craig T. Jordan和Monica L. Guzman博士领导的研究组正在与Kentucky大学的化学专家合作进行研究。这些化学家确定出了一种与parthenolide具有相同特性的水溶性分子。
Parthenolide是第一个已知能够在干细胞水平上作用于骨髓性白血病的物质。而且,由于目前的癌症治疗不能深层次地攻击突变的细胞(即使最新的药物Gleevec也无法到达干细胞),因此parthenolide的这个特征就显得弥足珍贵。
在实验中,他们还比较了人类白血病干细胞对parthenolide和一种叫做cytarabine的普通化疗药物的反应差异。结果表明,parthenolide能够有选择地杀死白血病细胞而不伤害正常的细胞,其对正常细胞的毒性要不cytarabine小。
研究人员相信parthenolide还可能使癌肿瘤对其他抗肿瘤药物更加敏感。这个研究组还确定了使parthenolide引发癌细胞死亡的分子途径,并因此可能增加发展出一种新疗法的机会。
8. Leukemia:Cd123是急粒白血病干细胞的特异标志
Leukemia, October 2000, 14(10):1777-1784
美国Jordan等对急性粒细胞性白血病(AML)干细胞的研究表明,CD123是该种细胞特异性抗原,这一发现为彻底治疗AML提供了新的思路。
干细胞具有两个特性:①可以自我复制或自我更新;②可以向某一系进行分化。近年的研究提示,AML的恶性细胞群体起源于白血病干细胞(LSC)的一个罕见种群。几乎所有的AML亚型均有LSC,其表型为CD34+/CD38-或CD34+/HLA-DR-。LSC概念的提出对于认识AML病因学具有极重要的意义。显然,为获得AML长期缓解,必须清除LSC群。然而,以往的研究提示,LSC在细胞生物学方面不同于较成熟的白血病幼稚细胞,它对常规的化疗无反应。这一现象与AML的临床特点相符,例如多数AML患者表面上可以获得完全缓解,但多数患者将复发。如果LSC对化疗的敏感性低于白血病幼稚细胞,可以认为,残留的干细胞是白血病复发的主要因素。因此,特异的针对LSC的治疗策略,将为AML患者提供更有效的治疗。
鉴于LSC在白血病发病中的关键作用,美国Jordan等对LSC的分子和细胞特性做了进一步研究。用流式细胞仪对原代AML细胞的研究显示,在18份标本中,16份标本的CD34+/CD38-细胞(阳性率为98%±2%)高度表达白介素-3受体α链(IL-3Rα或CD123)。与此相反,正常骨髓来源的CD34+/CD38-细胞几乎不表达CD123抗原。为了确定IL-3Rα阳性细胞的功能,研究者将纯化的CD34+/CD123+白血病细胞移植给有免疫缺陷的NOD/SCID小鼠。
结果表明,CD123+细胞可在小鼠体内建立和保持白血病细胞群。为揭示CD123在白血病中的生物学作用,他们对原代AML细胞的MAPK、Akt和Stat5途径的信号传导活动进行了分析。IL-3的刺激不能引起信号传导蛋白的磷酸化,这一结果提示,CD123在正常的IL-3介导的信号传导中不起作用。
综上所述,CD123是未分化白血病干细胞的特异标志。鉴于该受体在LSC高度表达,Jordan等提出,以CD123为靶点,有可能成为选择性清除AML细胞的有前途的治疗策略。
9. Cancer Cell:科学家发现与白血病有关的肿瘤干细胞
Cancer Cell, doi:10.1016/j.ccr.2014.03.036
在一项新的研究中,英国研究人员及其国际同行2014年5月15日报道,他们发现了与一种白血病有关的肿瘤干细胞。这类细胞是支撑肿瘤细胞生存和扩散的“罪魁祸首”,识别出它们有助于开发出有针对性的治疗药物。
肿瘤干细胞理论认为,在肿瘤及癌症中,总有一小部分细胞像干细胞那样在促使肿瘤细胞增殖、转移。近年来,研究人员曾先后发现了与前列腺癌等癌症有关的肿瘤干细胞。
英国牛津大学的研究人员和瑞典等国同行在美国新一期《癌细胞》杂志上报告说,他们对一批骨髓增生异常综合征患者进行了长期跟踪研究,这类恶性血液疾病经常会发展成急性髓系白血病。
研究人员持续观察了这些患者骨髓中的恶性细胞,并通过基因手段识别出最先出现致癌突变并将其传播的一组细胞。这些细胞具有使肿瘤扩散的能力,其特性与肿瘤干细胞吻合。
研究人员指出,与此前研究相比,新研究着眼于肿瘤干细胞的起源和发展,并通过基因追踪来识别这些细胞,应该具有相当的可靠性。
10. Nature:加拿大科学家找到急性髓系白血病复发根源
Nature, doi:10.1038/nature13038
由加拿大干细胞科学家John Dick博士领导的癌症研究小组发现,前白血病干细胞既是引起白血病的根源,又是逃避治疗的罪魁祸首,其能触发急性髓系白血病(AML)的复发。此项研究成果发表在2014年02月12日的《自然》网站上。
现为多伦多大学分子遗传学教授、玛嘉烈公主癌症中心及大学健康网络(UHN)资深科学家的Dick是癌症干细胞研究领域的先锋人物,其分别于2004年和2007年首次鉴别出白血病干细胞和结肠癌干细胞。他表示,新成果对于理解一个普通细胞经过怎样的步骤发展成AML是一个明显的飞跃,同时可鉴别从前白血病干细胞标靶获益的个体,也为促进个性化癌症医疗做好了准备。AML是一种入侵性血癌,新的研究表明,其初发于骨髓中的干细胞。
研究结果显示,在约四分之一的AML患者中,DNMT3a基因的突变导致前白血病干细胞可形成正常血液干细胞的功能,但其生长过程则会出现异常。这些细胞可在化疗后存活下来,并在病情缓解期的骨髓中被发现,它们形成了一个细胞储存器,最终获得额外的突变,从而导致病情复发。
通过窥视癌症在首次诊断前几个月和几年的发展过程,研究人员最终有了独特的发现。Dick说,人们倾向于认为,癌症病情缓解后的复发意味着化疗没有杀死所有的癌细胞。研究表明,化疗在某些情况下确实并未根除AML,但人们并不清楚是前白血病干细胞引发了新一轮AML的发展,最终导致疾病复发。此项研究结果将加速专门针对DNMT3a基因的药物开发。同时,该发现也为研究人员寻找带有其他基因突变的AML患者乃至非血癌患者的前癌细胞提供了动力。
11. Cancer Cell:白血病干细胞为何难以清除
Cancer Cell, doi:10.1016/j.ccr.2014.04.015
上海交通大学医学院细胞分化和凋亡教育部重点实验室医学干细胞课题组科研人员新近研究发现,急性淋巴细胞白血病干细胞通过建造新的骨髓微环境(niche),搭建“临时庇护所”以逃避化疗。最新一期《癌细胞》杂志发表了相关研究论文。
化疗难以清除骨髓中的白血病干细胞,因此导致白血病容易复发。因此,回答“化疗开始后骨髓中到底发生了什么”等问题,对发展白血病治疗新策略非常重要。
研究人员发现,化疗实施后,白血病干细胞会分泌一些细胞因子,“招募”和改造骨髓间充质干细胞,建立一个“临时庇护所”,逃避化疗杀伤。科研人员发现,这个“临时庇护所”初期为Nestin阳性间充质干细胞组成,之后转为α-SMA阳性,因此这个新建的“庇护所”被称为NSM 微环境(NSM niche)。干扰NSM niche的形成或保护功能,可以明显提高化疗效果,清除骨髓中残留的白血病干细胞。
在此基础上,科研人员在通过化疗不能缓解或部分缓解的白血病病人样本中,高频率地检测到NSM niche存在;在完全缓解的白血病人样本中却检测不到,因此判断NSM niche的形成是白血病不能达到完全缓解的重要原因,从而印证了前述在疾病模型中的研究发现。
研究人员表示,临床上可以通过检测NSM niche的存在与否,判断病人预后;可以将NSM niche作为药物靶标,干扰其形成及功能,从而提高化疗效果。
12. Cell:揭开白血病细胞生存秘密
Cell, doi:10.1016/j.cell.2013.05.041
来自纽约大学的科学家们发现了一个白血病细胞生存的秘密:一个遗传突变推动了白血病细胞。这项研究不仅解答了一个进化谜题,并为开发出高度靶向的白血病治疗铺平了道路。
在发表于2013年6月20日《细胞》(Cell)杂志上的这篇新研究论文中,纽约大学Langone医学中心的研究人员描述了,突变蛋白Fbxw7在癌细胞和健康细胞中表达时的行为差异。
Fbxw7蛋白调控了造血干细胞的生成,后者是可以分化为所有类型血细胞的前体细胞。没有Fbxw7,机体会丧失造血能力,最终患上贫血。科学家们还只是刚开始了解突变Fbxw7出现在相当一部分人类肿瘤,包括胃癌、前列腺癌和一些乳腺癌中的原因。这一突变尤其普遍存在于T细胞急性淋巴母细胞白血病(T-ALL)中。T-ALL是一种少见的致命性小儿白血病,其特征为未成熟白细胞大量表达。
当研究人员随后将突变Fbxw7导入到小鼠的白血病血液干细胞(那些生成过量白细胞引起白血病的细胞)中时,癌症速度加快。这种突变使得白血病干细胞变得更具侵袭性。
在接下来的实验中,研究人员证实Fbxw7结合并降解了推动白血病干细胞的Myc蛋白。他们发现,当Fbxw7突变时,Myc不再受到抑制,癌症干细胞群增长。这一认识还有助于解释健康血液干细胞似乎“忽视”突变Fbxw7的原因。不同于白血病干细胞,健康血液干细胞通常处于静止状态,直至机体需要紧急供血时才会被激活,且它们很少表达Myc。
随后研究人员提出,消除Myc是否有可能阻止白血病。事实上,在白血病小鼠中敲除Myc基因可以耗尽白血病干细胞,终止肿瘤生长。他们利用阻断Myc的一类新癌症药物——BET抑制剂,处理小鼠和人类细胞以及T-ALL的骨髓样本时获得了相同的结果。
研究人员认为,他们可以利用BET抑制剂来靶向治疗小儿和成人T-ALL白血病。
13. Cancer Res:白血病干细胞的致命弱点
Cancer Research, doi:10.1158/0008-5472.CAN-13-3012
尽管疗法已经得到了极大改善,但是两个成年急性髓性白血病(AML)患者中也仅有一人会生存下去,对于65岁以上的老年人而言,急性髓性白血病平均存活期不到一年;而研究者推测发病原因可能是白血病干细胞,在患者机体中白血病干细胞并不能完全被清除,这些白血病干细胞就是引发患者病情复发最终致死的原因。
近日,刊登在国际杂志Cancer Research上的一篇研究论文中,来自歌德大学(Goethe-Universitat Frankfurt am Main)的研究人员通过研究发现了急性髓性白血病干细胞的弱点,他们发现了一种名为5-脂氧合酶(5-LO)的酶类在急性髓性白血病干细胞的生存过程中扮演着重要角色。
此前研究人员已经发现了5-LO在炎性疾病比如哮喘症发病中的角色,研究者Jessica Roos教授表示,这项研究中我们发现,急性髓性白血病亚群中的白血病干细胞或许可以被5-LO抑制剂有效地选择性攻击,而且这种现象均可以在细胞培养基模型和白血病小鼠模型中观察到。
14. Nature子刊:白血病干细胞导致疾病复发
Nature Biotechnology, doi:10.1038/nbt1350
急性骨髓性白血病治疗后容易复发,日本研究人员发表最新研究报告说,其原因是白血病干细胞分裂缓慢,躲过了抗癌药物的攻击。
日本理化研究所石川文彦等人在10月22日的美国《自然—生物技术》杂志网络版上发表研究报告指出,他们向失去免疫能力的实验鼠注射采自人类白血病患者骨髓的白血病细胞,结果发现其中部分细胞虽然原本数量极少,却能大量增殖,引发白血病。
研究人员给上述发病的实验鼠注射抗癌药物,后来增殖产生的白血病细胞多数死亡,而最早注射入实验鼠体内的细胞却有70%到80%存活了下来。研究人员重新提取这些生存下来的细胞,注射入其他实验鼠体内,实验鼠随后也出现了白血病症状。
进一步研究显示,白血病干细胞的分裂速度较普通癌细胞缓慢,而抗癌药物一般针对增殖速度快的细胞,于是白血病干细胞恰好能躲过抗癌药物的攻击。另外,白血病干细胞集中存在于骨髓中抗癌药物难以达到的区域,这使得它们更难被消灭。
15. Nature:白血病治疗新方法
Nature, doi:10.1038/nature14888
近日,发表在国际杂志Nature上的一项研究报告中,来自澳大利亚彼得-麦卡伦癌症中心(Peter MacCallum Cancer Centre)的研究人员通过研究揭示了急性髓性白血病抵御突破性疗法的分子机制,或为开发新型疗法来治疗急性髓性白血病提供一定希望。
研究者首次在实验室培养皿中培养生长出了白血病干细胞,从而就可以更加容易快速地进行新型疗法来帮助治疗AML。
研究者指出,文章中我们揭示了白血病干细胞对BET抑制剂的反应机制,BET抑制剂是当前国际疗法中推荐的一种新型活性疗法抑制剂;靶向作用白血病表观遗传机制的潜在疗法或许可以有效关闭AML中的致癌基因;研究者发现,当细胞通过一种未知机制,适应并且增加WNT/β-连环蛋白通路中特殊蛋白的表达来绕过药物并且重新激活癌症驱动基因时就会引发癌症耐药性的发生。
研究者Dawson教授表示,利用BET抑制剂进行的临床试验或可帮助我们有效选择患恶性AML的病人,然而耐药性的风险却在任何癌症疗法中非常常见;因此精确理解其中所涉及的机制对于有效抵御疾病恶化或将带来巨大帮助。早在2011年研究者就开发出了名为BET-布罗莫结构域抑制剂的表观遗传药物,这些药物可以改变DNA的包装模式,并且最终导致致癌基因的关闭。
16. Cell Stem Cell:慢性髓样白血病治疗的新途径
Cell Stem Cell, doi:10.1016/j.stem.2012.02.017
近日,研究者在2012年4月出版的杂志Cell Stem Cell上发布了他们的最新研究成果,文章中,研究者通过在小鼠体内进行实验,发现了一种可以有效阻止白血病干细胞的方法,研究者建议联合的治疗方法可以有效的捣毁慢性髓样白血病(chronic myeloid leukemia,CML)。很多慢性髓样白血病人总是在重复经历着癌症的再次光顾,因为病人机体内部残存着逗留不去的白血病干细胞,白血病干细胞可以顽固地存在于病人体内,使得病人机体的癌症反复光顾。
格列卫公司生产的伊马替尼可以抑制CML病人的癌基因蛋白质的产生,但是其对于解除病人的痛苦效应往往不稳定,越来越多的研究证据显示,这种药物并不能完全清除病人体内的大部分不成熟的癌细胞,目前的问题是,我们到底如何来清除这些癌症细胞呢?研究者的这项研究焦点集中在了血液干细胞在其发育阶段的一种已知途径上,研究者通过小鼠实验发现,白血病干细胞可以不断恢复依赖于其早期的发育阶段。
白血病干细胞容易受到一种所谓的β-环连素途径的影响,而正常的血液干细胞并不会受其影响,研究证据显示,伊马替尼加上β-环连素途径的缺失治疗方法可以帮助患者阻止疾病的复发,β-环连素抑制子可以帮助小鼠消除体内的白血病干细胞。研究者表示,目前他们的研究工作是确定β-环连素的阻滞剂是否也在人类体内同样起作用,如果和小鼠机体的研究结果一样的话,CML病人将会用这种新型的治疗方法来进行治疗,减轻痛苦。
17. Cancer Cell:日本成功消灭慢性髓系白血病干细胞
Cancer Cell, doi:10.1016/j.ccr.2013.01.026
近日来自日本九州大学的一项研究发现,对慢性髓性白血病进行基因操作可以协助化疗药物更易发挥作用,从而杀死癌细胞。这一发现或可促进开发出根治白血病的治疗方法。
肿瘤干细胞被认为在体内处于几乎不增殖的“休眠状态”。化疗药物虽能遏制肿瘤细胞增殖,但对干细胞却难以发挥作用。即使化疗后肿瘤看起来已经消失,但只要残留少量干细胞,就会导致癌症复发和转移。
日本九州大学教授中山敬一率领的研究小组发现,肿瘤干细胞中一种名为“Fbxw7”蛋白质能够遏制细胞分裂。他们对患有慢性髓性白血病的实验鼠进行基因操作,使肿瘤干细胞无法再制造这种蛋白质。此后,研究人员让实验鼠服用化疗药物“格列卫”,35天后不再给药。
研究发现,一般情况下,患白血病的实验鼠60天后会有90%的复发率,而不能制造“Fbxw7”蛋白质的实验鼠复发率只有20%左右。研究小组判断肿瘤干细胞已经死亡。
中山敬一说:“如果开发出阻碍这种蛋白质发生作用的药物,同时与化疗药物并用,就有望根治癌症。”相关研究成果刊登在美国《癌细胞》杂志网络版上。
18. Nat Methods:白血病干细胞体外培养获得重大突破
Nature Methods, doi:10.1038/nmeth.2847
最近,加拿大蒙特利尔大学免疫学研究和癌症研究所(Institute for Research in Immunology and Cancer,IRIC)和魁北克Maisonneuve-Rosemont医院的白血病细胞银行(Quebec Leukemia Cell Bank)进行合作,发现了白血病干细胞在体外成活的两种因子,这为开发抗癌药物提供重大突破。
日前,这项研究发表在《自然•方法》杂志上,该研究为今后治疗白血病做好铺垫,对治疗抗急性髓系白血病的药物筛选有很大帮助。
在这项研究之前,当白血病干细胞在体外进行培养时,会很快地失去干细胞特性,从而对研究这种癌细胞的增殖很难进行。
加拿大的这组人员为解决这个问题,从患急性髓系白血病患者身上提取白血病干细胞,通过对上千个化学物质进行检测后,研究人员最后发现有两种物质能够决定白血病干细胞在体外成活。它们能让白血病干细胞在体外至少存活7天。从而使得研究者在后期对白血病干细胞在体外研究能够顺利进行。
白血病干细胞在体外培养是白血病研究领域的一个重大突破,下一步研究者的重点方向是研究调控白血病癌细胞生存和增殖的抗癌症药物的分子机制。
19. PNAS:选择性清除急性骨髓性白血病干细胞的潜在新药
PNAS, doi:10.1073/pnas.1302352110
来自上海交通大学、中科院等处的研究人员在新研究中发现了一种可选择性清除急性骨髓性白血病干细胞的潜在药物,从而为改善急性髓细胞白血病患者的治疗预后指出了一条有前景的治疗途径。相关论文发表在2013年3月19日的《美国科学院》(PNAS)上。
近年来大量的研究表明,白血病患者体内存在一群极微量的细胞群,约占所有白血病细胞的0.1%-1%,这些细胞在白血病的发病及进展中扮演着重要的角色,且由于这些细胞通常对化疗药物不敏感,也是导致白血病复发的罪魁祸首。科学家们将这群白血病细胞称之为白血病干细胞(Leukemia stem cells ,LSCs),认为其可能是治疗干预的一个重要的靶点。然而目前能够靶向LSCs,减慢急性髓细胞性白血病(AML)进程的药物相对较少。
基于体内外研究数据,研究人员在这篇新文章中报告称,一种耐受良好的维生素A衍生物:芬维A铵能够以生理上可实现的浓度清除LSCs,而不影响造血祖/干细胞。芬维A铵能够对于原发AML CD34+细胞,尤其是富含LSC的CD34+CD38-细胞亚群产生一种选择性毒性效应,而对于正常的细胞则没有明显的影响。
通过甲基纤维素克隆形成分析,研究人员进一步证明芬维A铵显着抑制了AML CD34+细胞源性的克隆形成,而不影响正常CD34+细胞。此外,在一个非肥胖性糖尿病/严重联合性免疫缺陷病(SCID)小鼠异种移植模型中,研究人员证实芬维A铵能够显着减少AML干细胞的移植而不影响正常造血干细胞。在进一步的机制研究中,研究人员揭示芬维A铵诱导的细胞死亡与一系列特征性的事件相关,包括活性氧簇快速形成,诱导与应激反应和凋亡相关的基因,以及抑制与NF-κB和Wnt信号相关的基因。进一步的生物信息学分析表明,芬维A胺下调基因与AML患者不良预后显着相关。
基于这些研究结果,研究人员提出芬维A胺是一种选择性靶向LSCs的有效药物,由此为AML治疗提供了一种有潜力的治疗策略。
20. 关闭CML干细胞活性有望攻克白血病干细胞
美国亚特兰大2012年12月9日召开的第54届美国血液协会年会暨博览会上,天普大学医学院报告了他们在研究慢性骨髓性白血病(CML)治疗方面的进展。他们设计出一种关闭CML干细胞活性的方法,以此遏制病情的进一步发展。研究人员指出,该发现有望带来攻克癌症干细胞耐药性的个体化新疗法。
在CML中,骨髓干细胞中的基因ABL1和BCR融合在一起产生了一种叫做BCR-ABL1的酶,在其驱动下产生了过多白细胞。尽管在治疗上,伊马替尼(imatinib)是一种比较成功的药物,但患者始终处在病情复发的风险中。论文高级作者、天普大学医学院微生物学与免疫学教授托马斯·斯科斯基解释说,白血病有一个小型干细胞库来对抗治疗,残余的白血病干细胞会积累大量致命的DNA变异,并能够有效地自我修复,从而在DNA中埋下致命隐患,最终导致病情恶化。
为此,研究小组用了一种不会伤害正常细胞的方法攻击了白血病干细胞修复DNA的路径,而正常细胞的修复机制与白血病细胞不同。他们用小鼠做了一系列实验,显示出瞄准一种特殊的蛋白质RAD52,能遏制白血病干细胞的自我修复过程。“我们希望这种方法能根除白血病干细胞,治愈慢性骨髓性白血病患者。”斯科斯基说。
“我们早期的研究也发现,RAD52基因是白血病发展的关键因素。”论文第一作者、该校微生物学与免疫学博士后金伯利·克莱姆说,小鼠骨髓细胞在缺乏RAD52时,CML会停止发展,这表明CML要依靠RAD52来实现自身DNA修复。
一种最普遍的DNA损伤是“双链断裂”,当RAD52蛋白发生变异时,就不能再与DNA结合修复断裂。研究人员用一种“适配子”加入到BCR-ABL1阳性骨髓细胞中,发现RAD52被阻止与DNA结合,白血病骨髓细胞会累积过多的双链断裂,最终死亡,而适配子对正常细胞则没有影响。
21. Blood:白血病干细胞最新研究成果
Blood, doi:10.1182/blood-2009-11-255778
2010年4月6日,国际著名学术期刊《血液》在线发表了中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所发育与疾病实验室及瑞金医院医学基因组学国家重点实验室的最新研究发现:进化上高度保守的PTEN-C/EBPa-CTNNA1信号轴控制造血干细胞发育与白血病干细胞恶性转化。
该实验室前期研究表明CTNNA1基因(编码alpha-catenin蛋白)在正常造血干细胞表达,但在伴有5号染色体长臂缺失的骨髓增生异常综合症和急性髓系白血病患者的白血病干细胞(或白血病起始细胞)中表达水平显著降低。初步证据表明CTNNA1基因是一个潜在的白血病干细胞肿瘤抑制基因,其一个等位基因通过基因组片段缺失而失活,另外一个等位基因被表观遗传学机制(DNA甲基化和组蛋白去乙酰化)抑制。因为DNA甲基化酶抑制剂和组蛋白去乙酰化酶抑制剂在临床上治疗效果有限,因而进一步寻找CTNNA1失活的表观遗传学机制和上游信号调节路径对于在白血病干细胞中重新开启此基因,因而特异性靶向治疗白血病肿瘤干细胞而不影响正常造血干细胞,具有重要的基础和临床意义。
在健康所刘廷析研究员指导下,通过和美国Loyola大学张吉旺教授及瑞金医院诸江教授合作,傅春堂和朱康勇等研究人员发现PTEN-mTOR信号通路作用在PTEN-C/EBPa-CTNNA1轴的上游,在翻译水平决定野生型p42C/EBPa与其显性负p30C/EBPa的比例:mTOR活性增加导致p42C/EBPa/p30C/EBPa比例下降;mTOR活性减低导致p42C/EBPa/p30C/EBPa比例上升。低的p42/p30比例导致p30C/EBPa优先结合到CTNNA1基因的近端启动子元件,并进而招募含EZH2,EED和SUZ12的PRC2蛋白复合体,介导组蛋白H3在第27位赖氨酸残基的三甲基化修饰(H3K27me3)和转录抑制。与此相反,高的p42/p30比例则导致p42C/EBPa结合到CTNNA1基因的近端启动子元件,通过促进H3K4三甲基化(H3K4me3)修饰激活CTNNA1转录。进一步研究发现,在PTEN敲除的小鼠骨髓和Pten敲低的斑马鱼胚胎中,野生型C/EBPa和alpha-catenin蛋白水平均显著下调,同时伴有造血干祖细胞的白血病样增生和异常浸润。更重要的是,该研究发现临床上约20%的髓系白血病患者的白血病干细胞存在CTNNA1低水平表达,而PTEN或CEBPA的移码突变只在这些CTNNA1表达低的白血病干细胞中被检测。
这项研究揭示三个重要的白血病肿瘤抑制基因共同作用在一个进化上高度保守的信号转导轴中,通过调节表观遗传学机制“三把锁”(组蛋白H3K27甲基化,组蛋白去乙酰化和DNA甲基化)而控制造血干细胞发育与白血病干细胞恶性转化。该白血病干细胞肿瘤抑制轴的发现也为白血病干细胞的靶向治疗(特别是CTNNA1表达低的患者)提供了重要线索。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#白血病干细胞#
0
#重大进展#
55