CRISPR-HOT:新型基因编辑工具,实现人源类器官的荧光标记和可视化
2020-03-10 BioWorld BioWorld
2009年,荷兰的Hans Clevers团队在体外三维(3D)器官培养领域取得重大突破,成功地在体外培养出有自我更新能力、保持肠道腺窝绒毛状结构的小鼠肠道类器官。自此,类器官技术在人类科学研究发展史
2009年,荷兰的Hans Clevers团队在体外三维(3D)器官培养领域取得重大突破,成功地在体外培养出有自我更新能力、保持肠道腺窝绒毛状结构的小鼠肠道类器官。自此,类器官技术在人类科学研究发展史中拉开了帷幕。
在过去的十年中,类器官体系的发展是干细胞研究领域取得的最令人兴奋的进展之一, 曾被Nature Methods评为2017年生命科学领域年度技术。与传统的研究模型相比,类器官模型因与对应的器官拥有类似的空间组织、保持一些关键特性并能够重现部分生理功能,而被认为是检测人类生物学和疾病方面的新模型。

CRISPR-Cas9技术已经使基因组编辑发生了革命性的变化,并可应用于类器官领域。对类器官的基因进行编辑将对研究生物过程和疾病建模有很大帮助。然而到目前为止,由于缺乏简单的基因工程方法,无法将外源性DNA序列精确整合到人源类器官中,因此,产生遗传改变的人源类器官是非常困难的。
缺乏内源性报告基因系也是研究人类成体干细胞衍生的类器官的亚细胞动力学的瓶颈。
2020年3月2日,荷兰Hubrecht研究所Hans Clevers团队在Nature Cell Biology杂志发表了题为:Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing的研究论文。
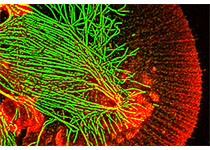
该研究开发了一种名为“CRISPR-HOT”的新型基因工具,可对人源类器官中的特定基因进行荧光标记和可视化。这一新的技术打破了荧光敲入类器官的瓶颈,为研究组织器官中实时动态的细胞过程打开了广阔的前景。
CRISPR/Cas9就像微型分子剪刀,可以精确地切割DNA中的特定位置,这项新技术极大地帮助和简化了基因工程。DNA中的小伤口可以激活细胞中两种不同的修复机制(同源末端连接和非同源末端连接),这两种机制都可以被用来迫使细胞在DNA切口处添加新的DNA。其中非同源末端连接
的方式容易出错,因此,一般不用来插入新的DNA片段。
由于一些早期的小鼠实验表明,新的DNA片段可以通过非同源末端连接的方式插入,因此研究人员着手在人源类器官上进行测试。研究发现,通过非同源末端连接的方法将DNA片段插入到人源类器官中,实际上比迄今为止使用的其他方法更有效、更稳健。他们将这一新方法命名为“
CRISPR-HOT”。
然后,研究人员利用CRISPR-HOT技术将荧光标签插入到人源类器官的DNA中,从而使这些荧光标签附着在他们想要研究的特定基因上。
首先,研究人员标记了肠道中非常罕见的特定类型的细胞:肠内分泌细胞。这些细胞通过产生激素来调节血糖水平、食物摄入量和胃排空。因为这些细胞非常罕见,所以很难研究。然而,
使用CRISPR-HOT,研究人员可以轻松地将这些细胞“涂成”不同的颜色,然后对其进行识别和分析。
其次,研究人员绘制了来自肝脏中特定细胞类型的器官,即胆管细胞。利用CRISPR-HOT,他们观察了角蛋白(细胞骨架中的蛋白质)。现在他们可以在高分辨率下详细观察这些角蛋白,研究人员以一种超结构的方式揭示了它们的组织结构。当细胞特化或分化时,这些角蛋白也会改变表达。因此,研究人员预期CRISPR-HOT可能对研究细胞命运和分化有帮助。
在肝脏内,有许多肝细胞含有比正常细胞多两倍(甚至更多)的DNA。目前还不清楚这些含有异常数量DNA的细胞是如何形成的,以及它们是否能够分裂。老年人含有更多的这种异常肝细胞,但尚不清楚它们是否与癌症等疾病有关。
Artegiani和Hendriks使用CRISPR-HOT标记了肝细胞类器官中细胞分裂机制的特定成分,并研究了细胞分裂的过程。Artegiani表示:“我们看到‘正常的’肝细胞分裂非常有序,总是按照一定的方向分裂成两个子细胞。”Hendriks说:“我们还发现了几个分裂的异常肝细胞。我们第一次看到一个“正常”的肝细胞如何变成一个异常的肝细胞。”除此之外,研究人员还研究了肝癌中常见的TP53基因突变对肝细胞异常分裂的影响。如果没有TP53,这些异常的肝细胞会分裂得更频繁。这可能是TP53影响癌症发展的方式之一。
研究人员认为,CRISPR-HOT可以应用于许多类型的人体器官,以可视化任何基因或细胞类型,并研究许多与发育和疾病相关的问题。
综上所述:研究中报道的荧光CRISPR-HOT敲入细胞系跨越了不同的生物学尺度,拓宽了3D培养中可及的细胞生物学领域。它们有助于监视和修改细胞活动,这些活动依赖于多细胞组织环境中的动态过程,如细胞膜力学、细胞迁移、囊泡运输、细胞代谢和干细胞生态位维护。鉴于在基因组编辑和类器官培养方面的巨大创新和更高的精确度,研究人员预期CRISPR-HOT可以帮助快速提高人类细胞来源的荧光类器官的使用频率。
参考内容:https://www.nature.com/articles/s41556-020-0478-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#可视化#
97
#荧光#
78
#基因编辑工具#
77
#CRISPR#
66