2016十大科技新闻评选:人类基因组编写计划:“完美”人类会诞生吗?
2016-12-18 马嘉悦 中国科技网
时光飞逝,2016年进入了倒计时。今年,国内外科技圈我们一起见证过的大新闻,你都还记得吗? 从11月底开始,我们将会带你依次回顾这一年中的重大科技新闻,并在年底进行投票,由你来选出2016年十大科技新闻~据《纽约时报》报道,今年5月10日,大约150名科学家、律师和企业家参与了一场秘密会议,探讨人工合成人类基因组的可能性——用化学手段重新创造生物代代相传的基因原料。人类基因组编写计划在争
时光飞逝,2016年进入了倒计时。今年,国内外科技圈我们一起见证过的大新闻,你都还记得吗?
据《纽约时报》报道,今年5月10日,大约150名科学家、律师和企业家参与了一场秘密会议,探讨人工合成人类基因组的可能性——用化学手段重新创造生物代代相传的基因原料。

人类基因组编写计划在争议声中“呱呱坠地”
一石激起千层浪,消息传出就引发各界广泛争议,很多科学家对该做法可能会引发的伦理问题表示了担忧。
但这些争论和担忧并没有阻挡科学家的决心,他们在2日出版的美国《科学》杂志上正式公布了“人类基因组编写计划(HGP-write)”:十年之内耗资数十亿美元从头开始合成出人类基因组。
英国《自然》杂志官网在6月3日的报道中表示,尽管这一项目的初衷是降低合成DNA成本,但科学界支持与反对者仍各执一端。
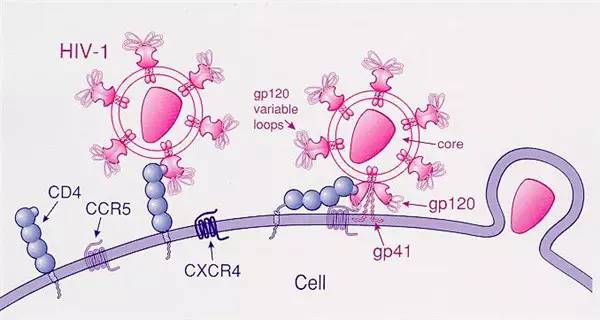
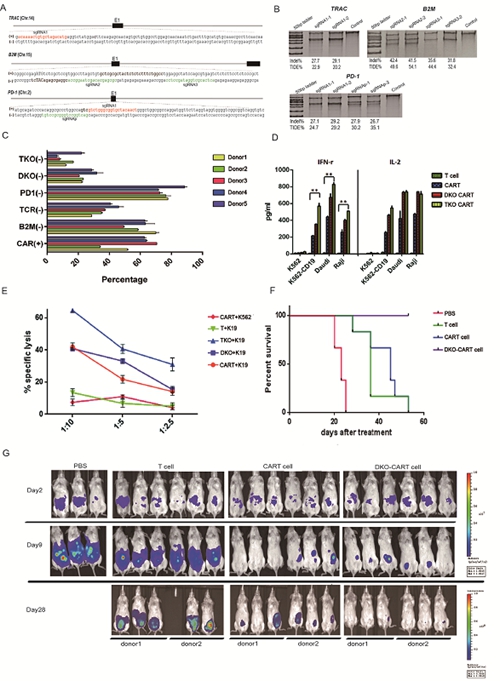
科学家利用CRISPR-Cas9技术在CART细胞中实现多基因编辑

人类基因组编写
CART(Chimeric Antigen Receptor T cell)细胞治疗是非常有前景的肿瘤治疗方法,中文翻译为“嵌合抗原受体T细胞”。嵌合抗原受体(Chimeric Antigen Receptor,CAR)是由人工设计合成的跨膜蛋白,包括细胞外、跨细胞膜以及细胞内三个部分。CAR的细胞外部分主要是识别特定抗原的单克隆抗体可变区(scFV),负责识别特异性抗原。跨膜区确保CAR可以在细胞膜上定位,而细胞内区域则负责激活T细胞,产生T细胞介导的免疫反应。临床数据表明,CART在B细胞恶性肿瘤治疗中取得了很好的疗效。
但是,目前采用的方法都是自体过继细胞治疗(autologous adoptive cell transfer,ACT),这种方法昂贵并且耗时。对于新生儿及老年患者,很难获得足量且状态良好的淋巴细胞用于CART细胞治疗。因此目前CART细胞治疗的一个重要研究方向是怎样使用一个健康献血者的T细胞制备大量的CART细胞,满足数百名患者的临床使用。这一技术的建立将极大降低CART疗法的成本,可以更好地保证统一制备的细胞质量,而且患者在需要时可以马上得到CART细胞进行治疗。
该研究得到了干细胞与生殖生物学国家重点实验室研究员、中科院院士周琪以及各位同事的大力帮助和支持,同时得到了科技部“863”课题、国家自然科学基金和中科院干细胞先导专项的资助。
基因编辑新工具“出炉” 可有效操控分子
美国科学家日前发现一种新的基于CRISPR系统的基因编辑工具,它以RNA为目标而不是DNA。新工具可作为小干扰RNA的替代方法,提供新的、可调节的基因“敲除”能力。
在6月2日发表于《科学》杂志的研究报告中,哈佛—麻省理工博德研究所核心成员张锋和其他研究人员描述了这种以RNA为导向的酶——C2c2,它是首个以RNA为目标的天然CRISPR系统。
据麻省理工学院官网介绍,新方法或将为强有力地进行分子操控打开大门。以DNA为目标的基因编辑可以永久改变分子的基因组,而以RNA为目标的基因编辑方法允许研究人员对分子基因组进行临时改变,并在以后对其进行调整。此外,与现有的RNA干预技术相比,新方法更精确、功能更强大。
该团队在去年10月发现C2c2酶,这种酶可以帮助细菌抵御病毒入侵。研究人员展示,这种酶可以用来剪切细菌细胞中特定的RNA序列,它是以DNA为目标的CRISPR-Cas9基因编辑工具的重要补充,只以RNA为目标,这允许其高通量地精确操纵RNA。而且,由于RNA帮助执行遗传指令,因此这种酶具有更广泛的基因操纵功能。
同时,与目前最常见的基因敲除技术——小干扰RNA(siRNA)相比,新的编辑技术更精确,应用范围更广,如它可为特定RNA序列添加模块并改变其功能。
新技术操控CRISPR基因编辑系统
深圳市第二人民医院973项目首席科学家蔡志明与黄卫人、刘宇辰对CRISPR-Cas9基因编辑系统进行改进完善,实现对Cas9的操控,可控制癌细胞胞内信号流动方向,对癌细胞多种“恶性”行为进行有效干预。相关研究成果在线发表于9月5日的英国《自然·方法学》上。
近年迅猛发展的CRISPR-Cas9系统具有很强的基因编辑和调控能力,通过sgRNA的精确“制导”和Cas9核酸酶实施靶向基因功能操作,两者协同实现编辑和调控能力。这一系统已在生命科学和医学等多领域得到广泛应用,然而其在应用过程中仍有许多方面尚待完善,如避免“使用失控”和“过度编辑”等问题。
传统方法主要借助外部“力量”来消灭癌细胞,但往往会损害无辜细胞,引起极大副作用。对于基因突变导致细胞信号转导异常的癌症,研究人员利用新技术能够控制癌细胞内信号流动方向,有效干预癌细胞的多种“恶性”行为,启动这些细胞自身的死亡程序。
研究人员介绍,肿瘤是一种由于基因突变而造成细胞内信号转导网络异常的疾病,传统治疗方法如放化疗等,在杀伤癌细胞的同时,往往伤及正常细胞,引起极大副作用。而这套新工具可感知癌细胞内部上游异常分子或外源信号分子的存在,并同时与下游多个抑癌分子组成一个新的“信号转导网络”,进而启动自身的死亡程序,由于正常细胞不存在癌细胞特有分子,可不受影响,这是过去的传统研究方法所不容易实现的。
四川大学开展世界首例CRISPR疗法人体试验

四川大学华西医院的团队成功将CRISPR-Cas9基因编辑技术修饰的细胞植入了人体
四川大学华西医院肿瘤科主任卢铀带领团队近日开展了世界上首例基于CRISPR-Cas9的基因编辑技术人类临床试验:他们从一位转移性非小细胞肺癌患者血液中提取免疫细胞,对其进行基因修改后再注入患者体内。
用其他基因编辑技术开展的早期临床试验已经表现出很好的疗效,而引入CRISPR技术,会让治疗变得更加简单高效。据《自然》杂志网站16日报道,卢铀这次的试验已经于今年7月获得医院伦理团评审通过。本计划8月就向病人注射经过CRISPR基因编辑的细胞,但因培养和扩增细胞比预期所用时间延长,试验不得不推迟到10月28日。
他们利用CRISPR技术让免疫细胞中负责编码PD-1蛋白的基因失去活性,然后在实验室对编辑过的细胞培养扩增,达到一定数量后再重新注入患者体内。PD-1蛋白能阻止免疫细胞产生应答反应,癌症细胞充分利用了PD-1的这一功能特性,不断在体内繁殖扩散。卢铀希望,经过修改后不再含有PD0-1蛋白的细胞能治好患者的肺癌。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











希望基因疗法能快点用于临床肿瘤的治疗
86
可以可以
64
期待结果!
79