【协和医学杂志】细菌外囊泡在疾病发生发展中的作用机制及应用前景
2023-10-08 协和医学杂志 协和医学杂志 发表于上海
越来越多的研究开始探究其在不同疾病发生发展中的作用机制,并挖掘其在疾病诊治中的巨大潜力。
细菌外囊泡(BEVs)是细菌分泌的一种细胞外囊泡(EVs),为具有脂质双分子层的球体结构,直径一般为20~400 nm[1]。近10年来,人们对BEVs的类别、特征及其生理和病理作用的认识不断深入。BEVs作为细菌衍生的小分子活性物质,具有结构稳定、循环有效时间长等优势,被认为是细菌间或细菌与宿主间相互作用的关键新媒介[2],既参与细菌生理和病理的多种生物过程,包括毒力因子运输、生物膜形成及抗生素抗性等[3];同时,在宿主生理和病理过程中也扮演着重要角色。
已有证据表明,肠道及口腔来源的BEVs可出现在外周血中,并与免疫细胞相互作用,甚至可到达肝、脑等远端组织[4],影响宿主的生理及病理功能。鉴于BEVs不同的细菌类型及功能多样性,其对机体可产生截然相反的效力(“致病”或“治病”作用),因此,越来越多的研究开始探究其在不同疾病发生发展中的作用机制,并挖掘其在疾病诊治中的巨大潜力。
1 BEVs 概述
目前,根据BEVs的组成和结构差异将其分为外膜囊泡(OMVs)、外-内膜囊泡(OIMVs)、细胞质膜囊泡(CMVs)和管状膜状结构(TSMs)[1]。然而,BEVs的形成机制尚不清楚。在革兰阳性菌中,内溶素会引发“泡状细胞死亡”,导致CMVs的产生[5]。
在革兰阴性菌中,至少有两种模型阐述了OMVs的产生:外膜起泡(即革兰阴性菌细胞壁成分生物合成不平衡或疏水分子插入外膜引起的包膜紊乱从而以起泡的方式分泌)和爆炸性细菌裂解(即细菌细胞被裂解后的碎片聚集并融合成囊泡结构)。目前,研究认为外膜起泡可由周质空间的压力改变、脂多糖(LPS)分子之间的阴离子电荷排斥以及肽聚糖(PG)与外膜之间的连接丧失等[6]原因引起。
以上机制形成的OMVs内膜是完整的,细胞质成分不能直接接触到这些OMVs。而爆发性细菌裂解是噬菌体来源的内溶素降解PG后形成的。一旦PG被降解,细胞聚集爆炸后重新聚集并组装成OIMVs[7]和爆炸性外膜囊泡(EOMVs)[8]。与外膜气泡形成的OMVs不同,EOMVs因为形成过程随机,因此一般包含细胞质成分,见图1。
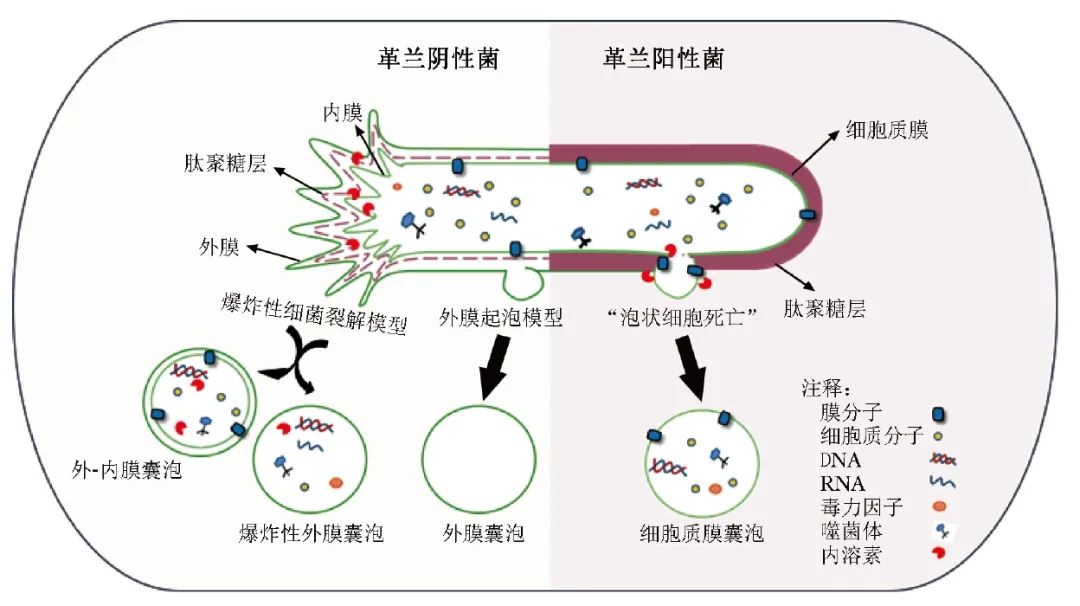
图1 细菌外囊泡形成过程示意图
BEVs的成分和含量因亲代细菌生长阶段及环境的不同而有所差异,但一般均携带蛋白质、脂质、核酸等生物分子。蛋白质组学方法揭示BEVs含有结构蛋白、孔蛋白和转运蛋白等与生物过程相关的蛋白质[9]。而脂质是细菌细胞膜的重要组成部分,目前有关BEVs上的脂质组成仍在探索之中。
已有研究表明,不同细菌来源的EVs所包含的脂质有所不同,可能与细菌适应及生存有关[2]。另外,随着代谢组学技术的发展,也发现BEVs装载着一些调节靶细胞功能的代谢物和效应分子,可能参与细菌间的交流以及生物膜形成等重要过程[10]。
2 BEVs在疾病发生发展中的作用机制
2.1 炎症性肠病
炎症性肠病(IBD)是一种胃肠道慢性炎症性疾病,全球已有350余万人受该疾病的影响,其发病率呈逐年上升趋势[11]。最新研究表明,在肠屏障功能障碍的IBD患者中观察到大量LPS阳性的BEVs[12],且多项研究表明BEVs可能是IBD发病机制中重要的调节因子,并与上皮屏障及免疫调节受损有关。
例如,Liu等[13]发现,具核梭杆菌的EVs促进巨噬细胞分泌肿瘤坏死因子-α(TNF-α),并通过Fas相关死亡域蛋白(FADD)受体相互作用蛋白激酶——半胱天冬氨酸酶3途径诱导肠上皮细胞死亡,破坏肠上皮屏障。
另一项研究发现,具核梭杆菌聚集在人结肠T84细胞附近的黏液层,并通过分泌EVs促进人结直肠腺癌细胞株分泌白细胞介素(IL)-8[14]。
此外,几种肠病原菌的EVs被证明是胞质肽聚糖传感器NOD1强激活因子,可激活核因子κB,参与宿主炎症和病理反应[15]。大肠杆菌的EVs可刺激肠上皮细胞系HT29-19A和Caco-2中Toll样受体的转录上调,导致轻度的促炎反应[16]。虽然越来越多的研究表明BEVs与IBD存在关系,但BEVs在IBD中的病理学调控机制仍需进一步研究加以明确。
2.2 神经相关疾病
近年来,越来越多的研究表明,BEVs作为纳米级颗粒,可干扰甚至穿过血脑屏障(BBB)[17],引发神经性炎症[18-19],可直接影响包括阿尔茨海默病(AD)在内的神经退行性疾病及抑郁等精神疾病的发生发展。目前,较多研究关注BEVs是以何种途径到达脑部并引起相应神经疾病的发生。
来自韩国的研究表明,古人类甲苯菌属的EVs可通过迷走神经途径影响认知障碍的发生[20]。口腔的牙龈卟啉单胞菌EVs(Pg-EVs)可通过牙周血转运至脑内,并增加海马组织中TNF-α的表达,从而导致认知功能障碍[21]。
Park 等[22]发现幽门螺杆菌(Hp)感染小鼠血清的HP-OMVs,可通过血液循环穿透BBB,增强淀粉样β或Tau蛋白引起的神经元损伤,这也为HP感染人群中存在较高的AD患病率提供了证据。
另外,研究发现,给小鼠注射Pg-EVs可激活小胶质细胞,导致神经炎症与认知障碍的加剧[23]。其他研究也发现BEVs可激活星形胶质细胞和小胶质细胞,并提高了IL-1β、Thr231位点上的Tau磷酸化或海马中NLRP3炎症小体相关蛋白的表达[24-25]。因此,BEVs可能是神经相关疾病发病机制中的重要补充途径。
2.3 其他疾病
2.3.1 肝脏性疾病
当前,BEVs与肝脏性疾病直接相关的研究越来越多。小鼠腹腔注射Pg-EVs会导致其在肝脏中积聚[26],BEVs在肠肝轴中对肝病可能发挥一定作用,但仍缺乏BEVs参与肝病的直接证据[27]。
最近,Fizanne等[28]发现非酒精性脂肪性肝炎(NASH)患者粪便来源的EVs(fEVs)可增加肠道通透性,而非酒精性脂肪性肝病(NAFLD)患者的fEVs及NASH-fEVs可激活肝星状细胞的促纤维化蛋白和促炎蛋白,从而导致肝损伤,这意味着fEVs在NAFLD向NASH进展中发挥潜在作用。
Natsui等[29]研究发现,失代偿期肝硬化患者的腹水和血清中存在来自肠道细菌的EVs,并通过体外实验证实此类EVs可能会加剧肝脏炎症、纤维化恶化,减少白蛋白产生,进而促进疾病进展。
2.3.2 代谢性疾病
BEVs与代谢性疾病的研究热度也居高不下。2015年,Choi等[30]即发现从高脂饮食喂养的小鼠粪便中获得的EVs可促进肌管和脂肪细胞的胰岛素抵抗。随后,Chelakkot等[31]报道在高脂肪饮食诱导的糖尿病小鼠中,嗜黏蛋白菌与肠道屏障完整性和代谢谱的改善之间存在直接关系。
最近研究表明,肥胖导致免疫球蛋白超家族的补体受体阳性枯否细胞数量减少,不利于肝脏清除含肠道微生物DNA的EVs,进而加剧了组织炎症和代谢紊乱[32]。可见,BEVs在代谢性疾病中的相应发病机制越来越具体。
2.3.3 自身免疫性疾病
随着肠-骨轴的发现,越来越多的学者关注到BEVs与骨组织相关的自身免疫性疾病的关系。类风湿关节炎(RA)是一种以关节病变为特征的慢性自身免疫性疾病,目前尚无有效治疗方法[33]。
最新研究发现,具核梭杆菌在RA患者肠道菌群中富集,并通过向关节输送含毒力因子FadA的EVs,FadA作用于滑膜巨噬细胞,激活炎症途径Rab5a-YB-1轴从而促进关节炎症[34]。这为RA提供了新的潜在治疗靶点。
另外,来自口腔的Pg分泌的肽酰精氨酸脱亚胺酶(PPAD)可介导宿主蛋白的瓜氨酸化,从而导致自身抗体ACPA产生,是连接牙周炎和RA发病机制的关键因素[35]。此外,PPAD大量存在于Pg-EVs中[36],因此,Pg-EVs在RA中的潜在作用值得继续探究。
2.3.4 恶性肿瘤
几个世纪以来,微生物在恶性肿瘤发生发展及诊治中的作用一直存在争议。研究显示,微生物可能需要介质来局部或远距离调控恶性肿瘤的进展[37],而BEVs作为细菌衍生的活性分子,可能具有影响基因组稳定性、肿瘤微环境及抑制免疫监视等潜在促肿瘤机制,但其在恶性肿瘤中的直接作用证据仍然匮乏[38]。
最新研究表明,具核梭杆菌的EVs可引起肿瘤肺转移,并可能通过激活细胞内自噬途径,从而与诱导的癌细胞上皮间充质转化表型有关。但由于BEVs内容物的复杂性,其参与肿瘤发生发展的具体机制仍未完全阐明[39]。
总而言之,BEVs,特别是来自口腔和肠道的BEVs,作为纳米级别的活性分子并携带着亲本细菌的遗传信息,可参与局部甚至远端组织和器官的通讯,发挥着重要的“致病”作用,相关机制仍在持续探索中。
3 BEVs在疾病诊治中的应用前景
BEVs就像一把双刃剑,一方面参与致病,与疾病的发生发展有关;另一方面参与治病,为相应疾病的诊断及治疗打开了新思路。
3.1 作为新生物标志物
BEVs携带着多种亲本细菌的生物信息分子或代谢分子,在人体血液、尿液、唾液等多种生物体液中均有分布,反映宿主菌群的组成,并积极参与细菌-细菌、宿主-细菌间的通讯,反映宿主生理病理状态[40-41]。此外,相对于具有侵入性的组织学分析及需要昂贵设备的影像学检查等疾病诊治手段[42],体液中的BEVs具有易获取、非侵入性等优势。
依托液体活检技术,BEVs作为疾病进展标志物被提上日程。An Hendrix团队从肠屏障功能障碍患者血浆中成功分离LPS阳性的BEVs,并对其进行定量和定性分析,发现肠屏障功能障碍患者血液中的LPS阳性BEVs含量明显升高且与血浆ZO-1蛋白含量呈正相关,这意味着该类患者肠黏膜完整性降低,渗透性增加,表明其可作为肠屏障受损的潜在生物标志物[12]。
基于多组学技术和生物信息学分析技术,分析体液中的BEVs组成并建立诊断模型后发现,BEVs在感染性疾病、特发性皮炎、呼吸道疾病、神经退行性疾病甚至肿瘤疾病中均展示出较好的诊断效能。
本文总结了近年来BEVs作为疾病潜在预测、诊断、鉴别或预后标志物的研究[43-51],见表1。
表1 BEVs作为潜在生物标志物的最新研究


例如,我国学者利用液相色谱-串联质谱方法发现来自AD患者和健康人粪便BEVs的代谢物存在明显差异,基于这些差异代谢物建立的诊断模型表现出较高的诊断效能,提示BEVs的差异代谢产物可能是AD有效的临床诊断指标[44]。
韩国首都大学癌症研究所利用宏基因组学分析卵巢良性肿瘤患者及卵巢癌患者血清中BEVs的相对丰度差异,发现两组在不动杆菌属的相对丰度方面存在显著差异,联合血清不动菌属、糖类抗原-125及年龄建模可更好识别卵巢癌[46]。
值得注意的是,与组织细胞来源的EVs相比,将BEVs作为疾病生物标志物的研究目前尚处于起步阶段,未来需利用更大纵向临床数据或优化检测分析技术,以探讨体液BEVs作为疾病新生物指标的有效性及临床实用性。
3.2 作为疫苗
BEVs不具备复制能力但具有高免疫原性,有望作为疫苗抗原候选物进行疫苗研发,该想法源于预防感染性疾病。2013年,Vesikari等[52] 率先研发B群脑膜炎奈瑟菌疫苗并获欧盟批准上市。该疫苗基于OMVs设计,装载3种高免疫原性蛋白,可诱导针对B群脑膜炎奈瑟菌的保护性抗体反应。其他基于OMVs的疫苗仍在研发中,尚未进入临床试验阶段[53]。
目前,考虑作为疫苗载体本身的减毒性,基于益生菌EVs的疫苗研发也在进行中。据报道将SARS-CoV-2的受体结构域插入Escherichia coli Nissle 1917分泌的EVs外膜或内部制备而成的新冠疫苗,具备较好的免疫原性及免疫反应性,可诱导较强的特异性体液免疫应答[54]。此外,基于基因工程和“即插即用”技术的更加灵活的疫苗平台的建立,能够快速开发个性化的多价OMVs疫苗[55]。
3.3 作为疾病防治的潜在新型纳米材料
益生菌分泌的EVs是一种对宿主健康有益的无生命微生物,其可避免活菌给宿主带来的潜在危害,同时保留亲本细菌的有益性和免疫原性。因此,益生菌的EVs有望成为预防及治疗相应疾病的新型纳米材料。
本文总结了益生菌EVs在疾病治疗中可能发挥的作用[56-63],见表2。
表2 益生菌细胞外囊泡在疾病治疗中可能发挥的作用

值得一提的是,益生菌EVs可能是预防病毒性感染疾病的新手段。Margolis团队[56]发现,从健康女性阴道分离出来的卷曲乳杆菌BC3和格氏乳杆菌BC12可显著保护离体组织和细胞免受人类免疫缺陷病毒1型(HIV-1)的感染,而这种保护机制正是通过乳酸杆菌释放的EVs发挥作用,若该研究结果在体内得到证实,这些乳酸杆菌EVs可能成为预防HIV-1性传播的新策略。
另外,国内团队[64] 发现口服肠道益生菌阿克曼氏菌的EVs可缓解葡聚糖硫酸钠诱导的结肠炎症状和病理表现,并探明其可能以选择性膜融合的方式特异性增加拟杆菌和乳酸杆菌等有益菌相对丰度,减少条件致病菌,从而显著逆转肠道微生物失衡。该研究还表明肠道益生菌的EVs对胃酸、胃黏液等具有较好的抵抗性。因此,肠道益生菌的EVs可能为IBD的干预和治疗提供了新靶点。
值得注意的是,目前益生菌EVs的应用仅停留于体外细胞及动物实验层面,未来仍需更多的人群研究及技术上的安全保障。
3.4 作为抗肿瘤制剂
1992年,Coley等[65]发现注射消菌溶液可治疗癌症患者,使细菌相关物质治疗癌症成为可能。2017年,Kim等[66]的研究表明,静脉注射减毒工程菌的EVs可引起强而长期的干扰素-γ和T细胞介导的抗肿瘤免疫反应,甚至完全消除肿瘤。
最近,研究者们采用仿生矿化的方法以避免单纯OMVs直接静脉注射带来的细胞因子风暴和抗体特异性清除等毒副作用,瓦解肿瘤免疫抑制微环境,增强免疫细胞的杀伤能力,从而有效抑制肿瘤生长[67]。
有学者研发了“即插即用”系统,用程序性死亡[蛋白]-1(PD-1)修饰在BEVs的外膜,促进程序性死亡[蛋白]配体-1(PD-L1)在肿瘤细胞表面的结合,同时保护T细胞免受PD-1/PD-L1免疫抑制轴的伤害[68]。基于BEVs的“即插即用”系统,可实现针对不同患者的特异性肿瘤抗原谱,合理设计表达不同肿瘤抗原的BEVs疫苗,从而实现个体化肿瘤治疗[69]。目前,越来越多的研究表明BEVs联合其他治疗可进一步增强肿瘤免疫治疗,彻底根除肿瘤,甚至可防止肿瘤复发和转移[70-71]。
4 挑战及未来研究方向
随着BEVs与更多疾病的研究机制被阐明,BEVs作为潜在生物标志物、疫苗、抗肿瘤制剂等为疾病防治提供了新途径。然而,BEVs的基础研究及临床转化过程仍面临巨大挑战:
(1)首先,分离和纯化BEVs的方法尚未标准化。目前,常见方法包括超速离心法、超滤法、尺寸排阻法及密度梯度离心法[72-73]。其中,超速离心法基于离心速度将囊泡从细胞碎片、细菌等物质中分离出来,是最常用的分离方法,但其设备昂贵且离心力会破坏BEVs的结构和功能;超滤法采用不同截留相对分子质量的超滤膜进行选择性分离,从而收集及浓缩囊泡,其回收效率最高但分离纯度最低;尺寸排阻法通过多孔聚合物凝胶填料对不同大小颗粒进行分离,其分离纯度较高但仅适用于小体积样本的提取;密度梯度离心法通过超高速离心将BEVs分布在一定范围的密度层中,分离纯度最高但操作也最繁琐[6]。Hendrix教授团队已联合尺寸排阻法和密度梯度离心法成功分离血浆中LPS阳性的BEVs,且该方法具有临床实操性[12],因此未来需探讨如何优化组合或创新提纯BEVs的方式。
(2)其次,BEVs具有异质性[74]。目前尚无有效方法从粪便、血液等复杂体液中识别特定的BEVs。未来需更成熟的蛋白质组学、脂质组学或代谢组学等技术筛选BEVs特异性标志物,提高其对疾病诊断的特异性。
(3)最后,BEVs的活性对储存条件要求苛刻。不同的储存温度和时间对BEVs活性的损伤程度不同[75],而储存和运输在BEVs的基础研究和临床应用中极为重要,因此需优化存储条件和运输方式。
5 小结与展望
BEVs作为一种携带亲本细菌生物信息分子的囊泡状纳米颗粒,充当着物种之间及跨物种相互作用的关键新媒介,其在宿主疾病发生发展及诊治中充分展示了“双刃剑”的作用。
依托液体活检技术,充分利用微生物组学技术,初步展示了BEVs作为疾病新标志物的潜力;此外,BEVs在疫苗研发、补充益生菌EVs和作为抗肿瘤制剂为疾病防治提供了新手段,应用前景巨大。但在BEVs的基础研究及临床转化过程中,囊泡分离技术、疾病诊断特异性、囊泡储运优化等仍面临挑战。
与组织细胞分泌的EVs相比,BEVs的相关研究尚处于起步阶段,未来需严格设计的临床研究证实其诊断和治疗价值。相信在不久的未来,BEVs的体外诊断及疾病防治成果可让更多患者受益。
参考文献
[1]Toyofuku M, Nomura N, Eberl L. Types and origins of bacterial membrane vesicles[J]. Nat Rev Microbiol, 2019, 17: 13-24.
[2]Díaz-Garrido N, Badia J, Baldomà L. Microbiota-derived extracellular vesicles in interkingdom communication in the gut[J]. J Extracell Vesicles, 2021, 10: e12161.
[3]Toyofuku M, Schild S, Kaparakis-Liaskos M, et al. Composition and functions of bacterial membrane vesicles[J]. Nat Rev Microbiol, 2023, 21: 415-430.
[4]Hendrix A, De Wever O. Systemically circulating bacterial extracellular vesicles: origin, fate, and function[J]. Trends Microbiol, 2022, 30: 213-216.
[5]Toyofuku M, Cárcamo-Oyarce G, Yamamoto T, et al. Prophage-triggered membrane vesicle formation through peptidoglycan damage in Bacillus subtilis[J]. Nat Commun, 2017, 8: 481.
[6]Xie J, Li Q, Haesebrouck F, et al.The tremendous biomedical potential of bacterial extracellular vesicles[J]. Trends Biotechnol, 2022, 40: 1173-1194.
[7]Devos S, Van Putte W, Vitse J, et al. Membrane vesicle secretion and prophage induction in multidrug-resistant Stenotrophomonas maltophilia in response to ciprofloxacin stress[J]. Environ Microbiol, 2017, 19: 3930-3937.
[8]Brown L, Wolf JM, Prados-Rosales R, et al. Through the wall: extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi[J]. Nat Rev Microbiol, 2015, 13: 620-630.
[9]Lee EY, Choi DS, Kim KP, et al. Proteomics in gram-negative bacterial outer membrane vesicles[J]. Mass Spectrom Rev, 2008, 27: 535-555.
[10]Zakharzhevskaya NB, Vanyushkina AA, Altukhov IA, et al. Outer membrane vesicles secreted by pathogenic and nonpathogenic Bacteroides fragilis represent different metabolic activities[J]. Sci Rep, 2017, 7: 5008.
[11]Kaplan GG. The global burden of IBD: from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 720-727.
[12]Jones E, Stentz R, Telatin A, et al. The Origin of Plasma-Derived Bacterial Extracellular Vesicles in Healthy Individuals and Patients with Inflammatory Bowel Disease: A Pilot Study[J]. Genes (Basel), 2021, 12:1636.
[13]Liu L, Liang L, Yang C, et al. Extracellular vesicles of Fusobacterium nucleatum compromise intestinal barrier through targeting RIPK1-mediated cell death pathway[J]. Gut Microbes, 2021, 13: 1-20.
[14]Engevik MA, Danhof HA, Ruan W, et al. Fusobacterium nucleatum Secretes Outer Membrane Vesicles and Promotes Intestinal Inflammation[J]. mBio, 2021, 12: e02706-20.
[15]Kaparakis M, Turnbull L, Carneiro L, et al. Bacterial membrane vesicles deliver peptidoglycan to NOD1 in epithelial cells[J]. Cell Microbiol, 2010, 12: 372-385.
[16]Patten DA, Hussein E, Davies SP, et al. Commensal-derived OMVs elicit a mild proinflammatory response in intestinal epithelial cells[J]. Microbiology (Reading), 2017, 163: 702-711.
[17]Pritchard AB, Fabian Z, Lawrence CL, et al. An Investigation into the Effects of Outer Membrane Vesicles and Lipopolysaccharide of Porphyromonas gingivalis on Blood-Brain Barrier Integrity, Permeability, and Disruption of Scaffolding Proteins in a Human in vitro Model[J]. J Alzheimers Dis, 2022, 86: 343-364.
[18]Muraca M, Putignani L, Fierabracci A, et al. Gut microbiota-derived outer membrane vesicles: under-recognized major players in health and disease?[J]. Discov Med, 2015, 19: 343-348.
[19]Choi HI, Choi JP, Seo J, et al. Helicobacter pylori-derived extracellular vesicles increased in the gastric juices of gastric adenocarcinoma patients and induced inflammation mainly via specific targeting of gastric epithelial cells[J]. Exp Mol Med, 2017, 49: e330.
[20]Lee KE, Kim JK, Han SK, et al. The extracellular vesicle of gut microbial Paenalcaligenes hominis is a risk factor for vagus nerve-mediated cognitive impairment[J]. Microbiome, 2020, 8: 107.
[21]Ma X, Shin YJ, Yoo JW, et al. Extracellular vesicles derived from Porphyromonas gingivalis induce vagus nerve-mediated cognitive impairment[J]. J Adv Res, 2023.doi: 10.1016/j.jare.2023.02.006.
[22]Park AM, Tsunoda I. Helicobacter pylori infection in the stomach induces neuroinflammation: the potential roles of bacterial outer membrane vesicles in an animal model of Alzheimer's disease[J]. Inflamm Regen, 2022, 42: 39.
[23]Yoshida K, Yoshida K, Seyama M, et al. Porphyromonas gingivalis outer membrane vesicles in cerebral ventricles activate microglia in mice[J]. Oral Dis, 2022.doi: 10.1111/odi.14413.
[24]Wei S, Peng W, Mai Y, et al. Outer membrane vesicles enhance tau phosphorylation and contribute to cognitive impairment[J]. J Cell Physiol, 2019, 235: 4843-4855.
[25]Gong T, Chen Q, Mao H, et al. Outer membrane vesicles of Porphyromonas gingivalis trigger NLRP3 inflammasome and induce neuroinflammation, tau phosphorylation, and memory dysfunction in mice[J]. Front Cell Infect Microbiol, 2022, 12: 925435.
[26]Younossi ZM, Golabi P, de Avila L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis[J]. J Hepatol, 2019, 71: 793-801.
[27]Villard A, Boursier J, Andriantsitohaina R. Bacterial and eukaryotic extracellular vesicles and nonalcoholic fatty liver disease: new players in the gut-liver axis?[J]. Am J Physiol Gastrointest Liver Physiol, 2021, 320: G485-G495.
[28]Fizanne L, Villard A, Benabbou N, et al. Faeces-derived extracellular vesicles participate in the onset of barrier dysfunction leading to liver diseases[J]. J Extracell Vesicles, 2023, 12: e12303.
[29]Natsui K, Tsuchiya A, Imamiya R, et al. Escherichia coli-derived outer-membrane vesicles induce immune activation and progression of cirrhosis in mice and humans[J]. Liver Int, 2023, 43: 1126-1140.
[30]Choi Y, Kwon Y, Kim DK, et al. Gut microbe-derived extracellular vesicles induce insulin resistance, thereby impairing glucose metabolism in skeletal muscle[J]. Sci Rep, 2015, 5: 15878.
[31]Chelakkot C, Choi Y, Kim D, et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permea-bility through the regulation of tight junctions[J]. Exp Mol Mede, 2018, 50: e450.
[32]Luo Z, Ji Y, Gao H, et al. CRIg+ Macrophages Prevent Gut Microbial DNA-Containing Extracellular Vesicle-Induced Tissue Inflammation and Insulin Resistance[J]. Gastroenterology, 2021, 160: 863-874.
[33]Mcinnes IB, Schett G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med, 2011, 365: 2205-2219.
[34]Hong M, Li Z, Liu H, et al. Fusobacterium nucleatum aggravates rheumatoid arthritis through FadA-containing outer membrane vesicles[J]. Cell Host Microbe, 2023,31: 798-810.e7.
[35]Quirke AM, Lugli EB, Wegner N, et al. Heightened immune response to autocitrullinated Porphyromonas gin-givalis peptidylarginine deiminase: a potential mechanism for breaching immunologic tolerance in rheumatoid arthritis[J]. Ann Rheum Dis, 2014, 73: 263-269.
[36]Gabarrini G, Palma Medina LM, Stobernack T, et al. There's no place like OM: Vesicular sorting and secretion of the peptidylarginine deiminase of Porphyromonas gingivalis[J]. Virulence, 2018, 9: 456-464.
[37]Sepich-Poore GD, Zitvogel L, Straussman R, et al. The microbiome and human cancer[J]. Science, 2021, 371: eabc4552.
[38]Chronopoulos A, Kalluri R. Emerging role of bacterial extracellular vesicles in cancer[J]. Oncogene, 2020, 39: 6951-6960.
[39]Chen G, Gao C, Jiang S, et al. Fusobacterium nucleatum outer membrane vesicles activate autophagy to promote oral cancer metastasis[J]. J Adv Res, 2023.doi: 10.1016/j.jare.2023.04.002.
[40]Schaack B, Hindré T, Quansah N, et al. Microbiota-Derived Extracellular Vesicles Detected in Human Blood from Healthy Donors[J]. Int J Mol Sci, 2022, 23: 13787.
[41]Yoo JY, Rho M, You YA, et al. 16S rRNA gene-based metagenomic analysis reveals differences in bacteria-derived extracellular vesicles in the urine of pregnant and non-pregnant women[J]. Exp Mol Med, 2016, 48: e208.
[42]Vandendriessche C, Kapogiannis D, Vandenbroucke RE. Biomarker and therapeutic potential of peripheral extracel-lular vesicles in Alzheimer's disease[J]. Adv Drug Deliv Rev, 2022, 190: 114486.
[43]Dey S, Gudipati S, Giuliano C, et al. Reduced Production of Bacterial Membrane Vesicles Predicts Mortality in ST45/USA600 Methicillin-Resistant Staphylococcus aureus Bacteremia[J]. Antibiotics (Basel), 2019, 9:2.
[44]Wei SC, Wei W, Peng WJ, et al. Metabolic Alterations in the Outer Membrane Vesicles of Patients with Alzheimer's Disease: An LC-MS/MS-based Metabolomics Analysis[J]. Curr Alzheimer Res, 2019, 16: 1183-1195.
[45]Yang J, Moon HE, Park HW, et al. Brain tumor diagnostic model and dietary effect based on extracellular vesicle microbiome data in serum[J]. Exp Mol Med, 2020, 52: 1602-1613.
[46]Kim SI, Kang N, Leem S, et al. Metagenomic Analysis of Serum Microbe-Derived Extracellular Vesicles and Diagnostic Models to Differentiate Ovarian Cancer and Benign Ovarian Tumor[J]. Cancers (Basel), 2020, 12:1309.
[47]Kim DJ, Yang J, Seo H, et al. Colorectal cancer diagnostic model utilizing metagenomic and metabolomic data of stool microbial extracellular vesicles[J]. Sci Rep, 2020, 10: 2860.
[48]Yang J, McdowelL A, Seo H, et al. Diagnostic Models for Atopic Dermatitis Based on Serum Microbial Extracellular Vesicle Metagenomic Analysis: A Pilot Study[J]. Allergy Asthma Immunol Res, 2020, 12: 792-805.
[49]Yang J, Hong G, Kim YS, et al. Lung Disease Diagnostic Model Through IgG Sensitization to Microbial Extracellular Vesicles[J]. Allergy Asthma Immunol Res, 2020, 12: 669-683.
[50]Han P, Bartold PM, Salomon C, et al. Salivary Outer Membrane Vesicles and DNA Methylation of Small Extracellular Vesicles as Biomarkers for Periodontal Status: A Pilot Study[J]. Int J Mol Sci, 2021, 22:2423.
[51]Yoon H, Kim NE, Park J, et al. Analysis of the gut microbiome using extracellular vesicles in the urine of patients with colorectal cancer[J]. Korean J Intern Med, 2023, 38: 27-38.
[52]VesikarI T, Esposito S, Prymula R, et al. Immunogenicity and safety of an investigational multicomponent, recombin-ant, meningococcal serogroup B vaccine (4CMenB) administered concomitantly with routine infant and child vaccinations: results of two randomised trials[J]. Lancet, 2013, 381: 825-835.
[53]Kaparakis-Liaskos M, Ferrero RL. Immune modulation by bacterial outer membrane vesicles[J]. Nat Rev Immunol, 2015, 15: 375-387.
[54]Wo J, Lv ZY, Sun JN, et al. Engineering probiotic-derived outer membrane vesicles as functional vaccine carriers to enhance immunity against SARS-CoV-2[J]. iScience, 2023, 26: 105772.
[55]Chen L, Valentine JL, Huang CJ, et al. Outer membrane vesicles displaying engineered glycotopes elicit protective antibodies[J]. Proc Natl Acad Sci U S A, 2016, 113: E3609-E3618.
[56]Ñahui Palomino RA, Vanpouille C, Laghi L, et al. Extracellular vesicles from symbiotic vaginal lactobacilli inhibit HIV-1 infection of human tissues[J]. Nat Commun, 2019, 10: 5656.
[57]Kim MH, Choi S J, Choi HI, et al. Lactobacillus plantarum-derived Extracellular Vesicles Protect Atopic Dermatitis Induced by Staphylococcus aureus-derived Extracellular Vesicles[J]. Allergy Asthma Immunol Res, 2018, 10: 516-532.
[58]Tong L, Zhang X, Hao H, et al. Lactobacillus rhamnosus GG Derived Extracellular Vesicles Modulate Gut Microbiota and Attenuate Inflammatory in DSS-Induced Colitis Mice[J]. Nutrients, 2021, 13:3319.
[59]Hu R, Lin H, Wang M, et al. Lactobacillus reuteri-derived extracellular vesicles maintain intestinal immune homeostasis against lipopolysaccharide-induced inflammatory responses in broilers[J]. J Anim Sci Biotechnol, 2021, 12: 25.
[60]Lee DH, Park HK, Lee HR, et al. Immunoregulatory effects of Lactococcus lactis-derived extracellular vesicles in allergic asthma[J]. Clin Transl Allergy, 2022, 12: e12138.
[61]Croatti V, Parolin C, Giordani B, et al. Lactobacilli extracellular vesicles: potential postbiotics to support the vaginal microbiota homeostasis[J]. Microb Cell Fact, 2022, 21: 237.
[62]Choi J, Kwon H, Kim YK, et al. Extracellular Vesicles from Gram-positive and Gram-negative Probiotics Remediate Stress-Induced Depressive Behavior in Mice[J]. Mol Neurobiol, 2022, 59: 2715-2728.
[63]Ye W, Chen Z, He Z, et al. Lactobacillus plantarum-Derived Postbiotics Ameliorate Acute Alcohol-Induced Liver Injury by Protecting Cells from Oxidative Damage, Improving Lipid Metabolism, and Regulating Intestinal Microbiota[J]. Nutrients, 2023, 15:845.
[64]Wang X, Lin S, Wang L, et al. Versatility of bacterial outer membrane vesicles in regulating intestinal homeostasis[J]. Sci Adv, 2023, 9: eade5079.
[65]Starnes CO. Coley's toxins[J]. Nature, 1992, 360: 23.
[66]Kim OY, ParK HT, Dinh NTH, et al. Bacterial outer membrane vesicles suppress tumor by interferon-γ-mediated antitumor response[J]. Nat Commun, 2017, 8: 626.
[67]Qing S, Lyu C, Zhu L, et al. Biomineralized Bacterial Outer Membrane Vesicles Potentiate Safe and Efficient Tumor Microenvironment Reprogramming for Anticancer Therapy[J]. Adv Mater, 2020, 32: e2002085.
[68]Li Y, Ma X, Yue Y, et al. Rapid Surface Display of mRNA Antigens by Bacteria-Derived Outer Membrane Vesicles for a Personalized Tumor Vaccine [J]. Adv Mater, 2022, 34: e2109984.
[69]Meng F, Li L, Zhang Z, et al. Biosynthetic neoantigen displayed on bacteria derived vesicles elicit systemic antitumour immunity[J]. J Extracell Vesicles, 2022, 11: e12289.
[70]Kuerban K, Gao X, Zhang H, et al. Doxorubicin-loaded bacterial outer-membrane vesicles exert enhanced anti-tumor efficacy in non-small-cell lung cancer[J]. Acta Pharm Sin B, 2020, 10: 1534-1548.
[71]Liu XZ, Wen ZJ, Li YM, et al. Bioengineered Bacterial Membrane Vesicles with Multifunctional Nanoparticles as a Versatile Platform for Cancer Immunotherapy[J]. ACS Appl Mater Interfaces, 2023, 15: 3744-3759.
[72]Bauman SJ, Kuehn MJ. Purification of outer membrane vesicles from Pseudomonas aeruginosa and their activation of an IL-8 response[J]. Microbes Infect, 2006, 8: 2400-2408.
[73]Northrop-Albrecht EJ, Taylor WR, Huang BQ, et al. Assessment of extracellular vesicle isolation methods from human stool supernatant[J]. J Extracell Vesicles, 2022, 11: e12208.
[74]Hong J, Dauros-Singorenko P, Whitcombe A, et al. Analysis of the Escherichia coli extracellular vesicle proteome identifies markers of purity and culture conditions[J]. J Extracell Vesicles, 2019, 8: 1632099.
[75]Gelibter S, Marostica G, Mandelli A, et al. The impact of storage on extracellular vesicles: A systematic study[J]. J Extracell Vesicles, 2022, 11: e12162.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







