JCO长篇综述:CAR T和双抗治疗MM的作用机制、疗效、毒性和最佳排序
2023-08-20 聊聊血液 聊聊血液 发表于上海
作者分析了CART细胞和BsAb治疗的最新数据,回顾了疗效和安全性考虑,特别关注细胞因子释放综合征、神经毒性和感染风险,还讨论了每一类治疗的相对优点和局限性,以及最佳排序和支持治疗措施方面未满足的需求
多发性骨髓瘤
由于缺乏有效的治疗选择,三重难治性(triple-class refractory)和五药难治性(penta-drug refractory)多发性骨髓瘤 (MM) 患者的结局一直较差。然而CAR T细胞和 T 细胞重定向双特异性抗体 (BsAb) 疗法的出现,使得重度复发/难治性 (R/R) 人群获得了前所未有的缓解率和缓解持续时间。
目前美国已有两种靶向BCMA的 CAR T 细胞疗法(idecabtagene vicleucel和ciltacabtagene autoleucel)及两款 BCMA/CD3 BsAb (teclistamab和
近日获批的elranatamab)获批用于晚期(既往超过4线治疗)RRMM,我国仅有一款BCMA CAR T产品上市,即驯鹿生物/信达生物的伊基奥仑赛注射液,用于治疗RRMM成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
《Journal of Clinical Oncology》近日发表一篇综述“Chimeric Antigen Receptor T-Cell and Bispecific Antibody Therapy in Multiple Myeloma: Moving Into the Future”,作者分析了CAR T 细胞和 BsAb 治疗(包括非BCMA靶向药物)的最新数据,回顾了疗效和安全性考虑,特别关注细胞因子释放综合征、神经毒性和感染风险,还讨论了每一类治疗的相对优点和局限性,以及最佳排序和支持治疗措施方面未满足的需求。

作用机制
CAR T 细胞和 T 细胞重定向的 BsAbs 都是利用T 细胞的细胞毒活性。T 细胞具有抗 MM 活性,但 MM 中多种机制导致 T 细胞功能障碍,而CAR T细胞通过基因修饰 T 细胞,通过信号域偶联抗原识别受体,使 T 细胞靶向特定的肿瘤抗原(例如BCMA),从而克服部分障碍(图1A)。当前的市售产品均来源于自体 T 细胞,而异基因CAR T 细胞也在开发中。简言之,患者接受外周血白细胞单采以获得自体 T 细胞,随后 T 细胞运送至中心生产实验室进行工程化和扩增。根据产品和生产工艺,这可能需要几天到8周的时间。在接受成品工程产品之前,患者接受清淋化疗(最常见的是氟达拉滨和环磷酰胺)。桥接化疗通常在生产期间给药,以维持疾病控制。CAR T 细胞治疗被称为活药物,因为细胞可在体内扩增,但持续时间各有不同。
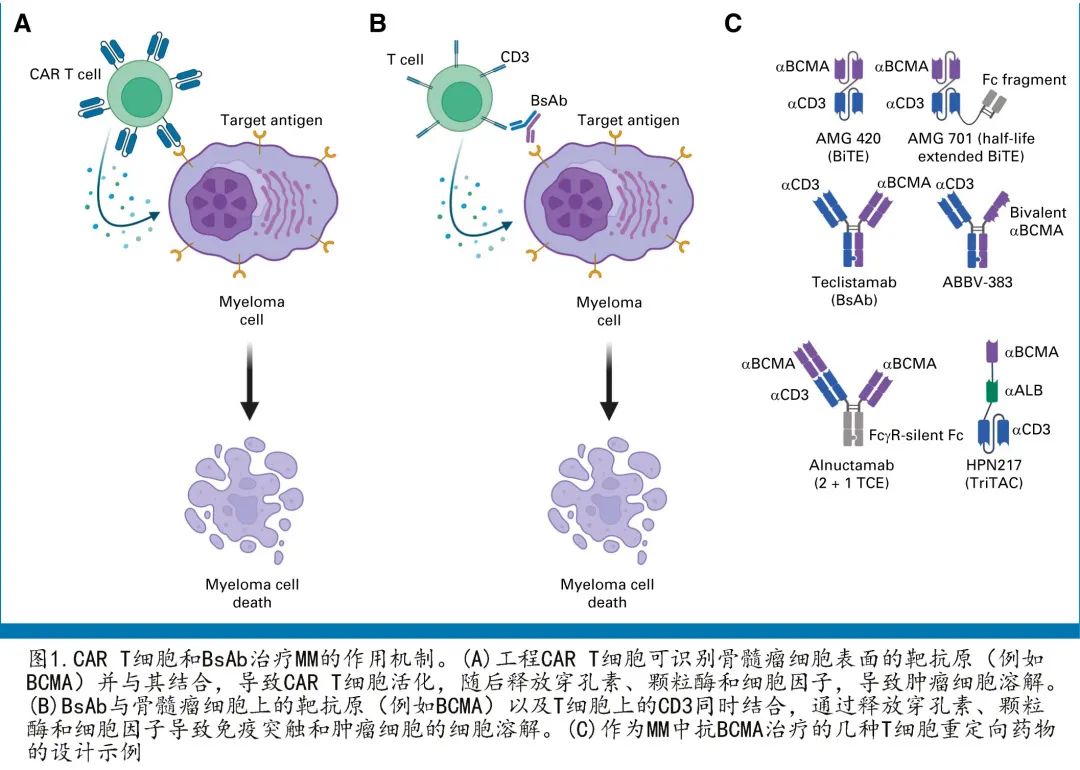
BsAbs和相关 T 细胞重定向药物通常被称为 CAR T 细胞疗法的现成(off-the-shelf)替代品,通过同时结合 T 细胞和 MM 细胞而将 T 细胞导向 MM 细胞,形成免疫突触(图1B)。该领域的初步探索为双特异性 T 细胞衔接系统AMG-420,由靶向 BCMA 和 CD3 的两个连接单链可变片段组成(图1C)。尽管 AMG-420 在 R/R MM 的 I 期首次人体研究中确实显示出活性(ORR为31%;最大耐受剂量下为70%),但存在需要连续 IV 输注的缺陷。后续研究重点关注半衰期延长的衍生物,如pavurutamab(AMG 701;图1C)。最终,该领域转向BsAbs(例如teclistamab),其包括提供稳定性并延长药物半衰期的 Fc 区,可减少给药频率(图1C)。其他变化包括具有两个 BCMA 结合域的药物(例如 ABBV-383 和alnuctamab)、三特异性 T 细胞激活结构(包括用于延长半衰期的抗白蛋白域(例如HPN217))和 Fc 部分修饰以最小化与 FcgR 和 C1q 的结合(例如alnuctamab;图1C)。
疗效
Idecabtagene vicleucel(ide-cel)、ciltacabtagene autoleucel(cilta-cel)和 teclistamab 的加速批准是基于在既往未接受过 BCMA 靶向治疗的 RRMM 患者中开展的 I/II 期研究,elranatamab的研究则分为既往接受过/未接受过 BCMA 靶向治疗两个队列。如表1所示,入组这些研究的大多数 MM 患者接受过多线治疗(中位5-6线既往治疗),患有三重难治性疾病,且少数患有五药难治性疾病。在这种情况下,ide-cel (73%)、 cilta-cel (98%) 、teclistamab (63%) 和elranatamab(61%)的 ORR 成为该难治性疾病人群的新基准。
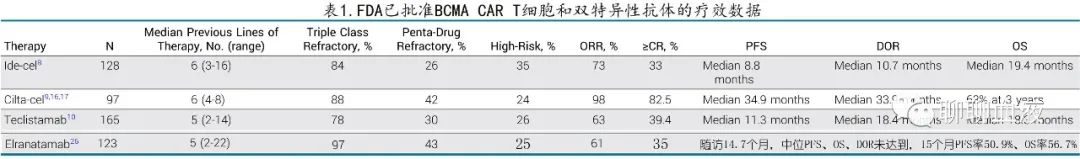
其他几项 ide-cel 或 cilta-cel 的研究也报告了结局。CARTITUDE-2 队列 A 评价了既往接受过1-3线治疗的患者 (n=20)(既往中位2线治疗,均为三重暴露,40%为三重难治),ORR 为95%,85%达到≥CR缓解,6个月 PFS 率为90%。KarMMa-2 队列 2a 入组了一线治疗(诱导、自体干细胞移植 [ASCT] 和含来那度胺维持治疗;n=37)后18个月内疾病进展的患者,46%的患者达到≥CR缓解(主要终点),中位 PFS 为11.4个月。CARTITUDE-2 队列 B 研究还评估了功能性高危人群(一线ASCT后12个月内或诱导开始后12个月内复发的人群,n=19),结果ORR 为100%,90%达到≥CR缓解,12个月 PFS 率为90%。
已有两项确证性 III 期研究的完整结果出炉。KarMMa-3 研究入组了既往接受过2-4线治疗的患者,以2:1的方式随机接受 ide-cel 或5种标准化疗方案之一。该研究达到了 PFS 的主要终点,ide-cel组的中位 PFS 为13.3个月,标准方案组为4.4个月(风险比 [HR]=0.49;P<0.001)。CARTITUDE-4 研究入组来那度胺难治性 MM 且既往接受过1-3线治疗的患者,并将患者随机分配至 cilta-cel 组或标准治疗组(包括达雷妥尤单抗/泊马度胺/地塞米松或泊马度胺/硼替佐米/地塞米松)。本研究也达到 PFS 的主要终点,cilta-cel未达到中位PFS,而标准治疗组为11.8个月(HR=0.26;P<0.001)。
Ide-cel 和 cilta-cel 上市后的真实世界经验也有报道。11家美国机构使用 ide-cel 的经验,ORR 为84%,中位 PFS 为8.5个月。同样,一项来自法国登记研究的报告(49例输注 ide-cel 的患者)指出,3个月时的 ORR 为76%,3个月 PFS 率为82%。12家美国机构使用市售 cilta-cel 的经验,短暂随访(中位5.8个月)时最佳 ORR 为89%,6个月 PFS 率为79%。
Teclistamab是首个获得监管批准的 BCMA BsAb,第二个是elranatamab,还有多种其他 BCMA 靶向药物正在开发中(图1C;表2)。有趣的是,所有这些 BCMA-/T细胞靶向药物的缓解率在各研究中惊人地一致(50%-60%);但所有这些药物是否最终获得监管批准,以及对一种药物难治是否等同于对该组中所有药物难治,仍有待确定。正在研究多种其他 BCMA CAR T 细胞产品(表2),其中部分产品使用了创新的生产程序(例如CC-98633/BMS-986354)、仅重链 BCMA 结合域(例如FHVH-T)、双抗原靶向(例如双特异性CS1-BCMA)或异基因 T细胞(例如ALLO-715)。所有产品的缓解率均较高 (>60%),但研究的随访信息不足以衡量缓解的持久性。
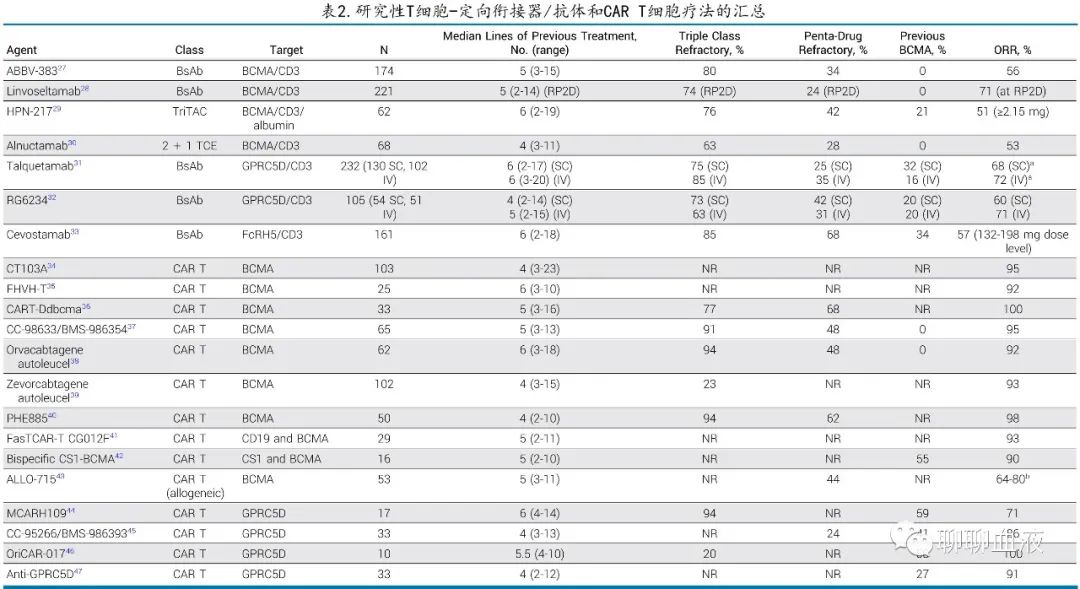
值得注意的是,CAR T细胞和 BsAb 已经在靶向BCMA之外进行开发(表2),特别令人感兴趣的是GPRC5D,其在浆细胞上高表达,GPRC5D CAR T 细胞的几项 I 期研究均显示较高的缓解率 (71%-100%)。同样,GPRC5D/CD3 BsAbs talquetamab和 RG6234 的 ORR 也介于60%-70%。最后,FcRH5也是 MM 的靶点,cevostamab(一种直接针对 FcRH5/CD3 的BsAb)的 I 期研究显示,在较高剂量水平下ORR为57%。抗 GPRC5D 和 FcRH5 研究纳入了部分既往接受过 BCMA 靶向治疗的受试者,这一点很重要,因为该人群正在迅速成为未满足需求的领域。
毒性
除 MM 治疗的典型血液学和非血液学毒性外,CAR T细胞和双特异性治疗还具有重要的类毒性,包括细胞因子释放综合征 (CRS) 和免疫效应细胞相关神经毒性综合征(ICANS;表3)。在接受 CAR T 细胞和BsAb治疗的MM患者中,CRS(特征为发热、低血压、缺氧和呼吸窘迫)的发生率分别约为90%和70%(表3)。与 CAR T 细胞疗法相比,BsAb引起的 CRS 的发生率通常较低且级别较低,部分原因可能是采用了剂量递增方案,即以极低剂量引入BsAb,然后多次递增剂量以达到完整的计划剂量。管理 CRS 的临床实践指南鼓励早期使用类固醇和白细胞介素-6受体拮抗剂托珠单抗。有学者探索在 cevostamab 首次给药前2小时预防性使用托珠单抗,结果仅36%的患者发生CRS,而历史队列为90%。继续完善支持治疗,包括前驱用药、替代给药策略和预防性托珠单抗,可进一步降低接受 CAR T 细胞和 BsAb 治疗患者中CRS的发生率。

ICANS可包括一系列症状和体征,包括头痛、意识模糊、嗜睡、癫痫发作和昏迷,减少 ICANS 发生的策略包括使用桥接治疗降低肿瘤负荷、强化持续监测和早期开始神经毒性治疗。随着 CAR T 细胞治疗经验的增加,对 ICANS 对患者功能和生活质量 (QoL) 影响的认知也仍在不断发展,特别是迟发性神经毒性,如帕金森综合征、运动障碍、认知障碍、颅神经麻痹和周围神经病变。
晚期 MM 患者本身就存在重度免疫功能低下和严重感染风险,因此许多 MM CAR T 细胞和双特异性研究中均观察到高感染率(包括≥3级)(表3),甚至包括5级事件。Ide-cel 或cilta-cel ≥3级感染的发生率约为20%;MajesTEC1 研究中 teclistamab 的≥3级感染率为45%。此外COVID-19感染也高发,其中12 例死于 COVID-19。所有 BCMA双特异性药物是否具有相似的感染风险仍有待确定,但有趣的是,在 talquetamab MonumenTAL-1 研究中,≥3级感染的发生率仅为7%,可能表明 GPRC5D 靶向治疗的感染风险低于 BCMA 靶向治疗。
在接受 ide-cel 的患者的一项真实队列中,超过半数的患者在前100天内发生感染;前30天内的感染多为细菌感染,并与血细胞减少相关。而另一组报告,在 BCMA CAR T 细胞治疗后的前3个月内主要是病毒感染,95%的患者出现低丙球蛋白血症。另一项回顾性分析显示,接受 BCMA BsAb 治疗的患者的感染率较高,所有应答者均出现重度低丙球蛋白血症(IgG水平<200mg/dL)。最近对11项 BsAbs 研究中的1185例受试者进行的汇总分析显示,严重甚至致死性感染的发生率较高:24.5%为3/4级感染,包括10%为3/4级肺炎。在报告的死亡中25%是由于感染。在异基因移植以外的 MM 人群中通常未观察到的机会性感染也有报道,包括耶氏肺孢子虫肺炎感染和巨细胞病毒再激活。在接受 BCMA靶向双特异性药物治疗的患者中也有长期病毒感染的报告,包括细小病毒和诺如病毒。
接受 BCMA BsAbs 治疗的患者中,3/4级中性粒细胞减少症的发生率似乎略高于非 BCMA BsAbs 治疗的患者。BCMA CAR T 细胞治疗后还观察到长期淋巴细胞减少症和低丙球蛋白血症。在报告低丙球蛋白血症的4项研究中,发病率为75%,近半数患者接受静脉注射免疫球蛋白。由于大多数临床试验和获批产品的商业使用发生在COVID-19 大流行期间,因此报告COVID-19 相关死亡也并不奇怪。此外COVID-19 诱导的免疫失调(尤其是 T 细胞功能障碍)对其他感染的易感性以及MM 对 CAR T 细胞和 BsAb 治疗反应性的影响程度仍有待确定。需要 MM 临床医生、细胞/移植专家和传染病专家之间的合作,以制定 CAR T 和 BsAb 治疗后预防的最佳实践。
靶向新型抗原 (GPRC5D) 的新类别药物的开发同时伴随着一组新的毒性。GPRC5D是一种孤儿受体,其生理功能尚未明确;虽然 GPRC5D 在浆细胞上高表达,但在皮肤硬角化组织和毛囊内的细胞上也有表达。使用 GPRC5D靶向 CAR T 细胞或 BsAbs 的研究报告了皮肤和指(趾)甲变化、皮疹和口腔相关不良事件,包括味觉障碍、口干和吞咽困难(表3),推测与这些组织中 GPRC5D 的表达有关。需要采取策略来最小化这些毒性并改善这些治疗的长期耐受性。
除了传统的不良事件报告和分级,还需要患者为中心,关注潜在毒性和其他个体健康结局,例如 CAR T 细胞治疗对患者报告功能和 QoL 的影响。
真实环境中治疗的可及性和平等性
考虑到临床试验人群通常是高度选择的,需要克服的障碍之一在于早期试验数据的普遍性,表4强调了已发表的 MM CAR T 细胞和 BsAb 研究中参与者的人口统计学特征。受试者倾向于更年轻、体能状态良好、白人更多,大多数研究排除了患有各种常见共病的患者,因此在临床试验典型代表性不足的患者中,临床医生对最有效治疗的认知存在差距。而真实世界数据可作为重要信息来源,例如在美国接受市售 ide-cel 的真实患者中,75%的患者由于实验室检查异常、既往 BCMA靶向治疗、其他恶性肿瘤或其他疾病而无资格参加 KarMMa研究,但报告的 ORR 和 PFS 值与原始研究相似。
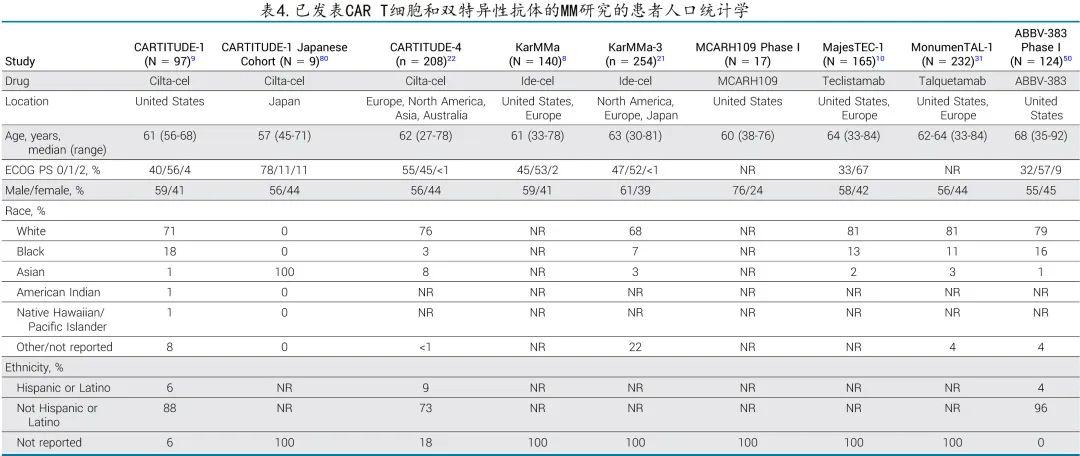
大多数血液恶性肿瘤研究中的老年人入组不足,在已发表的 CAR T 和 BsAb 试验中同样如此(表4)。排除性合并症通常包括充血性心力衰竭、近期心肌梗死、活动性感染和过去3-5年内的继发性恶性肿瘤,即使符合入组标准,老年人仍可能存在与衰老相关的脆弱性,引起临床医生对其毒性风险的担忧。尽管早期数据令人鼓舞,在真实世界实践中接受 CAR T 细胞治疗的老年患者耐受性与年轻患者相似,但更广泛地使用CAR-T将揭示哪些患者结局较差。例如最近的一项研究表明,肌肉减少症与 ICANS 风险增加和住院时间延长相关。通过不断收集更多关于 CAR T 细胞和 BsAbs 临床试验中入组个体基线健康的数据(包括老年评估),将提高临床医生的洞察力,即他们的患者是否与试验中的患者相似,并确定可能增加毒性风险的患者,从而实现更明智的共同决策。
另一个关键步骤将需要创新的方法来促进CAR T 细胞和BsAbs获批后的可及性。尽管目前 CAR T 细胞治疗在很大程度上仅限于移植中心,但在三级医疗环境之外,BsAbs可能更容易实施,即使在首次治疗期间仍需要住院。
治疗排序
CAR T 细胞和 BsAbs 的出现将为患者提供额外的治疗选择,但如何最好地将这些创新整合到患者的治疗中,目前尚不明确。一项已发表的随机研究证明,在既往接受过2-4线治疗的患者中,ide-cel优于标准方案,其他几项对照和间接治疗对照同样表明了ide-ce相对于标准治疗选择的获益。鉴于许多新兴疗法靶向相同的表位,而试验排除了接受过靶向这些表位治疗的患者,靶向相同分子的序贯疗法的作用尚不清楚。
CARTITUDE-2 队列 C 研究入组了既往三重暴露以及非细胞 BCMA 治疗的患者(n=20),ORR 为60%,中位 PFS 为9.1个月,均显著低于 CARTITUDE-1 的BCMA初治队列。总的来说,既往接受过 BCMA 靶向治疗的患者结局较差(中位 PFS 为3.2[既往BCMA] vs 9.0个月[既往未BCMA治疗];P=0.0002),表明 BCMA 靶向治疗的排序很重要。有趣的是,MajesTEC-1队列 C 研究(n=40) 入组了既往接受过 BCMA 治疗(ADC或CAR T)的患者,显示 teclistamab 的 ORR 为53%;中位随访11.8个月,71%最初获得缓解的患者仍维持其缓解;15例既往曾暴露于 CAR T 细胞的患者的 ORR 也为53%。对入组 elranatamab 临床试验且既往接受过 BCMA 治疗的队列进行汇总分析,结果显示 ORR 为46%(n=87),中位 PFS 为5.5个月;对于既往接受过 BCMA CAR T 细胞治疗的患者亚组,ORR为53%(n=36),中位 PFS 为10.0个月。BCMA BsAb治疗可作为 BCMA CAR T 细胞治疗后疾病进展患者的有效挽救治疗。
这些较低的缓解率/缓解持续时间是否反映了靶点特异性耐药机制(例如与 BCMA 表达相关)、T细胞适应性/耗竭,或仅反映了既往更多线治疗的疾病,仍有待确定。在此之前,关于这些 BCMA靶向的疗法的最佳测序存在实质性的不确定性。如前所述,GPRC5D和 FcRH5 靶向 CAR T 细胞和/或 BsAb 治疗在既往接受过 BCMA 靶向治疗的患者中显示出疗效,但同样需要研究最佳排序应涉及相同类别(例如BsAb转换为BsAb)还是转换类别(例如CAR T细胞转换为BsAb)
正面和反面
MM 专家面临的一个常见问题是,推荐哪个患者进行 BsAb 治疗、哪个患者进行 CAR T 细胞治疗?尽管许多患者应考虑多种因素,包括患者偏好、治疗可及性和疾病相关特征,但在治疗过程中的某个时间点可能会同时接受 CAR T 细胞和 BsAb 治疗。表5总结了市售产品和试验用产品的关键特征。CAR T 细胞治疗的一个关键优势在于允许缓解患者经历真正的无治疗间期,但随着探索CAR T 后的巩固/维持治疗的研究,该做法在未来可能会发生变化。同样,尽管目前正在以持续治疗直至疾病进展的方式研究大多数双特异性治疗,但确定固定周期或缓解引导的持续时间治疗是否可限制治疗强度也具有重要意义。
最近CAR T细胞研究(临床试验和真实世界研究)的一个共同主题在于患者在单采和 CAR T 细胞给药之间的脱落,部分原因是生产失败和疾病进展/临床衰退。因此,BsAb治疗相对于当前 CAR T 细胞治疗的一个关键优势在于其是现成的,允许立即开始治疗,并且对于疾病快速进展的患者具有明确的重要性。然而,CAR T细胞生产的创新,如将生产时间缩短至不到一周或使用现成的异基因产品,对于更及时地给予 CAR T 细胞至关重要。

如前所述,由于可及性和后勤问题,两类治疗的广泛使用均可能受到限制。目前市售 CAR T 细胞产品以及teclistamab前3个递增剂量给药均需要住院。CAR T 细胞治疗主要在移植中心进行,因此,社区肿瘤医生对 CAR T 细胞候选资格的偏倚或假设可能限制将潜在候选者转诊至 MM/CAR T 专家。尽管 teclistamab 的门诊给药可能更容易在社区输注中心完成,但初次住院的需求,以及培训识别/治疗 CRS/ICANS 的人员,仍可能是一个障碍。长期血细胞减少、低丙球蛋白血症和感染风险均是两类治疗的特性,需要强化支持性治疗措施以确保安全性。
最后,患者偏好仍然是指导患者接受最新治疗的重要考虑因素。最近的一项研究发现,大多数RRMM 患者优先考虑缓解率和总生存期,但给药途径和毒性特征仍是其他人的重要考虑因素,并可能为患者提供建议。目前缺乏关于 CAR T 细胞和 BsAb 治疗在少数的、缺医少药、老年或虚弱患者中的疗效和安全性数据,这对临床医生来说也是一个重大限制。
总之,MM领域还只是处于 CAR T 细胞和BsAb(以及其他 T 细胞重定向药物)治疗的起步阶段,但在既往结局不佳的患者人群中显然获得了前所未有的缓解率。CAR T 细胞和 T 细胞重定向治疗研究中新数据的快速出现率,使得综述文章几乎在发表时就已经过时。目前市售药物的批准状态是用于既往接受过4线或4线以上治疗的患者,并且大多数患者接受3线五药暴露/难治(许多患者在1-2线治疗后就已经为3重难治),获批适应症过于偏后线,使得患者在获得市售 CAR T 细胞和 BsAb 治疗方面存在重大治疗挑战。但根据KarMMa-3、CARTITUDE-4和正在进行的 III 期研究的结果,预计未来批准适应症可能会发生变化,在这些研究中,下一个挑战将是将这些药物纳入早期治疗线中。同样,随着非 BCMA 靶向药物的预期批准,将出现更多关于这些治疗的最佳排序和治疗范例变化的问题。联合BsAbs(即 RedirecTT-1研究中的teclistamab+ talquetamab)显著疗效的初步数据则提出了更多关于 BsAbs 最佳使用和排序的问题。无论未来在新的治疗选择方面带来什么,重要的是记录患者的经验,并积极努力确保公平获得所有创新治疗。
参考文献
1.Holstein SA, et al.Chimeric Antigen Receptor T-Cell and Bispecific Antibody Therapy in Multiple Myeloma: Moving Into the Future.J Clin Oncol . 2023 Jul 20;JCO2300512. doi: 10.1200/JCO.23.00512.
2.Lesokhin AM,et al.Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results.Nat Med . 2023 Aug 15. doi: 10.1038/s41591-023-02528-9.(根据本文更新了Elranatamab 的注册研究部分内容,这也符合文中那句话:综述文章几乎在发表时就已经过时)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











