Nat Chem Biol:云南大学陈庆锋等团队合作揭示ENaC/DEG超家族中神经肽失活通道的结构和机制
2023-08-11 iNature iNature 发表于上海
该研究展示了apo和FMRFamide结合状态下的Aplysia californica FaNaC的高分辨率冷冻电镜结构。
Phe-Met-Arg-Phe-amide(FMRFamide)激活的钠通道(FaNaCs)是由神经肽FMRFamide激活的一系列通道,迄今为止,潜在的配体门控机制仍然未知。
2023年8月7日,云南大学陈庆锋、天津大学田裕涛、叶升及北京大学张哲共同通讯在Nature Chemical Biology 在线发表题为“Structure and mechanism of a neuropeptideactivated channel in the ENaC/DEG superfamily”的研究论文,该研究展示了apo和FMRFamide结合状态下的Aplysia californica FaNaC的高分辨率冷冻电镜结构。
AcFaNaC形成一个杯状三聚体,并具有几个显著的特征,包括两个FaNaC特异性插入区域,一个明显的手指结构域和跨膜结构域(TMD)的非结构域交换跨膜螺旋。一个FMRFamide与位于细胞外结构域最顶部区域的间隙中的每个亚基结合,邻近亚基的残基参与其中。Bound FMRFamide采用扩展构象。FMRFamide紧密结合A.californica FaNaC N 结合方式,导致崩溃的绑定裂和诱发大局部构象重组。这种构象变化通过掌域向下向TMD传播,可能导致TMD向外移动和离子传导孔扩张。

神经肽广泛分布于无脊椎动物和脊椎动物体内,主要作为神经递质和神经调节剂。首先在软体动物中发现的FMRFamide,可以增强软体动物心肌的收缩力,诱导其他肌肉的延长收缩,使心律失常的心脏规律化,甚至诱导静止心脏的跳动。虽然FMRFamide仅存在于无脊椎动物中,但FMRFamide样肽(FLPs;以RFamide结尾的肽)存在于所有动物门中。从鸡脑中分离出的LPLRFamide代表了脊椎动物中报道的第一个FLP,而神经肽FF和神经肽AF是在哺乳动物中发现的第一个FLP,它们在体内给药时具有抗阿片活性。其他具有代表性的哺乳动物FLPs包括催乳素释放肽,它具有催乳素释放和疼痛调节活性,以及热谷氨酰化RFamide肽,它调节食物摄入、产热、脂肪生成和脂肪分解。
与大多数其他功能作用由G蛋白偶联受体介导的神经肽不同,FMRFamide可以直接结合并激活嗜离子受体(FMRFamide-activated sodium channels, FaNaCs)。事实上,肽激活的离子通道是罕见的。除了FaNaCs,其他已知类型的肽激活离子通道包括Hydra钠离子通道,它由神经肽Hydra-Rfamides I和II激活。FaNaCs和Hydra钠通道都属于上皮性钠通道/变性素(ENaC/DEG)阳离子通道超家族,其成员还包括酸感离子通道(ASICs)、ENaCs和DEG通道。
ENaC/DEG超家族通道可以形成同源或异源三聚体,如ASICs和ENaC的结构所示,其中大多数成员具有钠选择性。ENaC/DEG超族通道的激活与电压无关;相反,还涉及许多其他因素。一些是组成性开放的(ENaC),另一些是被低pH (ASICs)或机械力(DEG)激活的,这使得肽激活的FaNaCs在这个超家族中是不同的。肽激活似乎在ASICs中部分保留;虽然FMRFamide并不单独激活ASICs,但它可以显著增强低pH诱发电。
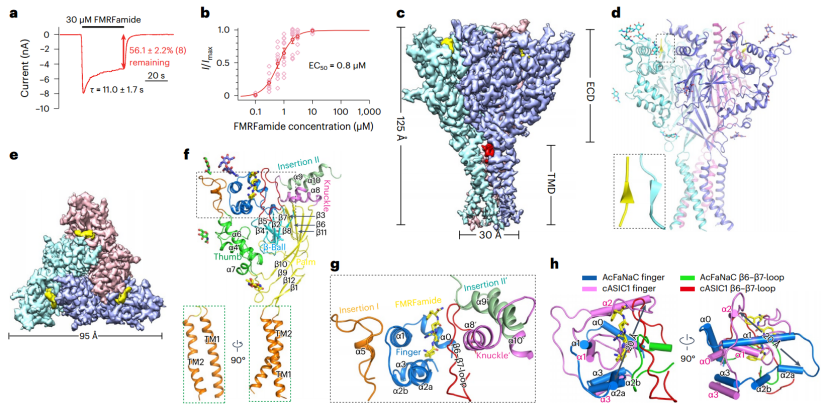
AcFaNaC的整体结构(图源自Nature Chemical Biology )
尽管序列相似性较低(~27%的同源性),但FaNaCs被认为采用与ASIC1相似的三聚体结构。然而,FaNaCs通常具有较长的氨基酸序列,有两个额外的区域称为特异性插入I和II。一些研究已经将FaNaCs中的配体结合位点映射到手指结构域的一个区域。特异性插入I和II也被认为在配体结合、门控或两者中发挥作用。
为了揭示配体特异性和门控的分子机制,作者测定了来自Aplysia californica (AcFaNaC)在载脂蛋白和FMRFamide结合状态下的结构。结合定点诱变、电生理学和分子动力学(MD)模拟,该研究为深入了解FaNaCs的结构和功能提供了重要的见解,并为基于FaNaCs的合成光遗传工具的合理设计铺平了道路,这在神经科学研究中可能具有潜在的应用前景。
原文链接:
https://www.nature.com/articles/s41589-023-01401-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言