文献学习:病毒性呼吸道病原体感染机制
2022-07-04 李姝 河南省沁阳市人民医院 “检验医学”公众号
流感病毒、冠状病毒和呼吸道合胞病毒在冬季出现感染高峰,全年均可检测到腺病毒、博卡病毒、副流感病毒、偏肺病毒和鼻病毒。副流感病毒的季节性模式可以是特定类型的,1型和3型分别在秋季和春夏季达到高峰。
急性呼吸道感染是一个主要的公共卫生问题,也是全世界发病率和死亡率的主要原因,尤其是在儿童、老年人和免疫功能低下的人群中。RNA病毒是主要病原体,常见病原体包括呼吸道合胞病毒、流感病毒、副流感病毒、偏肺病毒、鼻病毒、肠道病毒和冠状病毒。引起呼吸道受累的DNA病毒包括腺病毒、博卡病毒,重新激活免疫抑制患者的病原体,例如单纯疱疹病毒、巨细胞病毒和Epstein-Barr病毒。
呼吸道感染通常表现出季节性,通常发生在深秋、冬季和早春。原因包括:寒冷季节的拥挤程度增加、较低的温度和较高的湿度增加了体外病毒粒子的稳定性,以及寒冷,这可能会增加宿主易感性和由于阳光照射减少导致的维生素D缺乏。
流感病毒、冠状病毒和呼吸道合胞病毒在冬季出现感染高峰,全年均可检测到腺病毒、博卡病毒、副流感病毒、偏肺病毒和鼻病毒。副流感病毒的季节性模式可以是特定类型的,1型和3型分别在秋季和春夏季达到高峰。一些肠道病毒的流行在夏季增加。
临床表现
这些不同病毒引起的疾病从自限性上呼吸道感染(如感冒、喉咙痛或气管支气管炎)到危及生命的下呼吸道感染(如细支气管炎、肺炎或急性呼吸窘迫综合征)不等,以及偶尔播散的疾病。
下呼吸道的受累可能是三种机制之一:(i)直接感染肺细胞而没有在上呼吸道持续的病毒学复制(流感病毒,其特征在于对唾液酸的优先趋向性)更深的气道(ii)从涉及上呼吸道的病毒感染(例如冠状病毒)以连续方式传播,以及(iii)血行传播(例如,巨细胞病毒)。
每种感染的严重程度,以及从上呼吸道到下呼吸道的进展取决于引起病毒的内在毒力、合并感染以及与患者相关的因素,例如年龄、潜在疾病(即并发的呼吸道和心血管疾病)或免疫缺陷程度。
病毒性呼吸道感染是幼儿和老年人的主要杀手。此外,在发展中国家,儿童的死亡率可能比发达地区高出五倍。呼吸道合胞病毒等主要影响幼儿,引起鼻炎、喉炎或鼻窦炎,新生儿有患细支气管炎和肺炎的风险。另一方面,流感病毒每年平均造成23,607例与流感相关的死亡,其中90%发生在65岁或以上的人群中。
免疫功能低下的患者呼吸道病毒的获得频率与免疫功能正常的个体相同,但与感染时间延长、下呼吸道感染进展增加和死亡率升高有关。
与细菌性肺炎或其他肺部疾病相比,诊断病毒性肺炎的没有特征性线索。与细菌性肺炎相比,病毒性肺炎起病缓慢,伴随上呼吸道感染的临床表现,流感样症状、皮疹或胃肠道症状、无脓痰、心动过速或呼吸急促与体温不成比例、肺部检查缺乏特异性。
在鉴别诊断中应考虑免疫介导的间质性肺疾病(肺纤维化、结节病和高反应性气道疾病)、肺血管疾病(肺栓塞和肺动脉高压)和充血性心力衰竭。实验室检测与影像学相结合可以显着提高对病毒性肺炎的诊断。
影像学表现和实验室标记物
胸部X线是诊断下呼吸道感染最广泛使用的影像技术,其次是计算机断层扫描(CT)。胸片可以确定肺炎的存在,其范围和位置,并评估对治疗的反应,它还可以诊断胸腔积液或气胸等并发症。
由于细菌性肺炎和病毒性肺炎之间的胸部X线检查结果存在大量重叠,因此没有鉴别的特异性。提示细菌性肺炎的特征包括:肺泡浸润伴肺叶实变和合并胸腔积液。提示病毒性肺炎的特征包括:呈斑片状分布的双侧间质浸润。
血液学和生化测试可能有助于临床,识别其他器官的损伤、受影响患者的预后以及监测病程。不过,外周血诊断结果没有特异性,可能导致白细胞计数升高、正常或降低。然而,与细菌性肺炎相比,病毒感染与白细胞计数升高的相关性较低。
例如,在SARS-CoV-2感染的情况下,淋巴细胞减少与更严重的结果相关。一个相关标志物是中性粒细胞/淋巴细胞比率(NLR),虽然不是特异性的,但在严重的病毒性肺炎中通常会增加,并且最近被提议作为COVID-19患者的早期风险分层标志物。
动脉血气参数(即pO 2、pCO 2、pH、乳酸和碳酸氢盐)对于肺炎患者的持续监测至关重要。
呼吸道病毒及其组织损伤的直接机制
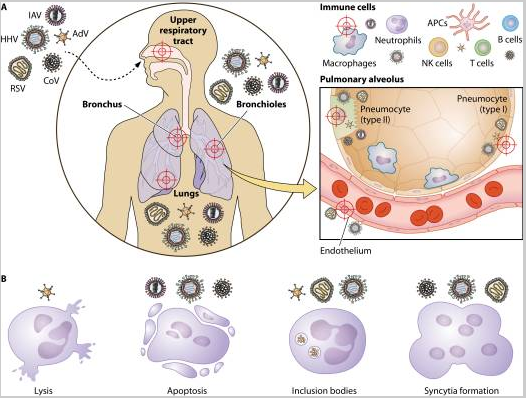
图 呼吸道病毒及其组织损伤的直接机制
(A)病毒感染的目标。由正粘病毒(例如甲型流感病毒 [IAV])、疱疹病毒 (HHV)、腺病毒 (AdV)、副粘病毒(例如呼吸道合胞病毒 [RSV])和冠状病毒 (CoV) 引起的病毒感染通常会影响上呼吸道和下呼吸道。因此,它们都可能导致肺炎,感染可能导致细支气管炎。RSV 是 1 岁以下儿童毛细支气管炎和肺炎的最常见原因。以肺泡为中心,CoV和IAV直接感染II型肺细胞,RSV、AdV和HHV同时感染I型和II型细胞。RSV和HHV靶向内皮细胞。另一方面,免疫细胞招募到感染部位,如巨噬细胞、中性粒细胞、T 细胞、NK 细胞、B 细胞和抗原呈递细胞 (APC) 可以被 AdV、CoV、IAV 和 HHV 感染。
(B)组织损伤的直接机制。感染后,病毒会改变细胞稳态,导致不同类型的损伤或改变。AdV负责直接裂解受感染的细胞,而IAV、CoV和HHV则诱导其靶细胞凋亡。包涵体是AdV、RSV和HHV感染的结果,并且已经描述了由RSV、CoV和HHV感染的细胞形成合胞体。和HHV诱导其靶细胞凋亡。
免疫系统在肺损伤中的作用
免疫反应,包括白细胞的迁移以及细胞因子和趋化因子的释放,对于病毒清除和恢复体内平衡至关重要,但通常也导致疾病并发症和组织损伤,这些并发症和组织损伤可能会在疾病期间长期存在。这种免疫病理学效应源于(i)炎症细胞浸润增加,(ii)细胞活性增强导致分泌的细胞因子和趋化因子水平升高,和/或(iii)错误的反馈调节
呼吸道病毒感染或“细胞因子风暴”期间不受控制的炎症是造成广泛肺损伤和严重免疫病理学的原因。细胞因子风暴(也称为“细胞因子释放综合征”)是由免疫细胞和细胞因子(如TNF-α、IL-6、IL-1、IL-12、IFN-α/β)相互作用引起的过度免疫反应、IFN-γ、MCP-1和IL-8,其特征是细胞因子和趋化因子水平的全身性升高。
感染多种呼吸道病毒(如IAV、RSV、SARS-CoV和SARS-CoV-2)会导致中性粒细胞和炎性单核细胞浸润失调,并增加细胞因子的产生,从而破坏组织完整性。中性粒细胞、炎性巨噬细胞和其他过度活化的免疫细胞可以通过产生细胞毒性自由基、活性氮和氧、蛋白酶和促纤维化介质来进一步传播结构性组织损伤,从而改变和损伤肺上皮。性别也可能是决定呼吸道病毒感染期间细胞因子反应和临床结果的潜在因素。
不受管制的炎症细胞死亡会引起过度的组织炎症和器官衰竭。组织驻留的肺泡巨噬细胞和募集的单核巨噬细胞发生焦亡,通过过量产生IL-6、TNF-α和IL-1β促进中性粒细胞浸润和强烈的细胞因子风暴,从而加剧肺部炎症。
IAV感染以I 型IFN 和RIG-I 依赖性方式激活NLRP3炎性体,从而诱导肺上皮细胞焦亡。SARS-CoV-2诱导的炎症小体和细胞焦亡会加剧呼吸窘迫和发烧。急性COVID-19发病机制也会影响血液凝固,这通常会导致肺部血栓形成(例如,肺栓塞)。
继发性细菌感染或“二次感染”是急性呼吸道病毒感染期间相当常见的临床并发症,是患者死亡的主要原因。病毒感染,如IAV感染,以及现在的SARS-CoV-2感染,使宿主更容易受到金黄色葡萄球菌、肺炎链球菌、铜绿假单胞菌或大肠杆菌细菌合并感染的影响。
病毒感染肺部的易感性受到多种因素的调节,例如气道上皮损伤增加和再生延迟、抗菌信号传导和细胞因子的抑制、免疫细胞耗竭以及导致免疫反应不适当或不足的肺细胞活化改变或降低防御能力。
在呼吸道病毒感染期间启动的抗病毒IFN反应在病毒控制和清除中非常重要。然而,长期暴露于IFN会损害肺部健康,从而大大增加宿主对继发性共感染的脆弱性。已经证明,缺乏I型IFN信号传导的小鼠可以在流感感染后有效清除继发性肺炎链球菌感染。
IAV和结核分枝杆菌的合并感染也会以I型IFN依赖性方式增加细菌性疾病的严重程度。此外,I型IFN可以通过阻断IL-1来抑制炎症反应,诱导IL-10的产生,并在病毒感染期间抑制组织驻留的淋巴细胞,例如γδT 细胞。
病毒感染通常会扰乱气道的结构和功能,宿主免疫反应会加剧这种情况。通常,感染消退后会恢复稳态,但在许多情况下,这取决于病毒的致病性、感染的范围和传播以及炎症反应的程度。
冠状病毒、鼻病毒和腺病毒的常见毒株通常表现为没有基础疾病的患者的轻度至中度上呼吸道感染。在严重的情况下,这些感染会增加渗出和水肿,增加上皮细胞死亡和粘液分泌过多,导致鼻塞、打喷嚏和咳嗽。更严重的病毒感染,例如儿童的流感、COVID-19、SARS、MERS和RSV感染,从上呼吸道传播到下呼吸道,如果不受控制,它们可以从支气管和细支气管传播到肺泡。
细胞变化(例如,RSV感染中上皮细胞的脱屑和纤毛的丧失,以及IAV感染中的上皮细胞增生)和下呼吸道炎症的增加由于呼吸功能受损而导致严重的疾病发病机制。病毒性支气管炎和细支气管炎的特征是气流受限和肺部水肿和粘液增加、血管充血和组织肿胀导致的气体交换效率低下。
在严重的情况下,呼吸和呼吸功能可能会受到影响,患者可能需要机器支持。肺炎是由到达肺泡并破坏肺功能稳定的病毒引起的。在危急情况下,肺泡腔内的液体积聚和坏死,以及表面张力和肺弹性的丧失,可导致急性呼吸窘迫综合征和呼吸衰竭。
ARDS是SARS和MERS感染危重患者的临床标志,并且在SARS-CoV-2感染中也出现了同样的情况。ARDS由“细胞因子风暴”驱动,导致广泛的炎症和肺损伤,在严重、高危的COVID-19病例中会导致多器官衰竭,甚至死亡。
肺部的病毒感染可引起广泛的炎症驱动损伤,但通常,在有效清除病毒后,肺部能够恢复其原始肺部结构。然而,炎症或再生途径的异常会对肺的结构和细胞构成产生不利影响,导致纤维化、肺气肿、支气管扩张和肺膨出。
呼吸道病毒通过胶原蛋白和纤连蛋白沉积改变肺的基质组成,这通常会导致疤痕组织形成。这些呼吸道病毒通过诱导相关因子、血管生成和成纤维细胞增殖来影响重塑,小鼠模型感染RSV,随后进行过敏原攻击,表现出以胶原合成增加和支气管基底膜增厚为特征的气道重塑,这是由RSV驱动的成纤维细胞生长因子2(FGF-2) 介导的。肺 ILC2主要在感染期间具有保护功能,但会因病毒或持续的I型IFN信号传导而失调,导致过敏性炎症反应和哮喘恶化。
文献读后感
近期实验室开始呼吸道6项检测,发现夏季临床上儿科患者呼吸道病毒感染比率依然不低,参阅其他实验室的全年数据,人鼻病毒排在第一位,腺病毒第二位,但是实验室工作人员对于所引起的临床症状知之甚少,查阅文献了解其机制,才能更好的服务患者服务临床。
参考文献:
NicolaClementiet al。ViralRespiratory Pathogens and Lung Injury。ClinMicrobiol Rev. 2021Jul; 34(3): e00103-20.Published online 2021 Mar31. doi: 10.1128/CMR.00103-20。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#病毒性#
101
👍
0
#呼吸道#
100
#病原体#
76