上海硅酸盐所陈航榕《AFM》: 突破性水凝胶技术——超声辅助肿瘤免疫疗法新策略
2024-01-08 BioMed科技 BioMed科技 发表于上海
这项工作提供了一种超声介导的类生态输送平台的新策略,为局部癌症治疗提供了高效和生物安全性。
恶性实体肿瘤具有密集的细胞外基质(ECM)和免疫抑制微环境(IME)的特点,严重限制了肿瘤的高效和精确治疗,导致恶性复发和转移的易感性增加。在此,中科院上海硅酸盐研究所陈航榕开发了一种基于“声遗传学技术”的超声介导的水凝胶输送平台HA-F127@Ti-MOF-Au/PEG-TK-DOX/PFD(缩写为HFTiDP),该平台封装了声敏剂(Ti-MOF-Au)、化疗前药(PEG-TK-DOX)和ECM溶解药物pirfenidone(PFD),以实现高组织穿透和内源性细胞内IME调控。更重要的是,外源性超声刺激结合水凝胶输送平台可以影响药物耐药相关基因/蛋白质表达,并影响信号转导途径在免疫微环境中的作用,从而促进肿瘤相关抗原(TAAs)的释放以激活免疫,实现胰腺癌或三阴性乳腺癌(TNBC)的高效治疗,并显著抑制肺转移和脾肿大。总体而言,这项工作提供了一种超声介导的类生态输送平台的新策略,为局部癌症治疗提供了高效和生物安全性。该研究题为“Injectable Responsive Hydrogel Delivery Platform: Enabling High Tissue Penetration and Sonogenetic-Like Potentiating Anti-Tumor Immunotherapy”发表在《Advanced Functional Materials》。

受到声动力疗法(SDT)诱导的内在免疫反应和声遗传学技术的启发,本文开发了一种“声遗传学类似技术”,通过结合超声效应和纳米输送系统来调节免疫微环境中特定蛋白质/基因表达,并影响信号转导途径。建立了两种典型的恶性肿瘤模型,证实了外源性超声操纵有利于协同减少肿瘤细胞中的P-gp/TP53表达,并触发线粒体介导的凋亡途径,促进肿瘤相关抗原(TAAs)的释放以激活免疫,并显著抑制肺转移和脾肿大,极大地提高了协同抗肿瘤免疫疗法的效率。这项工作为有效治疗恶性肿瘤,如胰腺癌和TNBC,提供了一种普遍的新策略,具有重要的临床研究价值和科学意义。
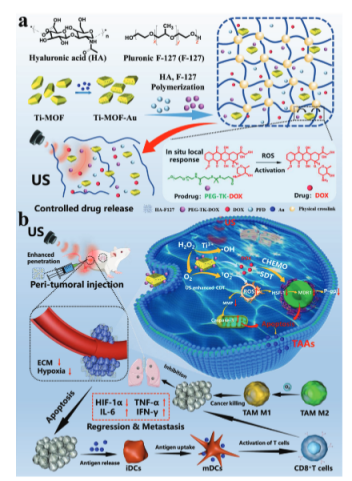
方案1.壁龛状水凝胶的构建及其治疗机制示意图
【Ti-MOF-Au的合成与表征】
该研究开发一种新型的声敏剂,用于增强声动力疗法(SDT)的效果。首先,按照之前报道的协议合成了Ti-MOF纳米颗粒。然后,通过NaBH4还原方法在Ti-MOF溶液中引入HAuCl4.4H2O,使金纳米颗粒在Ti-MOF表面原位生长,从而合成了Ti-MOF-Au纳米复合材料。通过多种表征技术,证明了Ti-MOF-Au纳米复合材料成功合成。Ti-MOF-Au具有较低的带隙,有利于电子和空穴的分离,从而在SDT过程中产生更多的ROS。此外,Ti-MOF-Au中存在氧空位,这有助于增强其在超声刺激下的ROS生成能力,从而提高SDT的疗效。这些结果为后续的研究和应用提供了基础,证明了Ti-MOF-Au作为一种有效的声敏剂在超声介导的SDT中具有潜力。

图 1. Ti-MOF-Au的合成与表征
【Ti-MOF-Au的价态和空位表征】
接下来,分析Ti-MOF-Au的化学组成和状态,特别是其价态和氧空位的特性。结果表明,Ti-MOF-Au中存在更多的氧空位,这与其较低的带隙和较高的ROS生成能力有关。EPR和PL光谱的分析进一步证实了Ti-MOF-Au中氧空位的存在,并且这些氧空位有助于增强其在SDT过程中的ROS生成。此外,通过在H2O2存在下观察Ti-MOF-Au的氧气生成能力,以评估其作为SDT过程中的催化剂样酶的活性。得出的结论是:Ti-MOF-Au在H2O2存在下能够有效地产生氧气,显示出其在SDT中的催化活性。Ti-MOF-Au在超声刺激下能够产生大量的1O2和·OH,这表明它在SDT中具有高效的ROS生成能力。这些结果表明Ti-MOF-Au可以作为一种有效的声敏剂应用于超声介导的SDT,为后续的肿瘤治疗研究提供了新的材料选择。
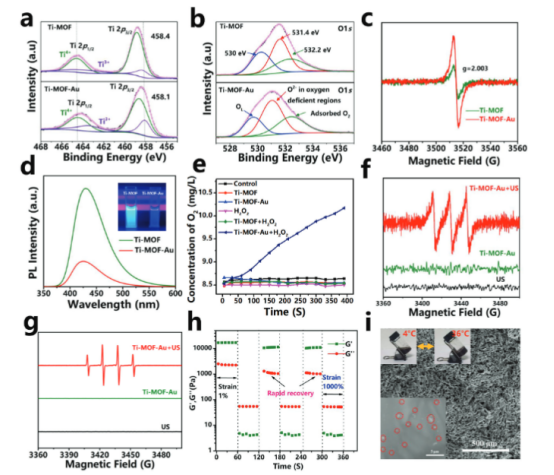
图 2. Ti-MOF-Au的价态和空位表征
【体外细胞毒性和细胞凋亡评估】
该研究评估了Ti-MOF-Au及其复合水凝胶在体外对肿瘤细胞的毒性和诱导细胞凋亡的能力。结果表明, Ti-MOF-Au能够有效地被PANC02细胞摄取,表明其在细胞内具有良好的分布。
HA-F127、HA-F127@Ti-MOF和HA-F127@Ti-MOF-Au水凝胶在体外对BALB/3T3和PANC02细胞显示出良好的生物相容性,没有显著的细胞毒性。此外,Ti-MOF-Au及其复合水凝胶在超声刺激下能够有效地诱导PANC02细胞凋亡,这表明它们在体外具有潜在的抗肿瘤活性。这些结果为Ti-MOF-Au及其复合水凝胶在肿瘤治疗中的潜在应用提供了实验支持,并为进一步的体内研究奠定了基础。
此外,该研究评估不同材料(特别是Ti-MOF-Au)在模拟肿瘤微环境中的渗透能力。首先构建了3D PANC02和4T1细胞球体,以模拟实体肿瘤的微环境。将Ti-MOF-Au与荧光素标记的FITC结合,然后与PANC02和4T1细胞球体共孵育,观察材料在细胞球体中的渗透情况。结果表明:Ti-MOF-Au在没有超声刺激或PFD的情况下,对PANC02和4T1细胞球体的渗透能力有限。当结合超声刺激和PFD时,Ti-MOF-Au能够有效地深入渗透到细胞球体的中心区域,表明超声和PFD的联合作用增强了材料的渗透能力。这些结果表明,Ti-MOF-Au在超声刺激和PFD的辅助下,具有改善肿瘤治疗药物递送的潜力,能够更有效地到达肿瘤深处。
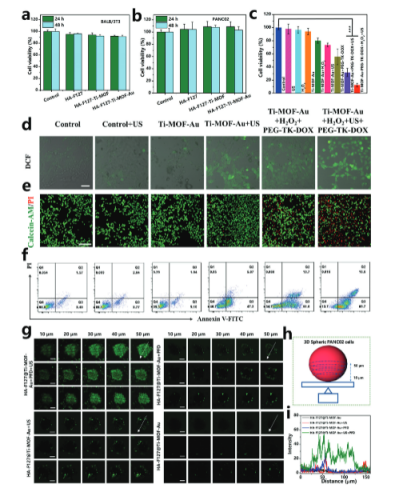
图 3. 体外细胞毒性和细胞凋亡评估
【计算机断层扫描(CT)图像,评估体内肿瘤硬度和穿透性】
接下来,该研究评估超声介导的Ti-MOF-Au在体内对肿瘤硬度的影响以及其在肿瘤中的渗透能力。结果表明,超声刺激和PFD的联合应用显著降低了肿瘤的硬度,这有助于药物的深层渗透和肿瘤细胞的摄取。 Ti-MOF-Au在超声和PFD的共同作用下能够有效地渗透到肿瘤组织中,这表明超声和PFD联合使用可以增强Ti-MOF-Au在肿瘤中的分布和渗透。
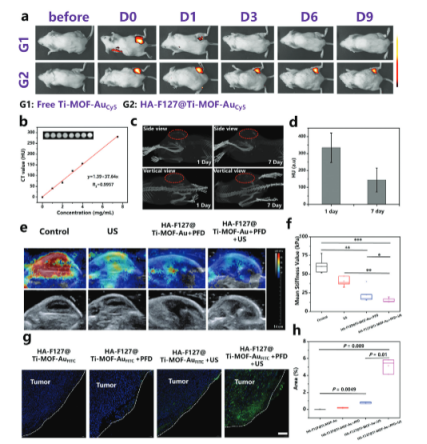
图4. 计算机断层扫描(CT)图像,评估体内肿瘤硬度和穿透性
【PANC02肿瘤小鼠体内抗肿瘤性能】
该研究评估超了声介导的Ti-MOF-Au复合水凝胶在体内对PANC02肿瘤的抗肿瘤效果。结果表明,超声介导的Ti-MOF-Au复合水凝胶在体内显著抑制了PANC02肿瘤的生长,并且这种抑制效果随着超声刺激和PFD药物的加入而增强。组织学分析显示,治疗组中的肿瘤细胞凋亡增加,增殖减少,并且免疫细胞的浸润也有所增加,这表明治疗不仅抑制了肿瘤生长,还可能激活了抗肿瘤免疫反应。此外,小鼠体重的稳定增长和主要器官未观察到明显毒性,表明治疗具有良好的生物安全性。这些结果表明,超声介导的Ti-MOF-Au复合水凝胶在PANC02肿瘤治疗中具有潜力,能够实现有效的抗肿瘤效果并保持治疗的安全性。
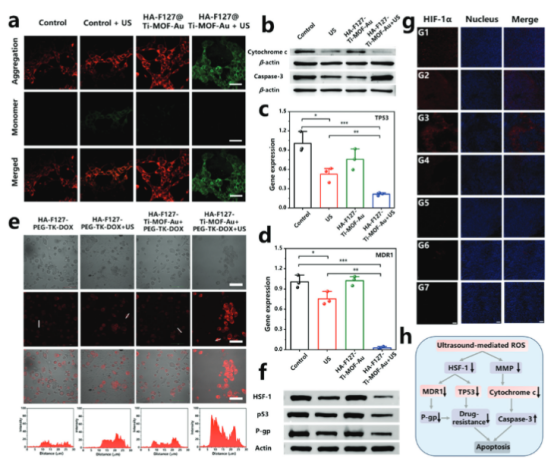
图 5. PANC02肿瘤小鼠体内抗肿瘤性能
【基于Ti-MOF-Au的US介导的ROS生成对细胞耐药性的影响】
为了探究基于Ti-MOF-Au的超声介导ROS生成对细胞药物耐药性的影响。研究人员通过流式细胞术观察了超声刺激下Ti-MOF-Au处理的细胞中线粒体膜电位(MMP)的变化,以评估细胞凋亡的早期生物变化。接着,通过Western blot分析了细胞中Cytochrome c和Caspase-3蛋白的表达水平,以进一步评估细胞凋亡途径。结果表明,超声介导的Ti-MOF-Au处理能够有效地降低细胞的MMP,激活Caspase-3蛋白表达,从而促进细胞凋亡。此外,超声刺激结合Ti-MOF-Au显著降低了TP53和MDR1基因的表达,以及HSF-1、突变p53和P-gp蛋白的水平,表明超声介导的ROS生成能够有效地抑制药物耐药性的表达。同时,超声处理增强了DOX的细胞摄取,这可能有助于克服化疗耐药性。这些结果表明,基于Ti-MOF-Au的超声介导ROS生成策略在克服肿瘤细胞药物耐药性方面具有潜力,为肿瘤治疗提供了新的策略。
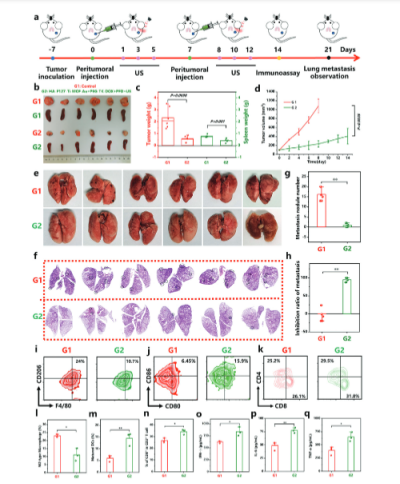
图6. 基于Ti-MOF-Au的US介导的ROS生成对细胞耐药性的影响
【小结】
该研究开发了一种创新的可注射的水凝胶HA-F127,内部共载有Ti-MOF-Au、PEG-TK-DOX和PFD。这种水凝胶能够在肿瘤区域内实现长期药物滞留,更重要的是,当与超声结合时,能够促进纳米药物深入肿瘤,产生包括声动力疗法(SDT)、药物耐药性减弱、免疫系统激活和原位化疗在内的协同效应。具体来说,由于超声效应和PFD对ECM的溶解作用,水凝胶上的载药能够穿透肿瘤基质屏障,深入肿瘤部位。此外,化疗前药PEG-TK-DOX对内源性ROS有响应,导致有毒DOX的释放,以杀死肿瘤细胞。更重要的是,声敏剂Ti-MOF-Au表现出超声响应性和类过氧化氢酶性质,能够生成ROS和O2,这不仅有效缓解了缺氧并诱导凋亡,还重编程了免疫微环境,导致抗肿瘤效应和抑制肿瘤转移和脾肿大。在胰腺癌和三阴性乳腺癌(TNBC)模型中建立的两种典型恶性肿瘤模型表明,内源性物质和外源性超声的协同作用不仅有效地减少了药物耐药并触发了线粒体介导的凋亡途径以抑制肿瘤生长,还激活了免疫系统并预防了肺转移。值得一提的是,基于Ti-MOF-Au的超声效应能够有效调节P-gp/TP53表达,展现出“声遗传学”的特点,这对于超声介导的肿瘤治疗具有重要意义。总的来说,这种智能响应性水凝胶药物输送平台,结合超声介导的协同治疗策略,在治疗耐药和易于转移的恶性肿瘤,如胰腺癌和TNBC方面,展现出巨大的潜力和应用前景。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202313723
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肿瘤免疫疗法# #超声辅助#
374