Nature:诺奖得主最新研究聚焦“脑肠轴”,发现内脏痛和焦虑的肠道驱动神经机制
2023-04-15 brainnew神内神外 网络 发表于上海
这种综合行为状态是内脏失调的一种特别敏感的表征,突出了肠-脑轴在神经胃肠病中的重要性。
胃肠道(GI)不适是大多数肠道疾病的标志。肠道嗜铬细胞(EC)是一种与GI疾病相关的细胞类型。在肠易激综合征(IBS)和其他炎症或炎症后GI疾病中,EC细胞和粘膜传入神经是内脏疼痛和焦虑的重要诱发因素。
近日,Holly A. Ingraham,Stuart M. Beierley和David Julius(2021年诺奖得主)团队通过使用小鼠模型来评估EC细胞在内脏疼痛和随之而来的性别差异中的参与情况。他们的成果发表在最新一起的Nature杂志上,名为“Gut enterochromaffin cells drive visceral pain and anxiety”。

作者发现,EC细胞在肠道超敏反应中起到了促进作用,且具有性别二态性。在雌性小鼠中,EC细胞的基础神经元活动明显更高,这表明神经元活动增强,但同时更少的细胞对刺激敏感。研究人员还发现,使用破伤风毒素(TeNT)抑制突触小泡融合和可兴奋细胞释放神经递质的能力,可以有效地抑制EC细胞的功能。这项研究的发现对于深入了解内脏疼痛和焦虑的机制以及发展新的治疗方法具有重要意义。
EC细胞促进肠道超敏反应
将ISV(isovalerate)应用于NaV1.8-ChR2雄性小鼠的离体神经-肠道制剂可提高粘膜传入对光的敏感性(图1a、b)。结果表明,ISV 介导的致敏作用并不特定于EC细胞或感觉神经元的机械刺激,而是更广泛地增强该回路的兴奋性,且存在性别差异。女性腰骶神经节的基础神经元活动明显更高(图1e-h)。男性中,6.5%的神经元被结肠内ISV激活,女性中,更少的细胞(2.2%)对ISV敏感(图1e-i)。
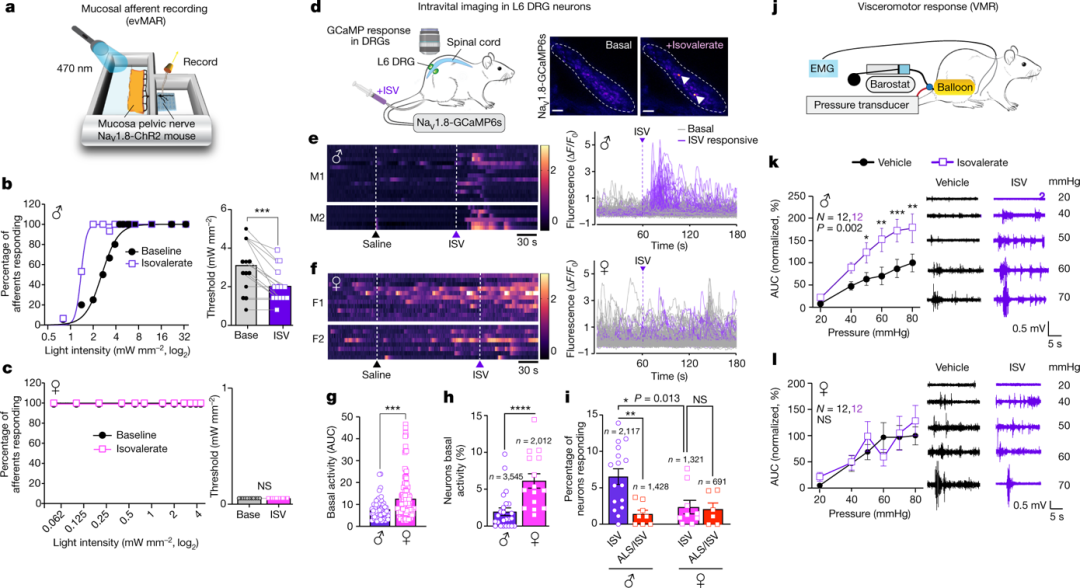
图1. EC细胞通过血清素信号介导对刺激物的性别依赖性反应。
作者研究了IS的致敏作用是否由EC细胞特异性介导,利用破伤风毒素(TeNT)抑制突触小泡融合和可兴奋细胞释放神经递质的能力。在肠道中,Pet1Flp,Tac1Cre系选择性地靶向EC细胞(图2b)。
为了验证TeNT表达的功能效应,作者使用ECPFTtox测量了刺激诱发的血清素释放。与TacCre对照类器官相比,ECPFTox血清素释放显著减少(约30%)。ECPFTox小鼠血清中的递质水平同样降低(图2c),反映了EC细胞作为外周血清素主要来源的作用。
作者进一步证实了ISV的致敏作用是通过EC细胞介导的。与对照相比,雌性ECPFTox小鼠的基线VMR 减少(图2e、f)。同时,结肠内ISV对雄性扩张诱发的VMR的强烈敏化作用被消除(图2g)。这些结果表明EC细胞对内脏伤害感受有很大贡献。沉默EC细胞对雄性的影响更大,而雄性则表现出更大的ISV诱发致敏作用。
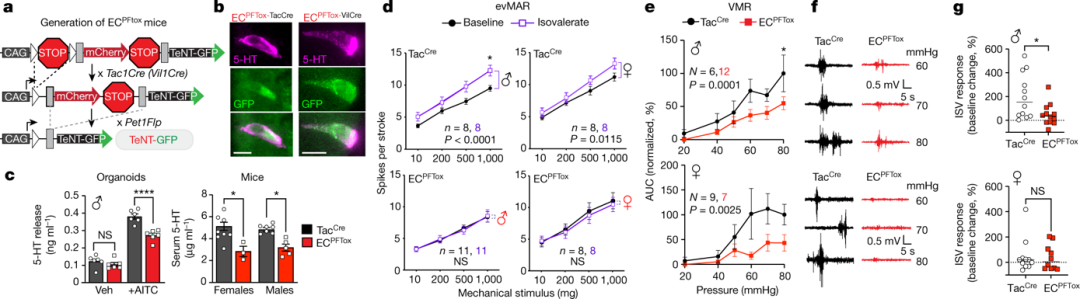 图2.沉默EC细胞可减弱结肠对刺激物和机械扩张的敏感性。
图2.沉默EC细胞可减弱结肠对刺激物和机械扩张的敏感性。
性别依赖性内脏超敏反应
作者接下来调查了EC细胞激活是否足以产生内脏超敏反应(图3a-c)。将DREADD激动剂应用于源自这EChM3Dq(DREADD受体)小鼠的肠道类器官可促进EC细胞活化和血清素释放(图3c)。
DREADD激动剂使EChM3Dq动物的纤维对粘膜机械刺激过敏,而不影响对照组的纤维(图3d),且这种敏化在雄性中更为明显。这些性别差异支持了EC细胞粘膜传入回路对女性结肠敏感性有更大的影响。
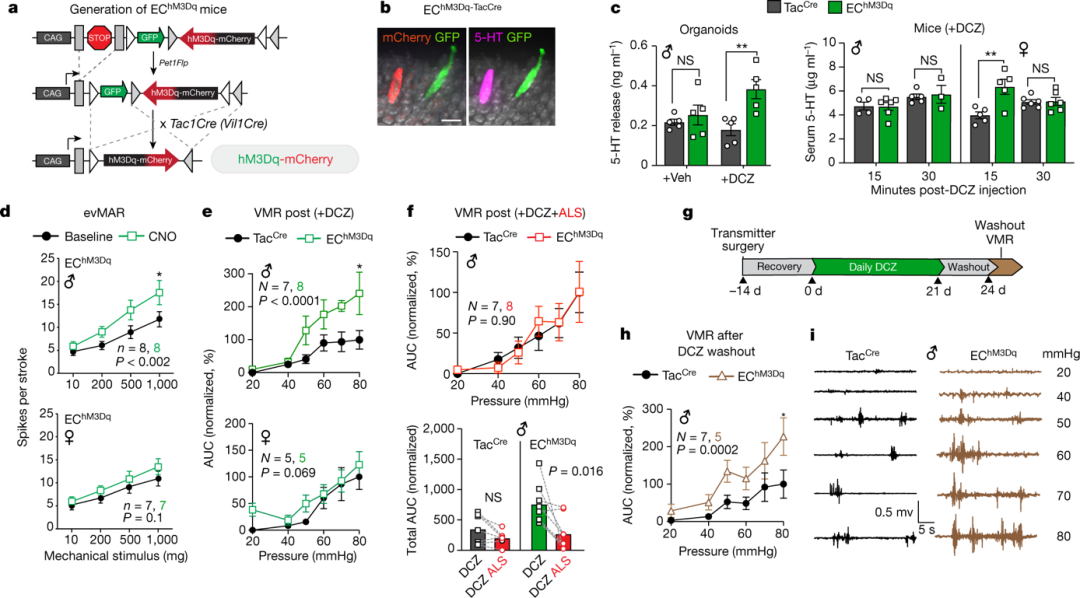 图3. 激活EC细胞会增加男性的传入输出并诱发长期超敏反应。
图3. 激活EC细胞会增加男性的传入输出并诱发长期超敏反应。
长时间的激活能否产生类似于在IBS中观察到的持续敏化?结果表明,EChM3Dq动物保持更高的敏感性,表明EC细胞激活足以驱动急性和持续性内脏痛(图3h,i)。
粘膜纤维传递EC细胞信号
人们普遍认为,具有低和高阈值(LT和HT)膨胀的神经纤维会驱动内脏痛。作者调查了除了支配粘膜的纤维之外的纤维是否受到EC细胞激活的影响。
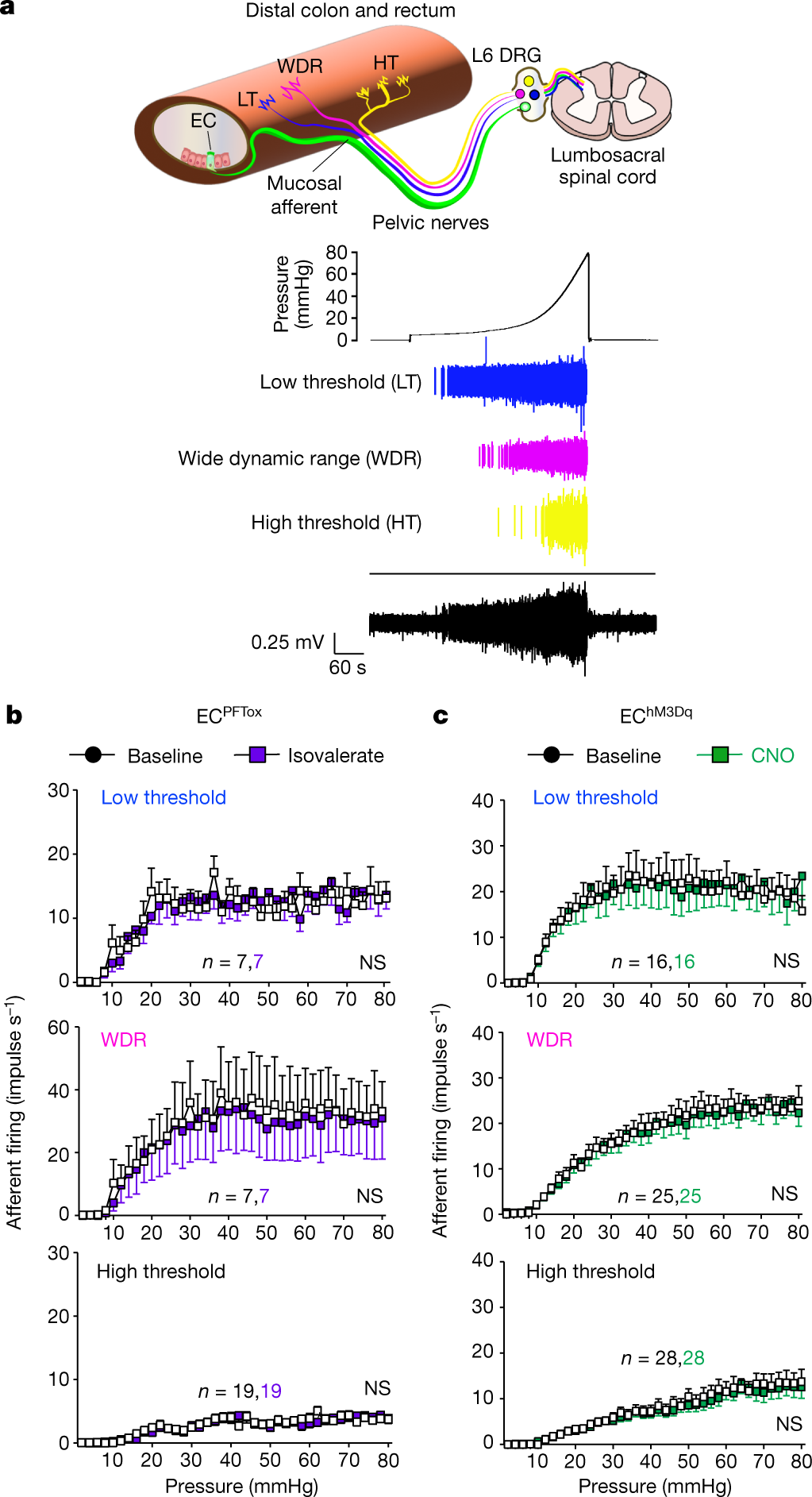
图4. EC细胞不调节对扩张敏感的传入神经。
在对照小鼠中,ISV的使用未能增强支配非粘膜层的扩张敏感传入神经的激活。ECPFTox小鼠的制剂对CRD的VMR减少,在ISV治疗之前或之后表现出正常的扩张敏感神经纤维激活(图4b)。EChM3Dq 小鼠的制剂也是如此,其中CNO 处理对扩张敏感纤维没有影响(图4c)。
这些结果表明,内脏痛的调节是由对扩张不敏感的粘膜传入神经驱动的,这些传入神经对局部组织变形有反应,并直接与粘膜层中的EC细胞相互作用。
EC细胞活动调节焦虑
通过评估标准高架十字迷宫(EPM)范式中的行为来了解EC细胞的慢性激活或抑制是否会影响焦虑状态。用DCZ治疗的幼稚EChM3Dq动物在张开手臂中花费的时间较少,表明焦虑增加。重要的是,ALS的共同给药逆转了DCZ的作用(图5a)。
综上所述,这些结果支持5-羟色胺能EC细胞-粘膜传入信号在调节肠-脑交流紊乱的伤害感受和情感成分中的作用。有趣的是,ECPFTox动物张开双臂的时间也更少(图5b),这表明通过长期抑制EC细胞活性来扰乱GI功能同样会引起焦虑。
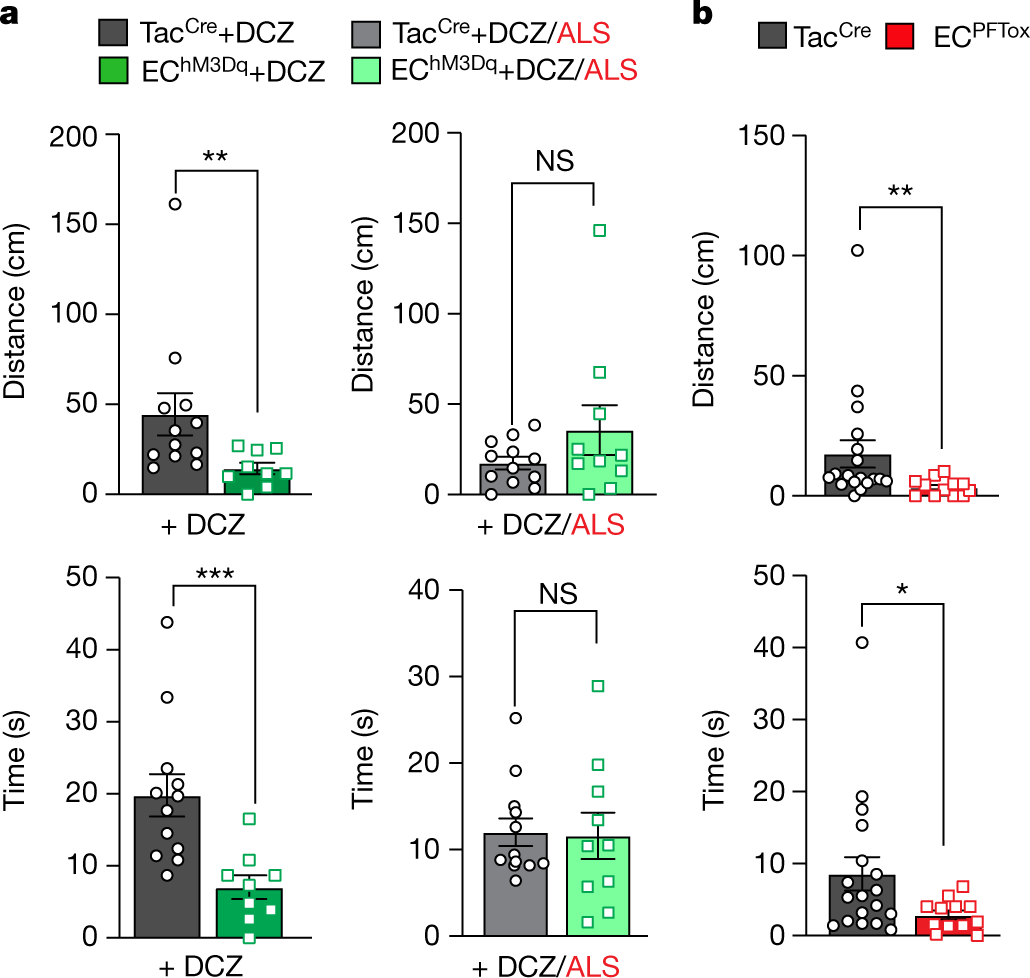
图5. 操纵EC细胞-粘膜传入活动会诱发焦虑样行为。
结 论
功能性胃肠道疾病在女性中尤为普遍。作者推测EC细胞-粘膜传入信号对雌性和雄性小鼠的内脏痛有不同的影响。增强的EC细胞传入回路可能使女性更易患内脏痛。识别EC细胞中性别特异性的分子和功能差异,有助于我们了解内脏疼痛综合征中性别差异的机制。
功能性胃肠道疾病也与焦虑增加有关,使用选择性5-羟色胺再摄取抑制剂进行治疗可能具有双重益处。有趣的是,作者观察到两种性别的EC细胞抑制或激活都会增强焦虑,这表明这种综合行为状态是内脏失调的一种特别敏感的表征,突出了肠-脑轴在神经胃肠病中的重要性。
原文链接:
https://doi.org/10.1038/s41586-023-05829-8
Bayrer, J.R., Castro, J., Venkataraman, A. et al. Gut enterochromaffin cells drive visceral pain and anxiety. Nature (2023).

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言