两款新冠病毒疫苗获批临床试验BioNTech/辉瑞mRNA疫苗和津大学腺病毒疫苗
2020-04-23 药明康德 药明康德
在与新冠病毒疾病(COVID-19)的斗争中,开发有效的预防性疫苗被认为是长期保护世界人口的关键之一。最早的是3月16号,针对新冠肺炎(COVID-19)的临床一期试验在西雅图正式开展。这项试验由美国
在与新冠病毒疾病(COVID-19)的斗争中,开发有效的预防性疫苗被认为是长期保护世界人口的关键之一。最早的是3月16号,针对新冠肺炎(COVID-19)的临床一期试验在西雅图正式开展。这项试验由美国国立卫生院(NIH)下属单位美国国立过敏与传染病研究所(NIAID)资助,在NIAID下属单位凯撒华州卫生健康研究所(KPWHRI)进行[1],疫苗名为mRNA-1273,由NIAID和Moderna公司的科学家共同开发,由一家非营利组织CEPI出资进行生产。这个一期试验旨在检验疫苗的安全性和诱导人体免疫应答(产生抗体)的效果,为期4-6周,共接种两针。
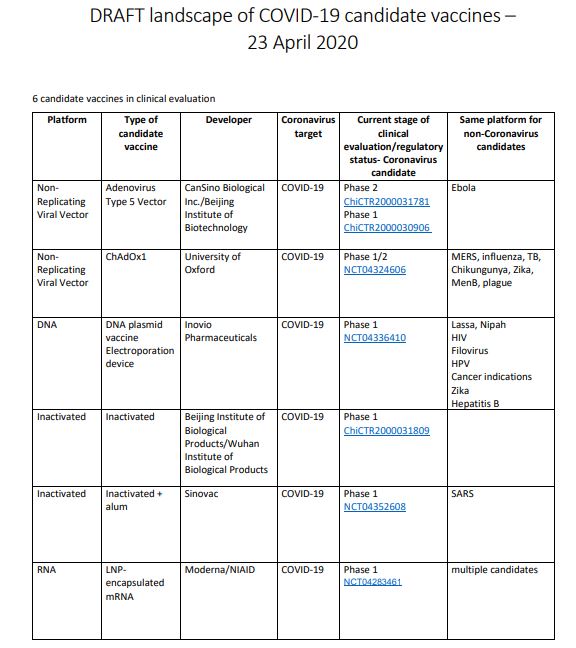
根据世界卫生组织(WHO)的最新统计,目前至少有83个新冠病毒疫苗研发项目,其中6个研发项目已经进入临床开发阶段。下面,我们来看一看新冠病毒预防性疫苗开发的最新进展。
BioNTech/辉瑞mRNA 疫苗获得德国政府批准开展临床试验
德国监管机构Paul-Ehrlich-Institut已经批准BioNTech的BNT162疫苗项目的1/2期临床试验,以防止新型冠状病毒感染。这项试验是德国开始的第一个新冠病毒候选疫苗的临床试验,也是BNT162全球开发计划的一部分。辉瑞和BioNTech也将在美国进行BNT162的试验,预计不久将获得监管部门的批准。
BioNTech公司的疫苗开发平台为mRNA疫苗,将编码病毒抗原蛋白的mRNA通过脂质纳米颗粒递送到细胞中,表达病毒抗原蛋白,进而激发机体免疫反应。总计将有四款候选疫苗进入临床试验,其中2种为核苷修饰的mRNA(modRNA),1种为尿嘧啶核苷mRNA(uRNA),第4种候选疫苗为自我扩增的mRNA(saRNA)。每种mRNA都有与之匹配的脂质纳米颗粒配方。两款候选疫苗编码的蛋白包含较大的刺突蛋白(S protein)序列。另两款候选疫苗包含优化的刺突蛋白受体结合域(RBD)序列。这一序列被认为在与细胞表面的受体结合中起到关键性作用。
1/2期临床试验的剂量递增部分将包括大约200名年龄在18岁至55岁之间的健康受试者,剂量范围为1微克至100微克,旨在确定进一步研究的最佳剂量,并评估疫苗的安全性和免疫原性。这项研究还将评估重复接种使用uRNA或modRNA技术的三种候选疫苗的效果。研究的第二部分将纳入具有更高严重新冠病毒感染风险的人群。
英国卫生部长昨日宣布,由牛津大学(University of Oxford)开发的新冠病毒候选疫苗有望在4月24日开始首次人体临床试验。英国政府将提供2000万英镑(约合2400万美元)给牛津大学的研究团队,支持对候选疫苗的开发。

候选疫苗ChAdOx1由牛津大学Jenner研究所开发,采用的是腺病毒疫苗平台。它将编码新冠病毒刺突蛋白的转基因导入腺病毒载体中。腺病毒载体技术能够通过一剂疫苗接种,激发强力免疫反应。同时,这种病毒无法复制,不会导致接种疫苗的人群出现感染。腺病毒载体已经被用于10多种不同疾病的疫苗开发,其安全性已在总计包括数***的多个试验中得到验证。
附录:世界卫生组织4月23日发布的统计中进入临床试验阶段的新冠病毒候选疫苗
疫苗小知识:
减弱病毒疫苗:有效、难研发、用时长
在这三种不同疫苗形式中,减弱病毒也许是最有效的,但也是最难研发的。因为获得减弱病毒株,需要经过很多代的转染和选择。尽管现代细胞培养和高通量筛选技术会大大加快这个过程,但也不太可能在很短时期内完成。
例如水痘疫苗采用的确实是人水痘病毒。为了获得减弱病毒,原病毒在人胚胎非成纤维细胞中传了11代,然后又在豚鼠胚胎成纤维细胞中传了12代。有意思的是,经过豚鼠细胞传代后,最终获得的减弱病毒成为对豚鼠细胞有更高感染力的病毒。这说明实验室减弱处理不仅仅是一个适应过程,其中还包括不可避免的病毒在基因层面的变化。
同样的例子还有结核疫苗。结核疫苗采用的是减弱病菌。但在减弱的过程中,致病菌失去了个别具有强烈抗原性的蛋白。这也让这一疫苗失去了一定的免疫保护能力。尽管如此,只要给予足够的时间和资源,减弱病毒疫苗是完全可以研发出来,常用的麻疹、腮腺炎、风疹疫苗等采用的都是减弱病毒。
但是,对于像新冠病毒这样一种突发性的病毒,时间并不站在我们这边,因此研发减弱病毒疫苗非但研发过程会较长,而其最终病毒株的安全性和免疫效果也很难确定。
灭活病毒疫苗:速度快、但抗原特异性较低
与减弱病毒疫苗相比,灭活病毒疫苗可能是一个更好的选择。灭活病毒疫苗可以避免长时间的筛选和测试过程,也可以避免在减弱过程中病毒抗原性的改变,以及几率不高但确实存在的个别感染的问题。常用的疫苗如小儿麻痹症疫苗以及季节性流感疫苗采用的多为灭活病毒。采用类似技术的还有伤寒、霍乱、鼠疫疫苗和百日咳疫苗这样的细菌疫苗。
这类疫苗唯一的缺点是在灭活的过程中,病原体中的抗原蛋白势必也会发生结构上的变化,这也会让灭活后的疫苗降低抗原的特异性。尽管如此,这些疫苗都已经被证明为具有保护作用,因此从技术上讲是不存在任何问题的。
裂解病毒疫苗:抗原性更强,安全性更好
裂解病毒疫苗是相对比较新的技术平台。主要通过采用表面活性剂来裂解病毒颗粒,从而达到阻止病毒在体内复制的可能。与传统灭活技术相比,裂解后的病毒抗原可能会更好地保持原抗原的结构和抗原特异性。例如流感疫苗现在就有全病毒灭活疫苗和裂解病毒疫苗。两者相比,裂解病毒疫苗抗原性更强,安全性更好。
因此如有可能,新冠病毒疫苗应该选择采用裂解病毒疫苗的形式。更重要的是,一旦病毒裂解后,可以根据对于病毒的致病性和抗原性的研究,有选择地分离部分病毒组分,从而更加精准地刺激特异性免疫功能。目前有不少这样的疫苗已经成功上市,比如肺炎疫苗。其他更多的疫苗还在研究之中。
MVA技术平台:可表达任何病毒的抗原蛋白,临床尚待观察
近日,武汉博奥生物与美国GeoVax Labs公司宣布合作开发一种新型的病毒疫苗。这种新型病毒疫苗是基于GeoVax公司的MVA技术平台。简单地说,MVA(Modified Vaccinia virus,Ankara)通过基因修饰,把病毒复制所需要的一些关键蛋白,通过基因改造,转移到宿主细胞里去。病毒可以在宿主细胞里扩增,但最终生成的病毒颗粒却不具有在正常细胞复制的能力。这样,生成的病毒颗粒可以保持活病毒的抗原性却不具有病毒活性。以这种病毒作为载体,就可以表达其他任何病毒的抗原蛋白,从而在人体内产生相应的特异性免疫。利用病毒和细菌载体表达特异性抗原已经有不少研究和临床,其中有成功的也有失败的。因此我们这一新疫苗是否可以获得临床成功还有待观察。
重组病毒蛋白疫苗:解决产能瓶颈
但是,无论研发哪种病毒疫苗,“瓶颈”显然在于病毒抗原的生产能力。以流感疫苗为例。我国每年流感感染人群估计在1亿~2亿人。而在过去十年里,我国流感疫苗每年批签发量最高为5000万支,平均约为3500万支左右。因此,在流感季节寻求一支流感疫苗往往都很困难。而如果发生类似新冠病毒这样的新型病毒流行,光是覆盖大部分60岁以上老年人就需要超过2亿支疫苗。因此,开发基于病毒抗原的疫苗需要有更好的病毒扩增技术和更大规模的生产设备。
而如果采用重组病毒蛋白疫苗,在生产上就要容易很多。到目前为止,已经有大约30个病毒株被成功分离和测序。这些数据都向全世界科学家开放。
与国内团队相比,国外团队很可能会更多地研发重组蛋白疫苗。在冠状病毒结构蛋白中,组成“皇冠”的S-蛋白是一个明显的靶点,也因此成为大多数研究团队研究的重点。我国三位研究人员合作通过蛋白三维结构计算机模拟,成功地揭示了S-蛋白与其侵入细胞过程中的受体ACE2的关系。这些结果,除了揭示病毒感染的途径,还为开发特异性重组蛋白疫苗提供了思路。
基于RNA、DNA和多肽的疫苗:第一批疫苗有可能40天内到达临床
除了重组蛋白外,国外研究单位也提出了基于RNA、DNA和多肽的疫苗。最近位于上海张江的思微生物与同济大学合作,准备在短期内研发和生产基于病毒 mRNA 序列的疫苗。根据报道,第一批疫苗有可能在40天内到达临床。几乎在同一时间,苏州艾棣维欣生物制药与美国Inovio公司宣布采用DNA疫苗快速响应技术,以最快的速度进行开发,争取在最短时间内将疫苗在中国推进至临床试验阶段,满足疾病防控的需求。我们期待着这几个产品的成功。
DNA或RNA疫苗研发可以追溯到上世纪80年代或更早。其核心概念就是将病毒抗原性蛋白基因以DNA或RNA的形式注入到人体内,通过人体细胞生成相应的抗原并导致免疫。这样的疫苗在理论上可以达到与重组蛋白疫苗相同或更好的免疫效果。而且在不少临床应用方面,包括肿瘤疫苗,也确实获得不同程度的成功。
但是,这个领域的发展长期以来受到核酸递送问题的困扰。而及时递送问题解决,也还存在有一个个体表达水平差异的问题。这无疑是一个值得探讨和开发的方向。
参考资料:
[1]https://www.nih.gov/news-events/news-releases/nih-clinical-trial-investigational-vaccine-covid-19-begins
[2] DRAFT landscape of COVID-19 candidate vaccines – 23 April 2020. Retrieved April 22, 2020, from https://www.who.int/blueprint/priority-diseases/key-action/draft-landscape-COVID-19-candidate-vaccines-23-April-2020.pdf?ua=1
[2] University of Oxford Covid-19 vaccine: everything we know so far. Retrieved April 22, 2020, from https://www.telegraph.co.uk/global-health/science-and-disease/oxford-university-coronavirus-vaccine/
[3] BioNTech and Pfizer announce regulatory approval from German authority Paul-Ehrlich-Institut to commence first clinical trial of COVID-19 vaccine candidates. Retrieved April 22, 2020, from http://www.globenewswire.com/news-release/2020/04/22/2019785/0/en/BioNTech-and-Pfizer-announce-regulatory-approval-from-German-authority-Paul-Ehrlich-Institut-to-commence-first-clinical-trial-of-COVID-19-vaccine-candidates.html
[4] Oxford COVID-19 vaccine programme opens for clinical trial recruitment. Retrieved April 22, 2020, from https://covid19vaccinetrial.co.uk/press-release-trial-open
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Bio#
75
#RNA疫苗#
70
#病毒疫苗#
117
#TEC#
86
#BioNTech#
77
新冠肺炎,疫情何时才能消失
81
好
155