Science封面:癌症免疫治疗潜在新靶点ESCRT
2022-04-26 MedSci原创 MedSci原创
正常的细胞往往都有一个共同的特征,即一个由双层磷脂形成的保护性膜结构,其也被称作细胞质膜。质膜可以保护细胞免受环境影响,并且充当细胞内外物质交换的守门人。当质膜承受的压力过大,无论是缺氧、营养匮乏或药
正常的细胞往往都有一个共同的特征,即一个由双层磷脂形成的保护性膜结构,其也被称作细胞质膜。质膜可以保护细胞免受环境影响,并且充当细胞内外物质交换的守门人。当质膜承受的压力过大,无论是缺氧、营养匮乏或药物影响,质膜都会产生损伤从而导致细胞死亡。癌细胞也如此。
基于癌细胞这一特征,细胞毒性T淋巴细胞(CTL)才会特异性地分泌两种蛋白来破坏质膜和促进癌细胞死亡。其中,CTL分泌的穿孔素(perforin)和颗粒酶(granzymes)是可以合作产生细胞毒性的毒素蛋白。穿孔素能够在质膜上形成孔洞,颗粒酶可以充当蛋白水解酶的作用,从孔洞进入癌细胞诱导细胞产生程序性死亡。
然而,癌细胞内善于逃避细胞毒性T淋巴细胞(CTL)致命攻击,其方法之一就是有效修复自身细胞膜的损伤,但其中的具体机制并不清楚。
2022年4月22日,基因泰克公司(Genentech)的研究人员在 Science 期刊发表了题为:ESCRT-mediated membrane repair protects tumor-derived cells against T cell attack 的研究论文,并作为期刊封面出现,引发人们的关注。
该研究发现并证实了ESCRT(内吞体分选转运复合体)介导的细胞膜修复机制导致癌细胞逃避细胞毒性T淋巴细胞(CTL)致命攻击,而抑制ESCRT通路能够促进CTL对癌细胞的杀伤,这为肿瘤免疫治疗提出了一种新的有潜力的治疗靶点。事实上,早在2017年,科学家就发现这一现象:Cell:ESCRT样程序性细胞坏死
转运必需内体分选复合物(endosomal sorting complex required for transport, ESCRT)系统是真核细胞中完成内体(endosome)膜内陷以形成多囊泡体(multi-vesicular body, MVB)的分子机器.其主要功能是促进被泛素(ubiquitin)标记的膜蛋白的降解, 还与细胞分裂、病毒出芽、细胞自噬以及真菌pH感知相关. ESCRT系统包括ESCRT-0,-Ⅰ,-Ⅱ,-Ⅲ和Vps4-Vta1共5个蛋白蛋白复合物.晶体学研究已经解析了大部分复合物的结构. 其促使膜内陷的分子机理一般认为分3步. 首先是ESCRT-Ⅰ和-Ⅱ在内体膜上结合并促使内体膜内陷形成初始芽体. 之后,ESCRT-Ⅲ在芽体颈部聚合并导致芽体的剪切,从而将内腔囊泡(intralumenal vesicles, ILVs)释放到内体腔内,形成MVB. 最后,Vps4/Vta1复合物则以水解ATP提供能量将聚合的ESCRT-Ⅲ解聚以循环使用,完成更多的出芽过程。


借助高分辨率成像和活细胞功能分析,来自美国基因工程技术公司基因泰克(Genetech)的研究团队发现,癌细胞产生的内体蛋白分选转运蛋白(ESCRT)能够用来防御CTL两种蛋白的进攻。它能够修复穿孔素在质膜上产生的孔洞,以此来拖延颗粒酶进入细胞内部的时间,甚至完全阻止它们进入。
在穿孔素被释放后,ESCRT蛋白会被精确招募到细胞毒性T淋巴细胞(CTL)和癌细胞的接合位点,从而修复穿孔素在细胞膜上的打孔,这种修复机制可以延迟或阻止杀伤性颗粒酶进入癌细胞,从而让癌细胞逃避死亡。研究团队推断,抑制ESCRT蛋白介导的穿孔修复,有望使细胞毒性T淋巴细胞(CTL)更好地杀伤癌细胞。而之前也有研究显示,长时间抑制ESCRT通路足以导致细胞死亡。
因此,研究团队使用了两种替代方法:一种是使用CRISPR基因编辑敲除ESCRT通路中的Chmp4b基因,一种是过表达ESCRT通路中的磷酸化酶VPS4的突变体。实验结果显示,这两种方法都能阻止ESCRT修复癌细胞膜中穿孔素的打孔,从而增加这些癌细胞被细胞毒性T淋巴细胞(CTL)杀伤的敏感性。
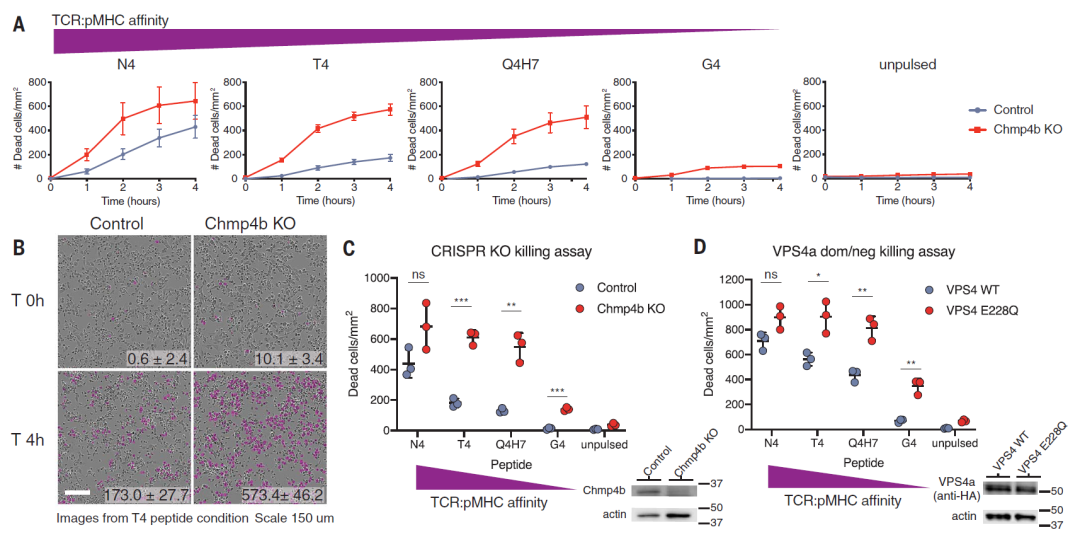
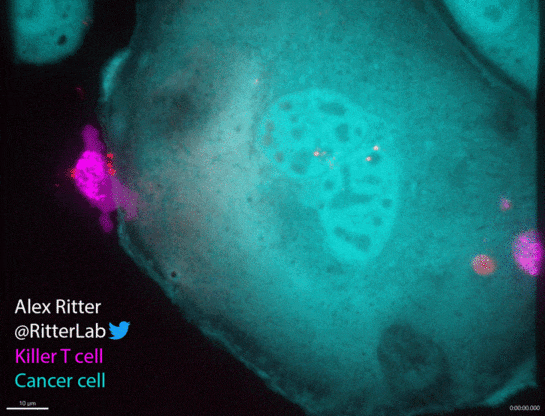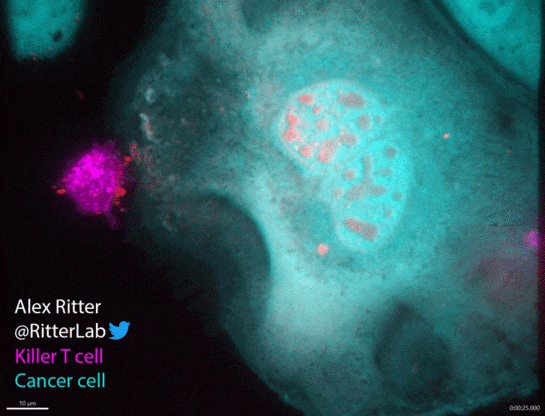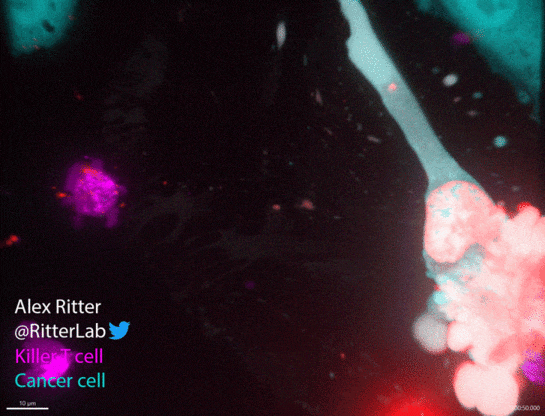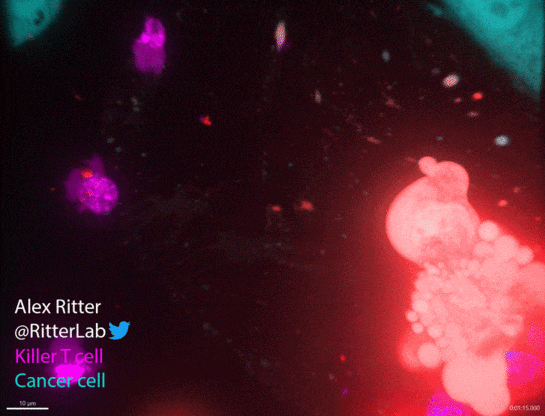
如动图所示,一个杀伤性T细胞(红色)参与并摧毁一个巨大的卵巢癌细胞(绿色),癌细胞中从T细胞附着部位发出的红波表明T细胞释放了破坏细胞膜的穿孔素和颗粒酶
对于这项研究结果,荷兰Radbound大学医学教授兼细胞显微成像主席彼得·弗里德尔博士认为,ESCRT机制或许会成为一个潜在靶点,毕竟,在此次定义的模型中,它将杀伤率提高了2到3倍。因此,干扰ESCRT膜修复pair复合物可能会开启一种新型的靶向方法,以延长单个细胞毒性T细胞造成的损伤。

基因泰克肿瘤学研究副总裁 Ira Mellman 博士
该研究的通讯作者、基因泰克肿瘤学研究副总裁 Ira Mellman 博士表示:这项研究表明,癌细胞使用一种普遍的膜修复机制来保护自己免受免疫系统攻击,这既是意料之外又在意料之中。从进化上讲,这可能有助于健康细胞防止不必要的或意外的误杀,但在癌症中,这可以部分解释癌细胞对免疫疗法的固有抵抗力。了解和解决这一机制将有助于开发更有效的癌症免疫疗法。
总的来说,该研究揭示了ESCRT介导的细胞膜修复是一种重要的且之前未被关注的癌细胞逃逸免疫系统杀伤的方式。在该研究中,抑制ESCRT通路能够显著提高细胞毒性T淋巴细胞(CTL)的杀伤效率。这提示了我们,ESCRT通路是一个有价值的癌症治疗靶点。Ira Mellman 博士表示,接下来将在功能上解析ESCRT复合体,以进一步确定治疗靶点。
马里兰大学细胞生物学家Norma Andrews博士认为未来的研究还将探讨其他细胞过程在修复膜损伤中的作用。“这一点很重要,因为全面了解质膜再封闭机制可能会揭示出合适的治疗干预步骤。”
不过,梅斯医学也注意到ESCRT是一个较为庞大的系统,在生理上与人体诸多功能密切相关。ESCRT 系统至少包括 ESCRT-0,-Ⅰ,-Ⅱ,-Ⅲ和 Vps4-Vta1 共 5 个蛋白-蛋白复合物。它参与多囊泡体( MVB ) 的形成,HIV 等囊膜病毒的出芽,真菌感知碱性环境,以及肿瘤。因此,它能否是一个“优质”靶点,仍然需要进一步研究。也许将来有必要针对不同的瘤种的ESCRT系统进行针对性研究。另外,这个机制如果得到应用,就应该与穿孔素联合使用,仅仅控制ESCRT,穿孔素也未必能及时杀死肿瘤细胞。
原始出处:
Ritter AT, Shtengel G, Xu CS, Weigel A, Hoffman DP, Freeman M, Iyer N, Alivodej N, Ackerman D, Voskoboinik I, Trapani J, Hess HF, Mellman I.ESCRT-mediated membrane repair protects tumor-derived cells against T cell attack.Science . 2022 Apr 22;376(6591):377-382.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#ESCRT#
112
#新靶点#
110
#CRT#
120
#SCIE#
101
#SCR#
80
潜在新靶点发现,相当不易。现在#肿瘤免疫#的#靶点#仍然屈指可数,PD-1/PD-L1, CTLA-4, LAG-3,这4个目前都算成功,以前的TIM-3,IDO-1,是大量的失败案例,还有最新的A2AR, NKG2A等,都需要观察
140