罕见病例|肝移植治疗难治性肝炎性肌纤维母细胞瘤1例
2023-10-21 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本文主要介绍1例难治性HIMT,病灶肝内多发并累及肝门部胆管引发胆管狭窄,患者反复出现梗阻性黄疸症状7年余,予以多种治疗手段效果均欠佳,最终行肝移植术后成功治愈,结合患者病史及相关资料。
肝炎性肌纤维母细胞瘤(HIMT)是一种少见的间叶组织起源的交界性实体肿瘤,病因及发病机制尚不明确,临床表现及影像学特征不典型,很容易误诊,大多数经保守治疗或手术局部切除后治愈,预后较好,少数有复发倾向和恶变潜能。本文主要介绍1例难治性HIMT,病灶肝内多发并累及肝门部胆管引发胆管狭窄,患者反复出现梗阻性黄疸症状7年余,予以多种治疗手段效果均欠佳,最终行肝移植术后成功治愈,结合患者病史及相关资料,现将病例报告如下。
1 病例资料
患者女性,21岁,2019年9月15日因“反复皮肤巩膜黄染7年余”就诊于南京鼓楼医院肝胆胰中心肝脏与移植外科,入院后诊断为HIMT。患者7年前无明显诱因出现皮肤巩膜黄染,并逐渐加重,伴皮肤瘙痒,至当地医院查磁共振胰胆管成像(MRCP)示:肝门部胆管梗阻伴肝内胆管明显扩张,胆总管全程闭塞;CT示:肝内多发低密度影,肝内胆管扩张,肝右叶小囊肿,肝内多发异常强化影,脾肿大,胆囊炎,门静脉海绵样变,腹膜后多发淋巴结、部分稍大。后至本院消化内科行经内镜逆行胰胆管成像(ERCP)+胆道支架置入术后黄疸减退。2012年8月14日患者在本中心行腹腔淋巴结+尾状叶肿瘤活检术,术后病理提示炎性肌纤维母细胞瘤(IMT)。2012年10月出现上腹部胀痛,向腰背部放射,进食后加重,伴皮肤巩膜黄染及发热,于2012年10月9日在本院消化内科行ERCP+胆道狭窄扩张+胆道支架更换,术后症状缓解。2012年10月18日在外院接受肝脏病灶伽马刀治疗。后分别于2013年1月29日、2014年7月8日在本院消化内科行ERCP更换胆道支架。2015年5月因黄疸症状反复在本院消化内科行经皮肝穿刺胆道引流术。2015年7月2日在外院行肝内病灶碘粒子植入术。后又分别于2017年4月、2017年8月、2018年8月、2019年2月在本院消化内科行ERCP更换胆道支架。患者曾于2019年7月1日为行肝移植入院,但在住院期间出现反复发热、感染性休克,血培养示大肠埃希菌和粪屎球菌阳性,经抗感染抗休克治疗后好转出院。患者既往无肝炎史,无外伤史,无输血史,未合并其他系统疾病。查体未见特殊异常。
术前辅助检查:2019年4月19日在本院查MRCP+ 增强(图1)示:肝脏右叶边缘不光整,内见多发异常信号,增强扫描可见肝右缘线状强化;增强扫描肝左叶见条状低信号;门静脉主干及左支曲张伴多发侧支形成;肝内胆管扩张,肝左叶胆管区见结节状短T1短T2信号,较大者直径约1.5 cm,局部胆管壁可见增厚强化;胆囊壁增厚;胆总管上段局部显示欠佳;脾脏体积增大,胰及双肾未见明显异常,腹腔内多发游离积液;腹腔及腹膜后多发小淋巴结;右侧心隔角旁见约30 cm×16 cm软组织信号;右侧胸腔积液。实验室检查:红细胞计数2.45×1012/L、血红蛋白66 g/L、血小板计数27×109/L;谷酰转肽酶70.5 U/L、直接胆红素17.7 μm/L、白蛋白31.3 g/L、胆固醇1.4 mmol/L、C反应蛋白88.7 mg/L;凝血酶原时间17.7 s、活化部分凝血活酶时间45.7 s、D二聚体4.17 mg/L;直接抗人球蛋白试验阳性,其余检查指标未见异常。心电图、心脏超声、肺功能、胸部CT均未见特殊异常。
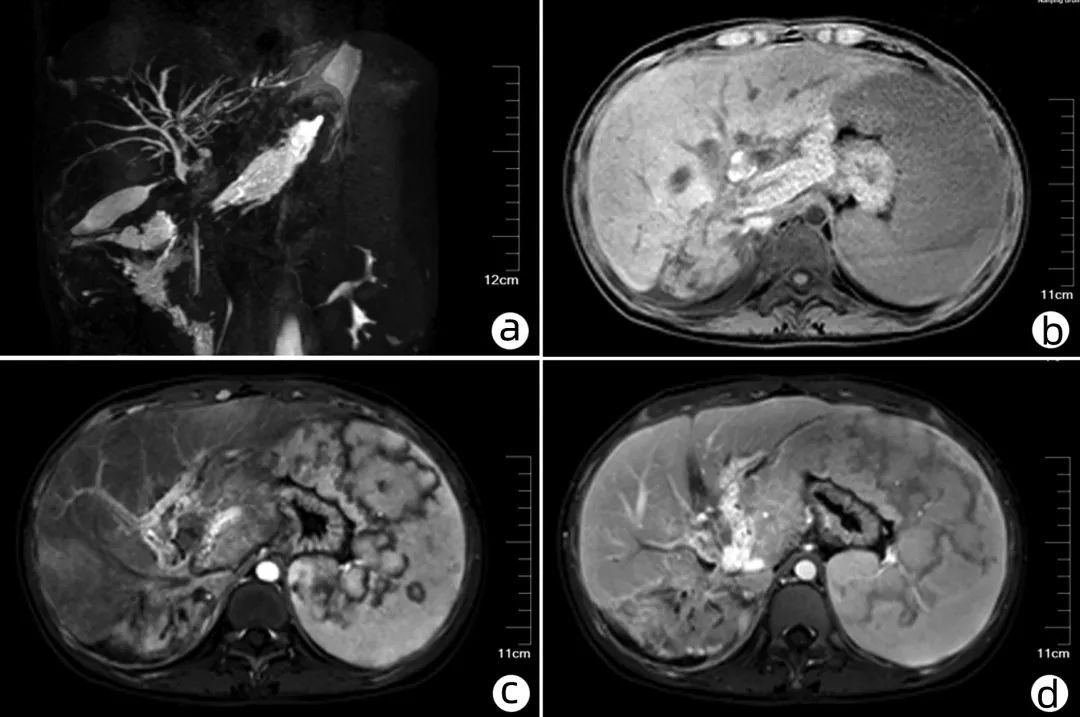
图1 术前MRCP+增强检查结果
注:a, 3D-MRCP;b, T1WI平扫;c, 动脉期强化;d, 静脉期强化。
肝移植经过:患者于2019年9月18日在本院行同种异体经典原位肝移植术。手术指征:HIMT引发肝门部胆管顽固性狭窄,患者病情反复并伴有加重,其他治疗手段效果不佳,且不能排除恶性可能,满足肝移植条件,未见手术禁忌。手术过程顺利,全程610 min,无肝期59 min,术中出血量约8 000 mL,共输注洗涤红细胞23 U、悬浮少白细胞红细胞6 U、冷沉淀凝血因子9 U、冰冻血浆3 900 mL、辐照单采血小板2个治疗量、人纤维蛋白原6 g,术中快速病理示:(尾状叶肿块)送检组织示纤维细胞及纤维母细胞/肌纤维母细胞增生伴少量淋巴细胞、浆细胞浸润,未见明确上皮性恶性肿瘤;(肝门部淋巴结)淋巴结1枚示反应性增生。患者术后生命体征平稳,术后5 h拔除气管插管,在重症监护室观察1日无特殊异常后转回病房,予以抗感染、保肝、补液等对症支持治疗,免疫抑制方案为甲强龙联合吗替麦考酚酯及他克莫司,术后1周肝功能恢复正常,多次病原学培养均未见阳性,患者术前曾伴有明显的贫血、低血小板及低白蛋白血症和凝血功能异常,术后未见好转,予以多次输注红细胞、血小板、白蛋白及营养支持治疗后逐渐恢复,患者于2019年11月25日顺利出院。术后病理(图2)回报:(右肝)肝组织示胆管管壁扩张,管壁纤维组织增生伴多量急、慢性炎症细胞浸润,扩张胆管壁周围小胆管增生,部分区肝细胞脂肪变,肝窦扩张肝细胞显著淤胆,局灶大泡性脂肪变性,肝窦稍扩张,汇管区慢性炎症细胞浸润(F1,G2,S0);肝门部胆管壁显著增厚、胶原组织结节状增生,局灶肌纤维母细胞增生。免疫组化:细胞角蛋白(CK) (-),LCA散在(+),CD117散在(+),间变性淋巴瘤激酶(ALK) (-),平滑肌肌动蛋白(+),结蛋白散在(+),波形蛋白(+ + +),HMB45(-),CD34血管(+)。
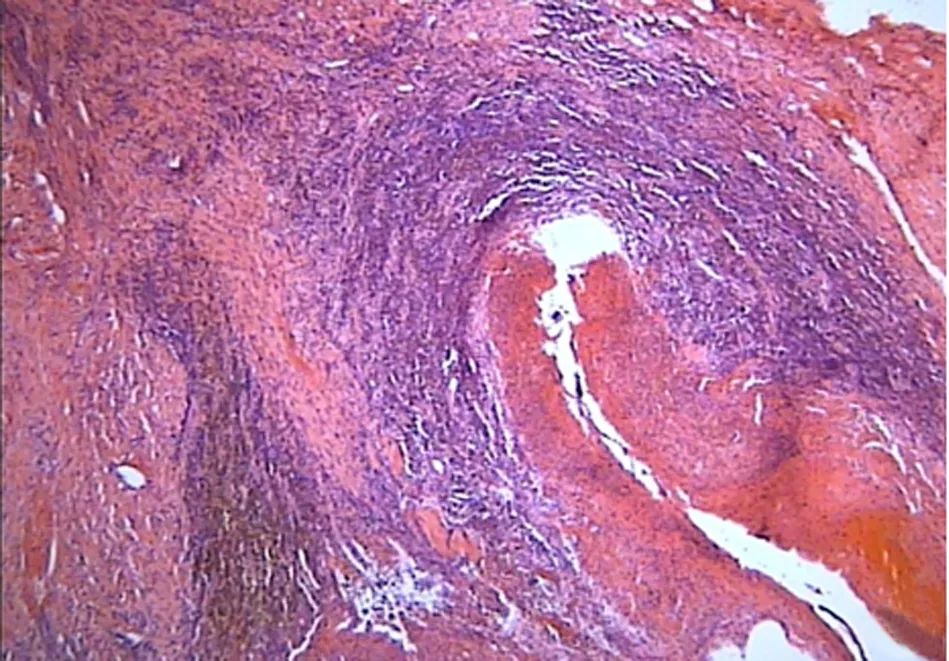
图2 术后肝肿物病理检查结果(HE染色,×100)
术后随访:2020年7月23日查上腹部增强CT(图3)示:肝移植术后,肝裂包裹性积液,肝囊肿可能;肠系膜脂肪多发片絮影及淋巴结影;右侧心隔角区、腹腔及腹膜后多发淋巴结;脾肿大;肝门部结构及胆囊显示不清;腹腔肠管致密影,部分肠管内积气;右侧胸腔积液。未见HIMT复发征象。目前患者肝移植术后3年,定期随访未再出现黄疸症状,最近一次门诊时间为2022年10月20日,患者精神状态佳,平常未诉不适,查血常规、生化全套、凝血五项等未见异常。

图3 术后10个月复查增强CT检查结果
注:a, 平扫;b, 动脉期强化;c, 静脉期强化。
2 讨论
IMT是由肌纤维母细胞和成纤维梭形细胞伴有炎症细胞(包括淋巴细胞和嗜酸性粒细胞)组成的肿瘤,鉴于复发和转移的风险较低,目前被归类为具有中等生物学潜力的肿瘤疾病[1-2]。IMT原发灶大多位于腹腔,特别是肠系膜、大网膜和腹膜后间隙,也可累及肺、膀胱、中枢神经系统和女性生殖系统[3]等部位,发生在肝脏和胆管的相对较为罕见,主要影响儿童和年轻人,且多为孤立性病灶[4]。HIMT具有上述相同的病理特点,在我国是一种罕见的肝脏实体肿瘤,大多数患者在体检时发现,少数出现症状者主要表现为上腹部疼痛和发热[5]。本例肝内多发并累及肝门部胆管、以梗阻性黄疸为主要症状的HIMT,属于治疗上较为棘手的特殊个案,在临床上非常罕见。
HIMT的发病机制目前尚不明确,可能与细菌、病毒、寄生虫等感染有关[6],胆汁中胆汁酸浓度高、胆管损伤和胆管周围炎也可能是潜在致病因素[7]。另外,约50%的IMT患者中可见ALK基因和ALK阳性细胞重排,并与肿瘤的侵袭性相关,同时IMT通常可见IgG4阳性细胞,提示自身免疫可能在IMT中发挥作用,但具体机制有待进一步研究[8]。
由于缺乏独特的诊断性临床、实验室或影像学特征,加之发病率低而对HIMT的认识普遍不足,HIMT在最初几年的误诊率高达70%以上[5]。HIMT的确诊目前主要依赖病理组织学检查,可分为黏液样血管型、致密梭形细胞型和低细胞纤维型三种,以胶原基质中大量梭形细胞增殖,伴浆细胞、淋巴细胞等炎症细胞浸润为主要特点[9]。在免疫组化方面,大多数梭形细胞中平滑肌肌动蛋白和波形蛋白呈阳性,部分病例中结蛋白、ALK及CK可呈阳性,而S-100蛋白和CD34等大多呈阴性,可以协助病理诊断[6]。HIMT的影像学检查首选超声检查,多表现为实性或囊实性的低回声肿物,但特异性较差[10]。CT表现为肝实质内低密度影,边缘模糊,形态多不规整,动脉期可呈轻度强化,门静脉期和实质期持续强化;MRI表现为T1WI和T2WI上不均匀等信号或略低信号,边界模糊,增强扫描与CT基本一致,动脉期轻度强化或无明显强化,门静脉期轻度强化,实质期强化程度较前明显[11]。总的来说,HIMT的影像学检查缺乏特异性表现,大多只能发现异常区域而不能判断病变性质,最终通过组织活检或术后病理确诊。需特别说明的是,发生在肝门部胆管的IMT虽然很少见,但极易误诊为胆管癌[12],遇到类似病例应仔细鉴别。
HIMT的治疗目前主张先行保守治疗,保守治疗无效或不能排除恶性者才考虑手术治疗,传统的保守治疗方法包括激素、非甾体抗炎药、抗生素、胆汁引流等[13],新兴的分子靶向治疗及免疫治疗也已在IMT的治疗中应用,并取得初步成效[1]。总之,绝大多数的HIMT在治疗上并不复杂,且都能取得不错的预后[5],而对于罕见的难治性HIMT,目前临床诊疗经验尚欠缺,有待更多的研究和报道。
肝移植是大多数终末期肝病最重要且最为有效的治疗手段,主要适应证包括各种良性肝病导致的不可逆肝衰竭,以及符合移植标准的以肝细胞癌为代表的各种肝恶性肿瘤[14],近年来,肝移植的适应证界限不断扩大,许多非肝细胞癌原发性和转移性肝恶性肿瘤在肝移植后也能达到很好的效果[15]。在本例报道中,单纯的HIMT并不能达到肝移植指征,但该患者HIMT累及肝门部胆管引起持续反复的胆管狭窄,在多种治疗手段不能长久缓解症状和遏制病情进展的情况下,加之并不能完全排除肝门部胆管癌的风险,肝移植或许是能够治愈该疾病的最后选择。另外最近有1例罕见的单纯肝门部胆管IMT的报道[16],在行局部肿瘤切除+肝门部胆管整形+胆肠吻合术后患者康复出院,取得不错的治疗效果,不过本例患者HIMT肝内多发并且肝内小胆管也出现病变,在这种情况下,肿瘤的局部切除手术无法实施,肝移植俨然成为唯一也是最佳的选择。
查阅文献发现,在国外既往共有8例因HIMT行肝移植术的个案报道,患者均为14岁以下儿童,而导致移植的主要原因也都与本例相同,即HIMT累及肝门部胆管导致胆管狭窄,患者黄疸症状明显,且肿瘤经局部手术无法切除[17-23]。不过,与本例报道不同的是,上述报道的HIMT中部分表现出明显的侵袭性,病变累及门静脉或下腔静脉,引发闭塞性静脉炎和门静脉高压,移植过程中需进行血管重建,还有1例HIMT侵犯肝总动脉和胰头,在肝移植的同时实施了胰十二指肠切除术[21]。最终,上述报道病例的肝移植均取得成功,术后随访期间均未见复发,结合本文报道经验认为,保守治疗无效、局部手术无法切除的肝门部HIMT是肝移植的良好适应证,同时基于HIMT惰性肿瘤的生物学特征,无论HIMT术前是否表现出明显的侵袭性,是否有血管和周围组织侵犯,在能够完全切除肿瘤病灶的情况下,均可行肝移植术。
综上所述,HIMT是一种少见的肝肿瘤,对其认识仍存在不足,误诊率较高,大多数经保守或手术治疗后能够治愈,但对于极少数类似于本例的复杂难治性HIMT,在其他治疗手段效果有限的情况下,肝移植或许是值得考虑的重要选择,往往能取得很好的治疗效果,本文所报告病例的成功经验值得借鉴。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.07.022
引证本文
解鸿跃, 周喆聿, 邵光鑫, 等. 肝移植治疗难治性肝炎性肌纤维母细胞瘤1例报告[J]. 临床肝胆病杂志, 2023, 39(7): 1673-1677

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











很棒
53
∽兴岑学习了
56