ADC设计中的靶抗原选择
2024-09-20 小药说药 小药说药 发表于上海
在ADC的开发中,选择在恶性细胞上高表达但在正常组织和免疫细胞上低表达的靶抗原被认为是实现选择性和效力的关键,同时最大限度地减少靶向肿瘤外毒性。
前言
抗体偶联药物(ADC)是一种强大的抗癌治疗方法,通过靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成。ADC利用抗体对其靶抗原的特异性,结合细胞毒性药物的效力,选择性地杀死表达靶抗原的肿瘤细胞。兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。
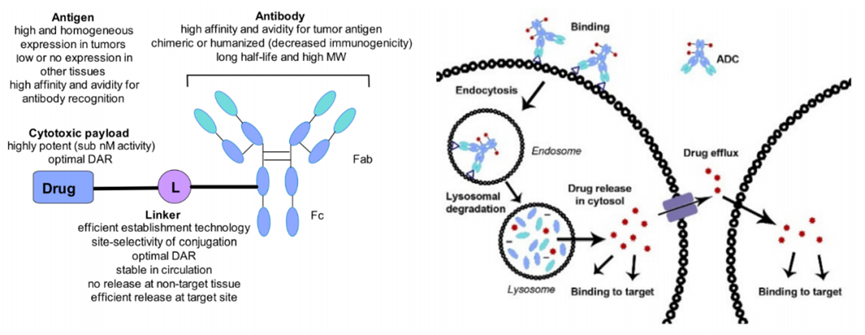
在ADC的开发中,选择在恶性细胞上高表达但在正常组织和免疫细胞上低表达的靶抗原被认为是实现选择性和效力的关键,同时最大限度地减少靶向肿瘤外毒性。除此之外,选择用于ADC的抗原需要考虑与靶抗原的表达模式和生物学特征相关的几个因素。
靶抗原选择的因素
在ADC中使用高效细胞毒性有效载荷需要合理的靶抗原选择,目的是最大限度地提高肿瘤选择性和抗肿瘤效力,同时最大限度地降低靶向肿瘤外剂量限制毒性。因此,在试图平衡安全性和有效性等因素的同时,尽可能地向癌细胞递送有效载荷对ADC设计至关重要。
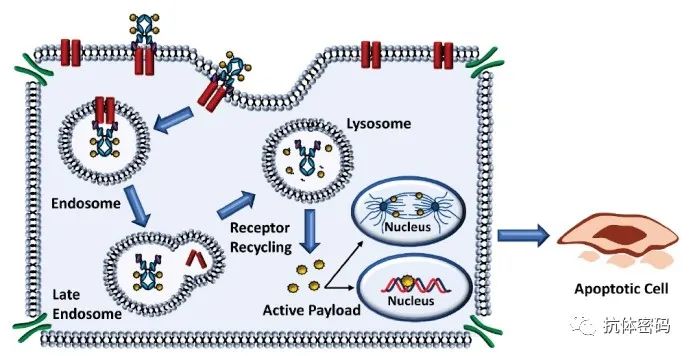
根据目前公认的原则,有效ADC的理想靶抗原应在肿瘤细胞表面以足够的密度和均匀性表达,在正常细胞上以最小的表达量表达,以限制靶向肿瘤外毒性并优化治疗指数。除了特异性和过表达外,最佳的靶抗原还需要是细胞外的,以便抗体结合抗原表位。此外,ADC疗效通常取决于有效的靶向介导内化,肿瘤抗原与ADC结合后的内化率和内化溶酶体运输动力学可能直接影响有效载荷释放和癌细胞杀伤。
了解抗原靶点主要指向循环或溶酶体靶向途径也是至关重要的。抗原-ADC复合物再循环到质膜被认为会影响ADC向溶酶体的有效递送,并可能阻碍有效载荷向胞质的释放,从而损害ADC的效力。最后,影响ADC有效性的另一个因素是从细胞表面去除抗原的速率,通常由肿瘤细胞产生的蛋白酶介导,这一过程被称为抗原脱落。
靶标表达水平
达到ADC活性的抗原表达阈值水平根据几个参数而显著变化,其中许多参数尚未完全阐明。已知表达水平取决于特定靶点、识别的抗原表位和癌症适应症,这对于靶向实体瘤的ADC尤其明显。例如,评估Kadcyla对HER2阳性转移性乳腺癌疗效的临床经验表明,与HER2低表达亚组相比,高表达亚组的生存率更好。
然而,Enhertu对HER2低表达乳腺癌患者的突出疗效表明,没有广泛适用的靶抗原表达阈值来确保ADC的疗效。在体外和体内实验中,一些HER2阴性细胞系可能仍然保持活跃的HER2信号传导,并且对抗HER2疗法敏感。这表明,由于表面表达的HER2水平较低,导致的较低水平的促肿瘤信号传导仍可能支持肿瘤生长。其它的靶点也不尽相同,例如选择仅高表达FRα靶抗原的患者组似乎与治疗益处相关。而在肾细胞癌临床研究中的ADC靶点CD70,仅观察到抗原表达水平与CD70靶向ADC敏感性之间的有限相关性。
总的来说,针对ADC治疗几种癌症类型的临床前研究和临床评估表明,不存在将抗原表达水平与ADC活性相关联的总体范式。因此,需要根据经验确定每种肿瘤类型和ADC的抗原表达的理想Cut-off值。
脱靶毒性
ADC治疗在临床上观察到的毒性最常见是由于脱靶效应,而ADC的靶向-靶外肿瘤毒性可能受到靶抗原选择的影响。
为了减轻毒性,还必须考虑靶抗原的生理作用及其发挥这一作用的机制。因此,新ADC靶标的临床前毒性研究不仅需要研究靶标在肿瘤和正常组织之间的差异表达,还需要研究靶标的生理功能,以确定潜在的毒性。例如,CD44抗体bivatuzumab与DM-1的ADC用于治疗鳞状细胞癌的I期试验报告了致命的皮肤毒性,这可能归因于健康角质形成细胞表达CD44。
然而,尽管正常细胞表达靶抗原是一个值得考虑的重要因素,但它并不一定会阻碍ADC的开发和最终成功。例如,尽管TROP-2在一些正常组织中高水平表达,但Trodelvy已成功开发并获得FDA的批准,用于治疗转移性三阴性乳腺癌。这表明,对于抗TROP-2 ADC,与恶性组织相比,正常组织中抗原的表达差异可能足以避免严重的毒性。此外,也有人认为,TROP-2在正常细胞上的细胞内而非细胞表面表达,或在抗体或ADC无法接近的导管或腺上皮管腔侧等部位的表达,可能起到重要作用。
抗原脱落
当选择ADC靶点时,抗原的脱落率可能是一个重要的考虑因素。在基于抗体的治疗方法中,抗原脱落是指去除细胞表面表达的靶抗原,这一过程通常由蛋白酶介导,作为功能调节的一种手段。早期对免疫毒素的研究表明,抗原脱落的增加可能会减少可用于靶向和肿瘤结合的ADC的量,从而损害ADC的有效性。然而,其他使用数学和实验模型的研究表明,高抗原脱落率可能增加还是降低ADC的有效性取决于几个因素,包括ADC内吞率、ADC再循环率和通过肿瘤微环境的外渗率。例如,对于抗间皮素和抗CD25免疫毒素的相同模型表明,脱落率的增加会增加前者的效力,但会降低后者的效力。
血液肿瘤的ADC靶点
对于血液肿瘤,免疫谱系特异性生物标志物如CD19、CD20、CD22、CD33、BCMA和CD79在恶性血液细胞上以高水平广泛而均匀地表达,因此已被广泛探索为ADC发展的候选靶点。此外,批准的ADC的靶抗原在结合后都很容易发生内化,这也是有助于ADC疗效的一个重要特征。
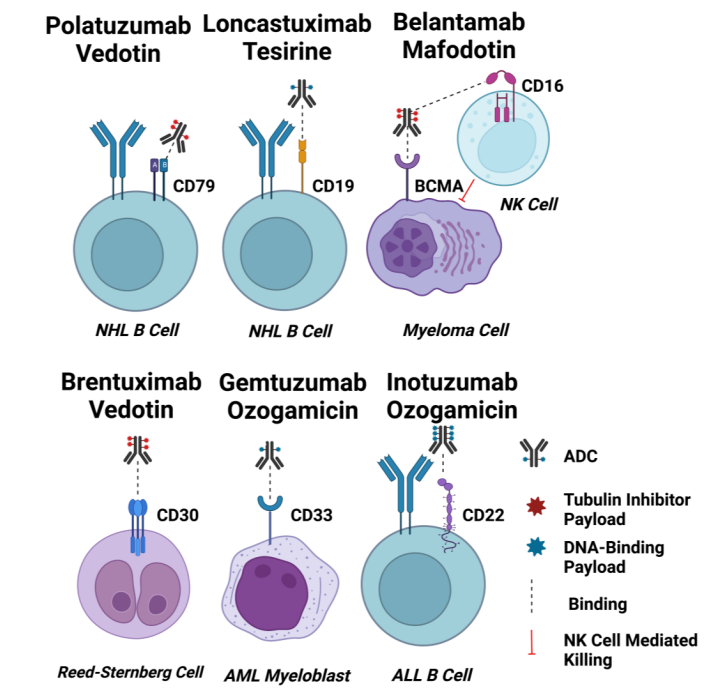
CD33
CD33是一种67kda跨膜糖蛋白受体,是唾液酸结合免疫球蛋白样凝集素(SIGLEC)家族成员,通常在正常髓系细胞上表达,由于其在AML细胞上优先过表达,是Gemtuzumab ozogamicin的靶点。CD33的胞内免疫受体酪氨酸基抑制基序(ITIM)调节CD33的内吞作用,可通过网格蛋白介导的内吞作用(CME)激活内吞作用。关于内吞效率,AML细胞中CD33的表达水平与其内吞率之间没有相关性。CD33是一种缓慢内化的抗原,此外,CD33交联并不能改善内吞作用。对GO无响应的AML患者可能与CD33受体内吞的功能低下有关。
CD22
CD22是一种140 kDa的跨膜糖蛋白,与CD33一样,它也是Siglec家族的成员,并与该家族共享多种结构特征。关键的区别在于CD22比CD33大得多,因为它有多个Ig结构域和ITIM/ITIM样基序。CD22的表达仅限于B细胞,CD22在各种B细胞恶性肿瘤(包括ALL)的大多数母细胞中表达水平升高。
CD22通过CME进行内吞作用。类天然配体通过CD22的结构性快速内吞在细胞内积聚。这些配体在溶酶体中被分类降解,而CD22则循环回到细胞表面。此外,CD22配体诱导的内吞激活细胞内池,补充或增加细胞表面CD22的表达水平。因此,CD22对ADC具有良好的内吞特性。
CD19
CD19被认为是一种泛B细胞标志物,也是成熟B细胞表面多分子复合物的主要信号传导成分。CD19的表达在大多数B细胞恶性肿瘤中高度保守,此外CD19具有快速内化动力学,不会脱落到循环中,使其成为理想的ADC靶抗原。
CD79b
CD79b仅在未成熟和成熟的B细胞中表达,在恶性肿瘤≥80%的B细胞中过表达。CD79a和CD79b是两种非共价结合的跨膜蛋白,介导信号传导和内吞作用。对于后者,CD79a-CD79b异二聚体是控制BCR内吞的支架。BCR内吞作用主要由CME完成,并由AP-2介导。有趣的是,CD79a直接与AP-2的μ亚单位相互作用,进而激活CD79b并导致整个BCR复合物的内吞。
此外,对于ADC来说,CD79a可以作为单体内化,但CD79b却不能。如果CD79b的近端膜酪氨酸(Y195)发生突变,AP-2与CD79a的结合就会被阻断,内吞也被阻断。在18%的活化B细胞样DLBCL标本中,Y195发生突变。总之,有证据表明CD79b其内吞活性依赖于整个BCR复合体的内化,而不是作为单体的内化。
BCMA
BCMA或CD269,也称为TNFR超家族成员17,转导诱导B细胞存活和增殖的信号。BCMA的分子量仅为20.2 kDa,其配体结合的胞外区域具有“臂椅”构象,由六个CRD组成。除了多发性骨髓瘤外,BCMA还表达于许多血液系统恶性肿瘤,如霍奇金淋巴瘤和非霍奇金淋巴瘤。
然而,关于BCMA所利用的精确内吞途径的知之甚少。与内吞作用有关,唾液酸化是一种调节功能,它可能诱导BCMA利用CME发生内吞作用。
CD30
CD30是一种120kda跨膜糖蛋白,属于肿瘤坏死因子受体(TNFR)超家族。其细胞外部分由六个扩展构象的富含半胱氨酸的结构域(CRD)组成。CD30在活化的T细胞和B细胞以及各种淋巴肿瘤(包括霍奇金淋巴瘤和ALCL)上表达。
CD30不具有内吞作用,相反,它因蛋白水解裂解而脱落,CD30的脱落由基质金属蛋白酶(MMPs)介导。脱落是CD30生物学的一个特征,高浓度的循环可溶性CD30可以作为监测肿瘤进展的血清标志物。对于ADC的疗效,升高的CD30循环水平似乎会隔离注射的ADC,从而减少能够定位于CD30阳性肿瘤部位的ADC的数量。因此,缺乏内吞作用的结果表明CD30不是理想的ADC靶点。
实体瘤的ADC靶点
设计用于治疗实体瘤的ADC针对一系列抗原,这些抗原通常包括可能与促肿瘤途径有关的肿瘤相关膜蛋白或受体。迄今为止,FDA批准用于治疗实体瘤的ADC靶向包括HER2、TROP2、Nectin-4、FRα和TF。
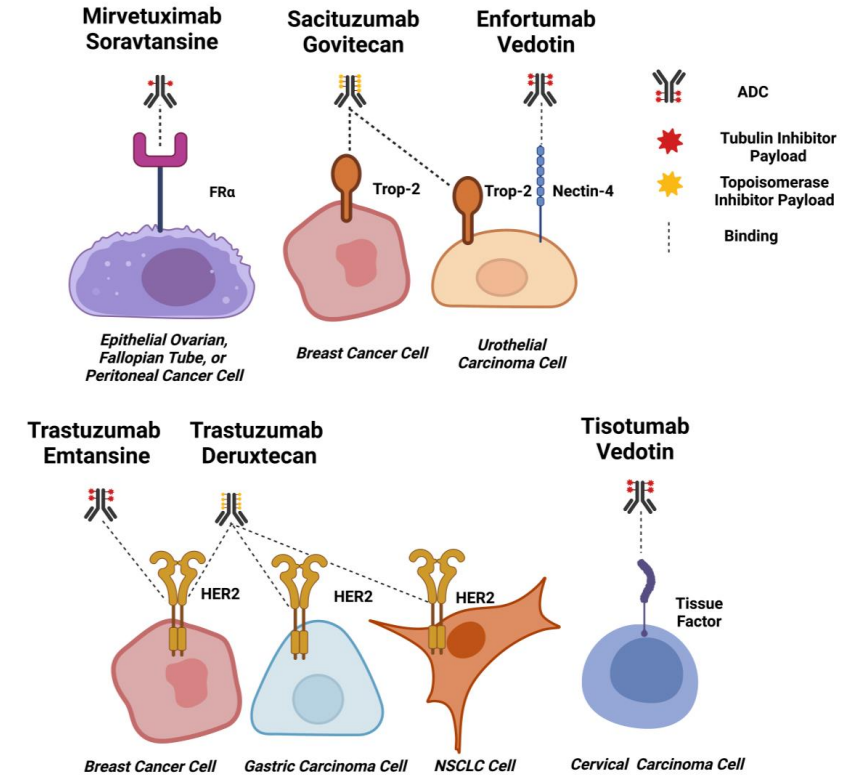
HER2
HER2是一种185kda跨膜糖蛋白,属于EGFR家族。HER2/neu基因的扩增是已知的人类恶性肿瘤和转移的驱动因素。由于HER2在癌症中的作用,几十年来一直被作为治疗靶点。HER2也一直是ADCs的靶点,T-DM1和T-DXT都被批准用于HER2阳性转移性乳腺癌患者。
HER2的内吞存在多种机制,首先是CME,共免疫沉淀清楚的显示HER2直接与AP-2结合,此外,dynasore能完全阻断SKBR3细胞的HER2内吞作用。另外,有研究证明HER2可以利用小窝介导的内吞途径和CLIC/GEEC的内吞途径。
TROP-2
Trop2是一种46kDa的单体糖蛋白,具有选择性过表达、结构性内吞作用和导向溶酶体等特性,使其成为ADC的一个非常有吸引力的靶点。Trop2的内化机制与CME有关。
此外,Trop2与多种配体结合,如claudin-1、claudin-7、cyclin D1和IGF1,然而,这些配体都没有证明在与Trop2结合或相互作用时被内化。因此,与正常细胞相比,Trop2在肿瘤细胞中发生的内吞作用更为强烈,这些都表明Trop2是ADC的一个很好的靶点。
Nectin-4
Nectin-4是一种66 kDa 的I型跨膜蛋白,其主要作用是促进细胞间的接触。Nectin-4作为ADC靶点很有吸引力,因为研究表明,它在几种肿瘤类型中过表达,但在正常成人组织中几乎不存在。
目前,没有发现天然配体或mAb/ADC与nectin-4的复合物内吞的信息,但是可以借鉴nectin-4结合病原体内吞的研究。Nectin-4也是麻疹病毒的受体,研究表明,麻疹病毒通过巨胞饮作用进入MCF7、HTB-20乳腺癌和DLD-1结直肠癌细胞。病毒进入需要PAK1,相反,dynamin抑制剂Dynasore对病毒进入没有影响。此外,表达显性负性小窝蛋白的细胞并不能消除病毒的内吞作用。基于这些间接研究,nectin-4表现出病毒受体所需的强大的内吞活。
TF
TF(组织因子),也称为凝血活酶因子III或CD142,是一种具有促凝血活性的跨膜糖蛋白,具有与蛋白水解酶因子VIIa(FVIIa)复合诱导细胞内信号传导的能力。TF被认为通过调节细胞生存、增殖、转移和血管生成的FVIIa依赖性细胞内信号通路促进癌症进展。由于缺氧诱导的信号传导,它在各种实体瘤和肿瘤血管系统中上调。
这种抗原的内化特性是开发TF靶向ADC的理想选择。此外,已报道的TF-FVIIa介导的表面TF表达诱导的机制,其中TF-FVIIa复合物的形成导致TF从高尔基体释放,然后运输到膜,导致细胞表面TF表达增强。如果这种作用可以由抗TF ADC诱导,那么这可以允许重复靶向表达TF的恶性细胞。
FRα
FRα(叶酸受体α)是一种膜结合代谢叶酸受体,参与叶酸的细胞内运输。一旦与叶酸结合,受体-配体复合物通过非经典的脂筏内吞机制内化。FRα在卵巢癌、乳腺癌、子宫内膜癌、间皮瘤和肺癌中高表达,而在正常细胞中几乎不表达,使得该受体非常适合ADC靶向。
此外,FRα被认为通过与叶酸结合来辅助促肿瘤信号传导,诱导下游效应,如STAT3的激活、FRα的细胞内转运以作为促生长途径的转录因子,以及叶酸的细胞内运输用于DNA生物合成。
小结
对于ADC选择针对实体瘤和血液瘤的靶抗原,可能需要考虑几个因素:包括(1)抗原在肿瘤和健康组织中的表达程度;(2)抗原在正常细胞和肿瘤细胞中的生理功能;(3)抗原的内吞特性和内吞机制;(4)抗原是否、在何处以及如何脱落,脱落对ADC有效性的潜在影响;(5)抗原循环及其对ADC作用机制的影响。
深入了解靶抗原的这些属性,并且仔细考量抗原的选择可能如何影响ADC性能的其他方面,将有助于我们设计用于治疗实体瘤和血液瘤临床安全、有效的最佳ADC。
参考文献:
1.Target Antigen Attributes and Their Contributions to Clinically Approved Antibody-Drug Conjugates (ADCs) in Haematopoietic and Solid Cancers. Cancers (Basel).2023 Mar; 15(6): 1845.
2. Impact of EndocytosisMechanisms for the Receptors Targeted by the Currently Approved Antibody-DrugConjugates (ADCs)—A Necessity for Future ADC Research and Development. Pharmaceuticals(Basel). 2021 Jul; 14(7): 674.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













前往app查看评论内容
0 0