Adv Sci:郭鹏/何大维/杨柳等合作发现表观遗传重编程增强临床前黑色素瘤模型中的ICAM1抗体药物偶联物
2024-06-18 iNature iNature 发表于上海
该研究对ADC和表观遗传药物地西他滨(DAC)(一种临床批准的DNA甲基化抑制剂)在多种黑色素瘤临床前模型中的协同作用进行了专门研究。
抗体药物偶联物(ADC)与其他靶向治疗药物联合的治疗益处和潜在的生物机制在很大程度上是未知的。
2024年6月14日,中国科学院杭州医学研究所郭鹏、重庆医科大学何大维、浙江省人民医院张鹏及杨柳共同通讯在Advanced Science 在线发表题为“Epigenetic Reprogramming Potentiates ICAM1 Antibody Drug Conjugates in Preclinical Models of Melanoma”的研究论文,该研究对ADC和表观遗传药物地西他滨(DAC)(一种临床批准的DNA甲基化抑制剂)在多种黑色素瘤临床前模型中的协同作用进行了专门研究。
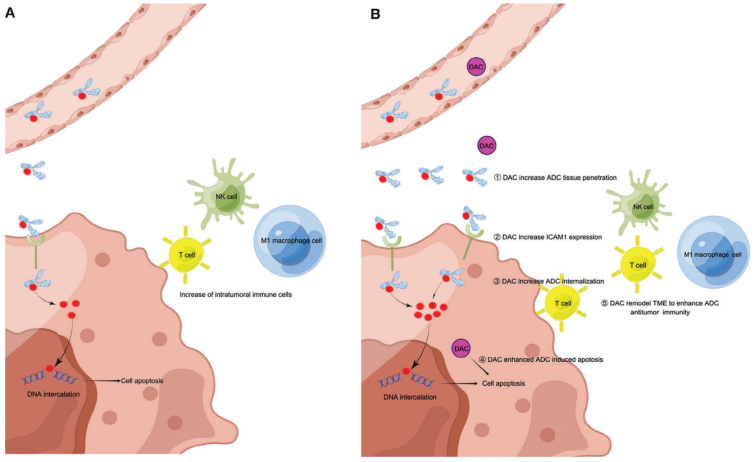
从机制上讲,DAC如何与ICAM1抗体偶联DNA拓扑异构酶I抑制剂DXd (I1-DXd)协同作用的潜在生物机制被阐明。DAC治疗通过上调抗原表达、增强抗体内化和通过黑色素瘤的表观遗传重编程增强肿瘤敏感性,显著增强了I1-DXd的抗肿瘤疗效。同时,I1-DXd/DAC联合还通过增强固有免疫细胞和适应性免疫细胞的肿瘤浸润,提高ADCs的渗透,增强抗肿瘤免疫,对肿瘤微环境(tumor microenvironment,TME)发挥调节作用。该研究为实体瘤治疗提供了一种合理的ADC联合策略

抗体-药物偶联物(ADCs)是一种新兴的治疗药物,对各种难治性和转移性实体瘤具有优异的疗效。ADC可以通过将有效载荷与肿瘤归巢的单克隆抗体共价偶联,特异性地将高细胞毒性有效载荷传递给表达靶标的癌细胞。先前开发抗黑色素瘤ADCs的尝试包括靶向内皮素B受体(ETBR)的DEDN6526A和靶向跨膜糖蛋白NMB (GPNMB)的glembatumumab vedotin。在之前的研究中,通过无偏性和定量筛选,细胞间粘附分子1(ICAM1)被确定为黑色素瘤的有希望的细胞膜靶点。ICAM1是一种I型膜结合糖蛋白,属于免疫球蛋白(Ig)超家族。此外,ICAM1的高表达也与黑色素瘤的不良预后和耐药(包括BRAF/MEK抑制剂)相关。之前的研究报道了ICAM1 adc在消融包括三阴性乳腺癌和间变性甲状腺癌在内的多发性难治性实体肿瘤中是有效的。
更重要的是,为了获得更持久的疗效和更高的疗效,ADC与其他抗癌药物联合治疗有望通过增强ADC治疗,为难治性肿瘤提供协同或附加效益。一个有希望的机会是针对非突变的表观遗传肿瘤微环境,这是癌症的一个标志,在癌症的发生和进展中起重要作用。为了解决这个问题,研究人员使用29个经过验证的化学探针库对黑色素瘤细胞进行了无偏筛选,这些探针选择性地靶向不同的表观遗传调节因子。根据筛选结果,研究人员确定了DNA甲基化(DNMT)抑制剂地西他滨(DAC),FDA批准的通过DNMT失活的特异性低甲基化药物)作为ADC联合治疗的潜在合作药物。
机理模式图(图源自Advanced Science )
该研究报告了两种不同的ICAM1-ADC在临床前黑色素瘤模型中的单药疗效。研究人员为开发有前途的黑色素瘤靶向治疗的ADC候选药物提供了重要的见解。此外,该研究还揭示了DAC可以增强ICAM1-ADC的抗肿瘤功效,具有不同的机制。这些发现为 ICAM1-ADC 作为黑色素瘤的候选药物和寻求DAC 作为联合合作伙伴提供了支持性理由。这种组合还可以为基于ADC的治疗其他难治性恶性肿瘤开辟一条新途径。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202400203
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#黑色素瘤# #抗体药物偶联物#
62