NAT COMMUN:神兽”的抗体果然神奇!研究发现,羊驼抗体能“绑定”在SARS-CoV-2上,有效阻止其感染宿主
2020-09-09 生物探索 生物探索
《自然-通讯》:羊驼纳米抗体能有效中和SARS-CoV-2。
最近,世界多国都出现了新冠肺炎二次感染的病例。虽然新冠疫苗和药物的研制进行得如火如荼,许多“候选人”也已进入临床试验,但目前为止效果并不明显。因此,科学家另辟蹊径,转而瞄准了羊驼的抗体。
9月4日,来自瑞典斯德哥尔摩卡罗林斯卡研究所的科学家在《Nature Communications》上发表了他们的最新研究:羊驼纳米抗体可以通过阻断受体相互作用来中和SARS-CoV-2。
羊驼的抗体为何如此优秀?
作为特定疗法的候选者,羊驼来源的单结构域抗体片段(也称为VHH或纳米抗体)相对于传统抗体具有多种优势。它们的大小约为常规抗体的十分之一,却保留与常规抗体相似的特异性和亲和力,且更易于克隆、表达和操作。这种抗体可以在细菌中大量表达,并显示出较高的热稳定性和溶解性,使其易于大规模生产并降低成本。
此外,它们可以低聚来增加亲和力或延长血清半衰期,这对于其在人类中作为抗病毒药的用途至关重要。更重要的是,它们已被证明是体内病毒感染的高效抑制剂,特别是呼吸道感染,而且通过现有方案就能轻松将其人源化。
羊驼抗体能中和SARS-CoV-2吗?
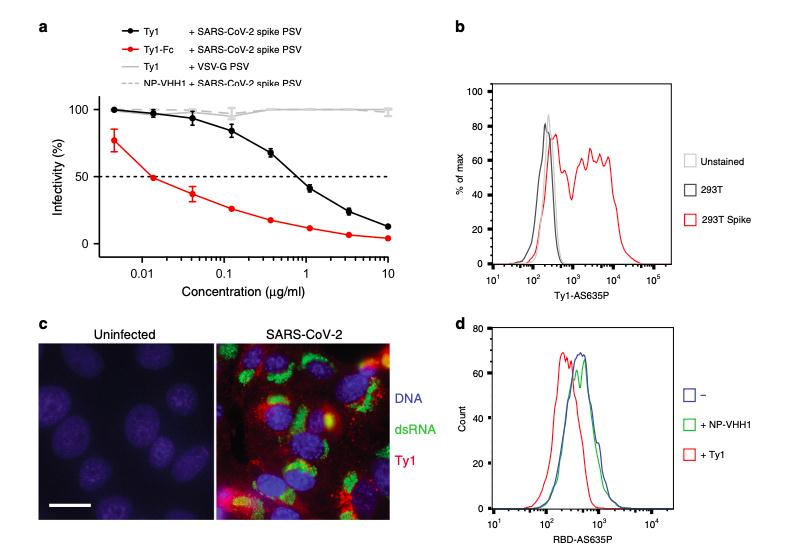
研究人员首先从被免疫的羊驼中分离出一个能特异性结合SARS-CoV-2刺突蛋白受体结合域的纳米抗体——Ty1。随后,他们用SARS-CoV-2刺突蛋白假型化的慢病毒颗粒进行了体外中和实验。结果显示,Ty1 以0.77 μg / ml(54 nM)的IC 50值中和SARS-CoV-2假型病毒。当Ty1以Fc融合蛋白的形式在哺乳动物细胞中表达时,有效的中和抗体可能会进一步提高至?12 ng / ml。
通过表征Ty1的特异性,研究人员发现,Ty1以其天然构象在SARS-CoV-2感染的细胞中以高度特异性识别了病毒刺突蛋白。实验中的低背景也说明,Ty1是一种高度特异性且适用于研究、诊断和治疗的工具。
Ty1通过与SARS-CoV-2刺突蛋白结合来中和SARS-CoV-2
羊驼抗体如何中和SARS-CoV-2?
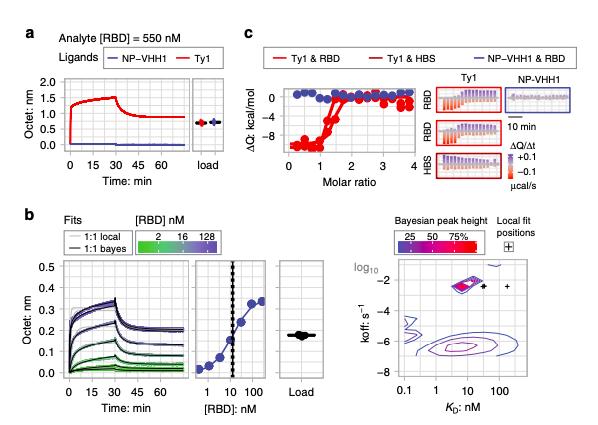
为了了解中和机制,研究人员评估了Ty1对SARS-CoV-2受体结合域(RBD)与受体血管紧张素转换酶2(ACE2)结合的影响。实验结果表明,Ty1直接阻止RBD与其宿主细胞受体ACE2的结合。而Ty1与RBD的特异性和高亲和力结合也在动态生物膜层干涉(BLI)实验中得到证明:Ty1以大约5-10 nM的高亲和力与RBD结合。
RBD以5-10 nM 的K D与Ty1结合
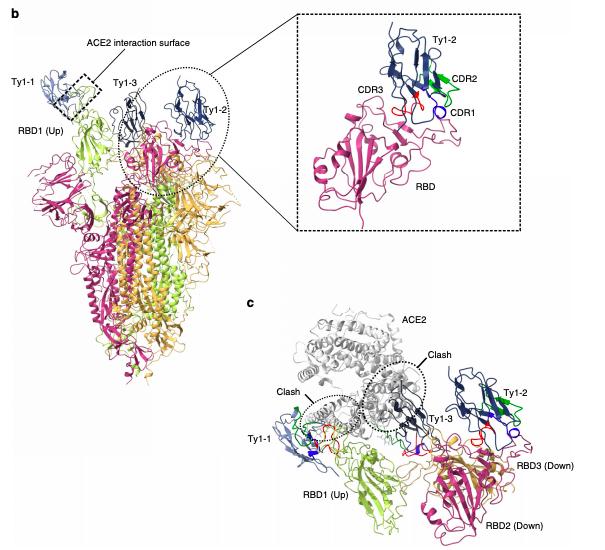
为了解有效中和SARS-CoV-2的结构基础,研究人员使用冷冻电镜对与Ty1形成复合体的融合前稳定的SARS-CoV-2刺突胞外域进行了结构测定。结果发现,Ty1以“向上”和“向下”的构型绑定到病毒的RBD上,而且,无论RBD构型是“上”还是“下”,纳米抗体都保持与RBD相似的结合方向。
Ty1以“向上”和“向下”构型结合到RBD并阻止ACE2接合
由于宿主细胞受体ACE2仅能以“向上”的构象与RBD结合,因此,SARS-CoV-2与ACE2的结合之路在两个侧面都受到了空间阻碍。简而言之,ACE2与病毒RBD的结合位置被“向上”构象和“向下”构象的Ty1纳米抗体侵占了。因此,在尖峰三聚体中,可用的三个RBD结合位点中的任何两个都充分阻碍了病毒与宿主细胞受体的结合。
总结而言,这项研究证明了羊驼纳米抗体通过阻断病毒与宿主细胞受体间的相互作用起到中和SARS-CoV-2的作用。因此,Ty1有望进入抗病毒的候选药物名单。
原始出处:
Hanke, L., Vidakovics Perez, L., Sheward, D.J. et al. An alpaca nanobody neutralizes SARS-CoV-2 by blocking receptor interaction. Nat Commun 11, 4420 (2020). https://doi.org/10.1038/s41467-020-18174-5.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#羊驼#绝对是神兽,能直接产生#纳米抗体#。在羊驼外周血液中存在一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(VHH)和两个常规的CH2与CH3区,但却不像人工改造的单链抗体片段 (scFv) 那样容易相互沾粘,甚至聚集成块。更重要的是单独克隆并表达出来的VHH结构具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,是已知的可结合目标抗原的最小单位。VHH晶体为2.5nm,长4nm,分子量只有15KDa,此也被称作纳米抗体(Nanobody, Nb)
122
#SARS-CoV#
75
#Nat#
72
#体能#
101
#研究发现#
75
#COMMUN#
60
#SARS#
103
#宿主#
50
学习了
121
学习了,谢谢分享
144