于金明:肿瘤免疫治疗十大挑战
2020-09-26 欣小琦 医学论坛网
肿瘤内科治疗进展的三次革命,依次为以细胞周期为主的化疗,以基因突变为主的靶向药物,以免疫逃逸为主的免疫治疗。免疫治疗在非小细胞肺癌治疗中是全程不可或缺的,但也面临着十大现实挑战。
可能很多人不太熟知,能够被载入史册的医学革命共有十一项,从最早1895年伦琴发现X射线到最近2010年的免疫DC疫苗,它们具有两大共同点,那就是科技创新、跨界融合。回归到肿瘤内科治疗进展的三次革命,依次为以细胞周期为主的化疗,以基因突变为主的靶向药物,以免疫逃逸为主的免疫治疗。
对于免疫治疗,在9月20日召开“第23届全国临床肿瘤学大会暨2020年CSCO学术年会”肺癌专场上,山东省肿瘤医院院长于金明院士认为,它如同当年的青霉素虽未解决全部感染问题,却开启了一场轰轰烈烈的抗生素革命一般,免疫治疗、免疫联合治疗(IO+)必将颠覆肿瘤的传统治疗理念,对肿瘤治疗产生革命性贡献。?
不得不承认,免疫治疗在非小细胞肺癌治疗中是全程不可或缺的,但也面临着十大现实挑战。
1. 肿瘤异质性是精准免疫治疗面临的挑战
肿瘤异质性存在于患者间、肿瘤间和肿瘤内三个层面,还可细分至DNA、RNA、蛋白三个水平。它主要源于微环境的差异等因素,近年研究探讨了肿瘤免疫抑制性多元化的驱动因素。
2. 原发性、适应性及获得性耐药是最大挑战
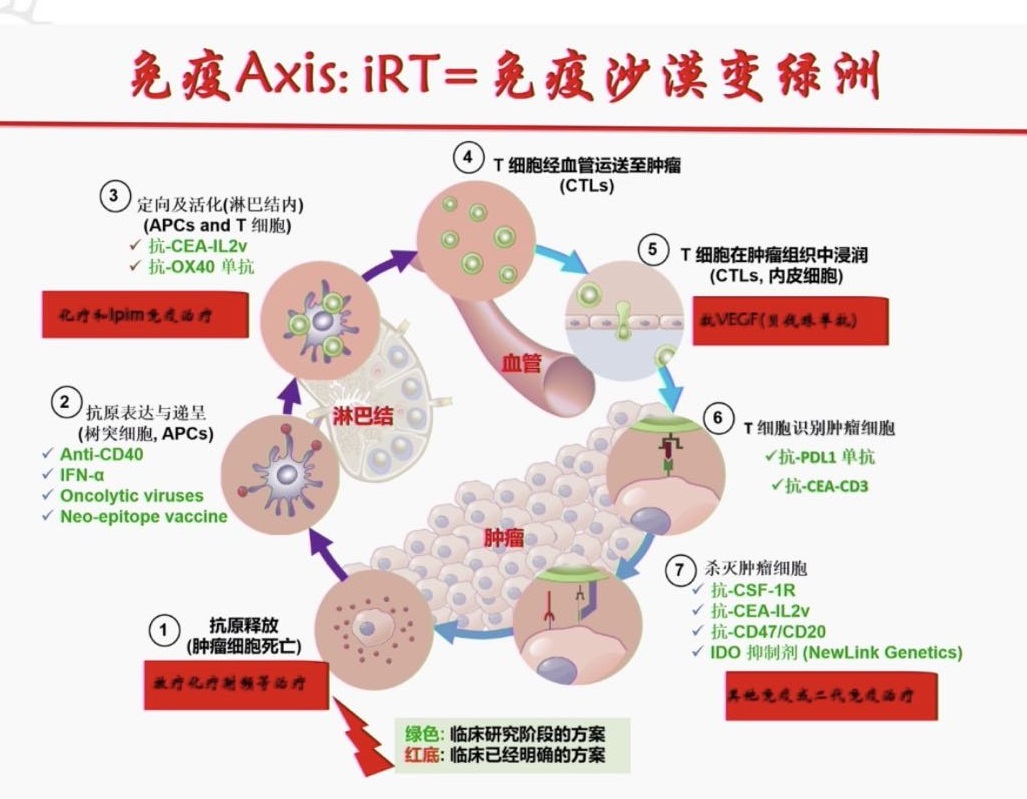
不管是内源性还是外源性耐药机制,迄今仍没有澄清。目前,临床主要面临三个实践难题
原发性耐药:肿瘤内因因素耐药,或无相关抗原及抗原少,不被免疫系统识别;
适应性耐药:可被免疫系统识别,但通过适应性免疫抑制,阻断免疫细胞杀伤;
获得性耐药:肿瘤异质性导致存在耐药克隆亚群,或因治疗后出现耐药克隆。
怎么办?免疫治疗要联合抱团取暖,即IO+X,X包括化疗、手术治疗、放疗、血管靶向治疗、其他免疫治疗甚至EGFR-TKI(表皮生长因子受体-酪氨酸激酶抑制剂),目的就是要延缓或克服耐药并提高疗效、早显效。
3. 明确多重生物标志物与预后的关系并实现个体化精准免疫
生物标志物的预后评价尚无法统一,现已知,PD-1表达越高者的长期生存越高,但75%的非长期获益者来自于早期治疗有效患者;放疗后的绝对淋巴细胞计数(ALC)能够显着预测远隔效应,而立体定位放疗可更好地保护淋巴细胞、保护淋巴结、保护骨髓。
我们知道,PD-1高表达对于免疫治疗是好的,但是放疗与免疫治疗联合之后还能一如既往吗?完全不同!反而是PD-1地表达者(1%~49%)更能从中受益。这就需要临床医生继续通过组织学、液体活检、分子影像个体化探索免疫治疗疗效和免疫损伤。
4. 临床前模型的临床免疫转化能力有限
目前临床前模型都是靠老鼠,与人体自然十几年几十年肿瘤的发生发展完全不一样,无法完全反映人体的真实免疫情况。同样,基因工程小鼠也存在不能解决的问题,如与人类癌症突变长期自然积累不同。
5. 理解特定器官的肿瘤免疫状况不够
肿瘤生长和转移与其脏器微环境有关,免疫治疗敏感性存在差异,如肝脏、骨髓对肿瘤免疫敏感性差,而肺脏、皮肤、淋巴结等对肿瘤免疫更有利。目前,在肿瘤的临床治疗上普遍没有考虑到器官的特异性治疗。
Checkmate 017/057研究显示,Nivolizumab二线治疗肺癌成功,而Checkmate-143研究证实其对复发性脑胶质母细胞瘤失败,未能改善患者生存。
6. 如何寻找免疫治疗更好的疗效评价标准面临挑战
免疫治疗虽好名单它的毒性远比其他化疗、靶向治疗复杂,目前很难或几乎无法很好预测。当前,RECIST v1.1在临床应用最为广泛,但对以下三个问题评估能力有限。
假进展:免疫治疗后病灶增大或出现新病灶,活检证实为坏死或炎性细胞浸润,随后肿瘤负荷又减小的现象。
超进展;免疫治疗后首次评估与治疗开始前比体积增加>50% & TGKR>2(治疗后/治疗前肿瘤增长动力学比);国外报道发生率为4%~29%,高于传统化疗。
疗效分离:表现在ORR、PFS、中位OS、年化OS等评价指标分离;二分离应答是指肿瘤治疗后一部分肿瘤体积增大,二另一部分肿瘤病灶体积缩小的现象。在非小细胞肺癌患者发生率为7.5%,其预后优于单纯进展,可考虑放疗。
近年,研究者在积极寻找预测免疫化疗后超进展的标志物,现认为年龄偏大、放疗过的照野内、基因组改变(MDM2扩增和EGFR突变)三个变量可能提示超进展可能。
7. 免疫治疗应用巩固和维持的时间尚无定论

8. O+X:免疫联合克服耐药作用机制的挑战
免疫联合的目的是要避免免疫显效慢、生存曲线早期交叉,提高免疫疗效。
抗肿瘤免疫节点颇多,未来最佳的免疫治疗方案并非单独某个疗法,两联治疗仍不足以攻克转移性非小细胞肺癌耐药问题。但免疫联合的多管齐下,可以调控多个环节克服耐药的机制仍不明确。所以,免疫联合不是“乱炖”不是简单的“排列组合”,而是需要循序、需要火候、需要配比、需要佐料的精准联合与优化:一是,实现疗效1+1≥2,而不是费用和毒性相加;二是,力争尽早显效,因为早显效者预后明显更好(KN001/003)。
那么,免疫联合放疗时不同药物的应用时间和顺序有何不同呢?
放疗+CTLA-4:先免疫再放疗,因为其作用在淋巴结,激活CD4+T并抑制Treg增加了PD-L1的释放;
放疗+PD-1/L1:免疫同步放疗,因为抗PD-1&PD-L1直接作用于肿瘤,所以推荐同时或稍后用;
放疗+OX40:先放疗再免疫,因为OX40激动剂放疗后用可最大程度诱导CD8+T细胞活化。
9. 化疗作用于增值快、靶向作用于受体表达细胞,免疫对正常组织损伤不清楚
免疫毒性,如果仅仅是免疫反应和过敏反应,应用激素就可以解决问题了。但临床仍不乏见到严重并发症,因此可能还存在脱靶和其他的原因。
毒性反应主要攻击四大脏器,它们是心脏、甲状腺、小肠和垂体,主要致死性副作用是心肌炎、肺炎、肠炎、肝炎,其损伤机制不尽相同,各类药物程度也千差万别。
10. 类固醇和抗生素对免疫治疗的影响及挑战
临床肿瘤医生,需要认真衡量免疫治疗中的应用类固醇、抗生素的利弊,切不可长期用、大量用、广谱用,以免对患者造成更大伤危害。
结语:
“免疫治疗”的前途是光明的,道路是曲折的,但要创新、要融合、要转化。治愈肿瘤的未来是什么,是“免疫联合”,仍需在免疫联合放化疗等其他治疗,多靶点和更强靶点的免疫,探讨免疫治疗预测标志物三个方面加力前行。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言