【指南与共识】| 抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)
2024-02-12 中国癌症杂志 中国癌症杂志 发表于陕西省
本共识旨在进一步在上海地区积极、合理、规范、全程地预防和处理AINV,保障患者的治疗强度和医疗安全。
[摘要] 恶性肿瘤患者在接受化疗、放疗、靶向治疗及免疫治疗等抗肿瘤治疗时都可能引发恶心呕吐。化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV)是最为常见也是目前研究最为深入的不良反应;放疗所致恶心呕吐(radiation-induced nausea and vomiting,RINV)、靶向治疗及免疫治疗所致恶心呕吐(targeted therapy and immunotherapy-induced nausea and vomiting,TIINV)也越来越受到关注。本专家组在《化疗所致恶心呕吐全程管理上海专家共识(2018年版)》的基础上,根据近年来抗肿瘤治疗所致恶心呕吐(antineoplastic-induced nausea and vomiting,AINV)领域的循证医学新证据,结合上海一线肿瘤治疗专家的实际临床经验,最终形成《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》,以便进一步在上海地区积极、合理、规范、全程地预防和处理AINV,保障患者的治疗强度和医疗安全。
[关键词] 抗肿瘤治疗;恶心;呕吐;全程管理;共识
[Abstract] Nausea and vomiting are common adverse reactions in tumor patients during anti-tumor therapy such as chemotherapy, radiotherapy, targeted therapy and immunotherapy. Although chemotherapy-induced nausea and vomiting (CINV) is the most common and the most intensively studied adverse event, radiation-induced nausea and vomiting (RINV), targeted therapy and immunotherapy-induced nausea and vomiting (TIINV) have also attracted more and more attention. Based on “Shanghai expert consensus on whole-process management of chemotherapy-induced nausea and vomiting (2018 edition)”, as well as new medical evidence of antineoplastic-induced nausea and vomiting (AINV) and experience of Shanghai experts in this field, the expert group finally developed “Shanghai expert consensus on whole-process management of antineoplastic-induced nausea and vomiting (2024 edition)”. This consensus will guide doctors in Shanghai to standardize the whole-process management of AINV, and to ensure the treatment intensity and medical safety of patients.
[Key words] Antineoplastic; Nausea; Vomiting; Whole-process management; Consensus
《《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》
专家组
专家组组长
-
胡夕春 | 复旦大学附属肿瘤医院
-
张 剑 | 复旦大学附属肿瘤医院
专家组成员
(按姓名汉语拼音排序)
-
陈思宇 | 上海交通大学医学院附属新华医院
-
董宇超 | 海军军医大学第一附属医院
-
郭伟剑 | 复旦大学附属肿瘤医院
-
郭雪君 | 上海交通大学医学院附属新华医院
-
高 勇 | 同济大学附属东方医院
-
胡夕春 | 复旦大学附属肿瘤医院
-
姜 斌 | 上海交通大学医学院附属第九人民医院
-
梁晓华 | 复旦大学附属华山医院
-
刘天舒 | 复旦大学附属中山医院
-
刘苓霜 | 上海中医药大学附属龙华医院
-
李 琦 | 上海交通大学医学院附属第一人民医院
-
李恒宇 | 海军军医大学第一附属医院
-
李 婷 | 复旦大学附属肿瘤医院
-
秦悦农 | 上海中医药大学附属龙华医院
-
区晓敏 | 复旦大学附属肿瘤医院
-
沈 赞 | 上海交通大学医学院附属第六人民医院
-
唐 曦 | 复旦大学附属华东医院
-
王理伟 | 上海交通大学医学院附属仁济医院
-
章 真 | 复旦大学附属肿瘤医院
-
张 剑 | 复旦大学附属肿瘤医院
-
张 俊 | 上海交通大学医学院附属瑞金医院
-
周彩存 | 同济大学附属上海市肺科医院
-
臧远胜 | 海军军医大学第二附属医院
-
湛先保 | 海军军医大学第一附属医院
-
钟 薏 | 上海市中医药大学附属上海市中西医结合医院
执笔人
-
张 剑 | 复旦大学附属肿瘤医院
-
李 婷 | 复旦大学附属肿瘤医院
恶性肿瘤患者出现脑转移、并发肠梗阻和水电解质紊乱,或给予手术、化疗、放疗、靶向治疗及免疫治疗等抗肿瘤治疗以及癌痛药物控制过程中都可能引发肿瘤患者的恶心呕吐。所有因抗肿瘤治疗引起的恶心呕吐可统称为抗肿瘤治疗所致恶心呕吐(antineoplastic-induced nausea and vomiting,AINV),其中化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV)是最为常见并且也是目前研究最为深入的,靶向治疗及免疫治疗所致恶心呕吐(targeted therapy and immunotherapy-induced nausea and vomiting,TIINV)也因精准治疗时代的到来越来越受到大家的关注,而放疗所致恶心呕吐(radiation-induced nausea and vomiting,RINV)的发生与照射部位、剂量、分割、照射体积和放疗技术等相关因素有关。AINV不仅会使患者脱水及代谢失衡,还会降低患者的自理能力,导致患者生理和心理状态下滑,更严重的会导致患者营养耗竭或产生厌食症,甚至发生食管撕裂和伤口开裂等严重后果,是患者拒绝后续抗肿瘤治疗的主要原因之一[1]。
虽然临床对AINV的关注程度逐渐提高,但在国内外临床实践中,对于相关指南的依从率仍有很大的提升空间。国外一项纳入45 324例患者CINV的真实世界研究[2]发现,使用AC方案(含蒽环类药物、环磷酰胺的联合方案)、含顺铂方案和含卡铂方案的患者,分别仅有24%、18%和7%使用了癌症支持疗法多国学会(Multinational Association of Supportive Care in Cancer,MASCC)/欧洲临床肿瘤协会(European Society for Medical Oncology,ESMO)指南推荐的三联止吐方案。国内也有类似研究,但样本量相对较小,有研究[3]回顾性分析某医院肿瘤科2019年7—12月收治化疗患者的止吐医嘱,依据国内外的化疗止吐指南,评价医嘱与指南的一致性,其中高致吐性和中致吐性化疗方案的止吐指南依从率分别为11.41%和53.89%。随着AINV越来越受到医师和患者的关注,无呕病房等一系列推动规范化化疗止吐预防项目的落地和开展,国内医院的指南依从率已有显著提高。2022年有研究[4]抽样调查了上海16家三级甲等医院共376例癌症患者数据,结果显示,2022年上海CINV管理与指南符合率较5年前有显著改善,特别对于高致吐风险人群,指南符合率从21.6%提升至67.0%。然而,RINV的发生率虽高达50%~80%,但往往会被医师低估或在临床实践中被忽略[5],一项纳入60例放疗患者的研究[6]中,仅28例(46.7%)在放疗前预防性给予了止吐药。随着靶向治疗和免疫治疗的广泛应用,TIINV也越来越受到关注,其虽比CINV和RINV的发生率低,但因临床实践中靶向治疗及免疫治疗常与放化疗联合使用,其所致恶心呕吐的不良反应仍不容忽视。
为进一步在上海地区积极、合理、规范、全程地预防和处理AINV,保障患者的治疗强度和医疗安全,在《化疗所致恶心呕吐全程管理上海专家共识(2018年版)》[7]的基础上,吸收了近年来AINV领域的循证医学新证据,结合上海一线肿瘤治疗专家的实际临床经验,部分参考其他最新颁布的指南与共识并广泛征求肿瘤治疗工作者的意见,最终形成《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册编号为PREPARE-2024CN253。
1 AINV概念及分类
AINV是指由抗肿瘤治疗引起或与抗肿瘤治疗相关的恶心[以反胃和(或)急需呕吐为特征的状态]和呕吐(胃内容物经口吐出的一种反射动作)。虽然两者通常同时出现,但也可能作为独立症状在抗肿瘤治疗过程中发生,其中恶心的发生频率相对更高[8]。按照致吐风险通常可分为高度、中度、低度及轻微。按照发生时间,CINV和TIINV通常可分为急性、延迟性、预期性、爆发性及难治性5种类型。急性恶心呕吐一般发生在给药后数分钟至数小时,并在给药后5~6 h达到高峰,但多在24 h内缓解。延迟性恶心呕吐多在给药24 h后发生,常见于顺铂、卡铂及环磷酰胺等化疗时,可持续数天,一般为2~5 d。预期性恶心呕吐是指患者在前一次给药时经历了难以控制的恶心呕吐后,在下一次给药开始前即发生的恶心呕吐。爆发性呕吐是指即使进行了预防处理但仍出现的呕吐,并需要进行拯救性治疗。难治性呕吐是指以往的给药周期中使用预防性和(或)拯救性止吐治疗失败,而在后续给药周期中仍然出现的呕吐(需除外预期性呕吐)。RINV可在治疗后24 h内(急性期)或治疗结束后2~10 d(延迟期)发生[9]。
在应用可致恶心呕吐的抗肿瘤治疗时,恶心呕吐是一种常见且令人畏惧的伴随症状,它是导致患者抗肿瘤治疗依从性下降的主要原因,恶心呕吐严重影响患者的生活质量、治疗实施和疗效,若控制不佳,会为临床工作和临床结局带来不良后果[7]。
2 CINV的全程管理
2.1 致恶心呕吐化疗的疗前管理
临床医师在为患者制订化疗方案后,可根据静脉或口服用药方案确定致吐风险等级(表1),适当参考患者高危风险因素和既往CINV的发生情况,为患者制订预防性止吐方案。CINV的疗前管理主要体现在急性恶心呕吐和延迟性恶心呕吐的预防上。



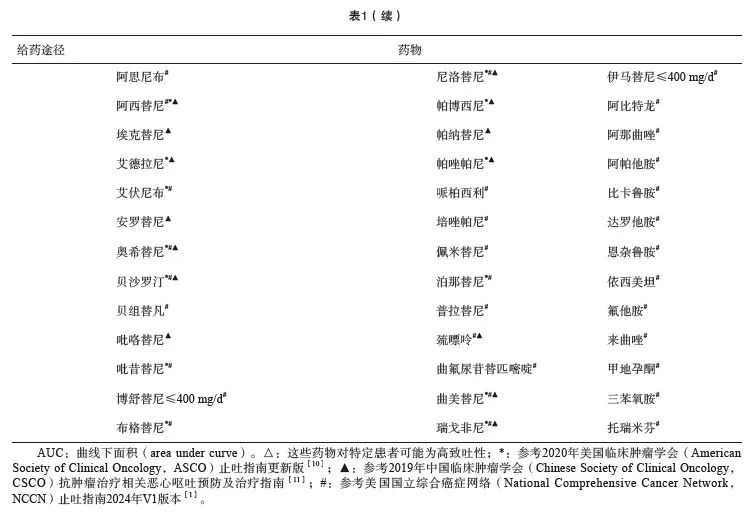
临床问题1:目前用于疗前评估的化疗药物致吐风险分级是否合理?
目前各大指南按照抗肿瘤治疗药物的给药方式和致吐风险将药物划分为不同致吐等级。将静脉给药的抗肿瘤药物分为高度、中度、低度和轻微4个致吐风险等级,>90%为高度致吐风险等级,30%~90%为中度致吐风险等级,10%~30%为低度致吐风险等级,<10%为轻微致吐风险等级。将口服给药的抗肿瘤药物分为中-高度致吐风险(呕吐发生率≥30%)和轻微-低度致吐风险(呕吐发生率<30%)两个等级[1,10-11]。
专家共识1:该分级在临床实践中非常实用,虽然个别药物的等级划分在不同指南中略有差异,但总体上为临床医师制订单药和联合化疗的止吐方案提供了有价值的参考。专家组也认为,多种化疗药物联合使用或采用化疗联合放疗等其他治疗手段时,患者发生恶心呕吐的风险不能完全参照单个化疗药物的致吐等级来判断,特别是多种非高度致吐风险药物联用时有可能提升患者恶心呕吐的风险。此外,除了考虑药物的客观致吐性之外,还应该考虑患者本身发生恶心呕吐的高危因素,通过药物致吐等级和患者本身高危因素的综合评估才能更好地判断患者发生恶心呕吐的风险。
临床问题2:高度致吐风险静脉化疗药物的推荐预防方案是什么?
自2014年NCCN指南首次将奥氮平纳入化疗止吐的推荐方案以来,临床使用奥氮平治疗CINV的研究逐渐增加。一项随机、双盲、安慰剂对照的多中心临床试验[12]纳入710例接受顺铂为基础化疗的患者,随机分成两组,分别使用5 mg奥氮平或安慰剂联合标准治疗方案[阿瑞匹坦+帕洛诺司琼+地塞米松(dexamethasone,DXM)],主要终点为完全缓解(complete response,CR)率(24~120 h无呕吐且无拯救性治疗),结果显示,奥氮平组患者的CR率为79%(95% CI:75%~83%),而安慰剂组患者的CR率为66%(P<0.000 1),提示5 mg奥氮平联合阿瑞匹坦、帕洛诺司琼、DXM可能成为接受以顺铂为基础的化疗患者新的标准止吐治疗方案[12]。而另一项治疗中国乳腺癌患者CINV的临床试验[13],将患者随机分配进入奥氮平组[奥氮平+神经激肽-1受体拮抗剂(neurokinin-1 receptor antagonist,NK-1 RA)+5-HT3受体拮抗剂(5-HT3 receptor antagonist,5-HT3 RA)+DXM]和标准治疗组(NK-1 RA+5-HT3 RA+DXM),在第1个周期使用阿霉素/环磷酰胺治疗的过程中,奥氮平组的CR(无呕吐且无拯救性治疗)率显著高于标准治疗组(总体期:65.0% vs 38.3%,P=0.003 5;急性期:70.0% vs 51.7%,P=0.039 7;延迟期:92.9% vs 74.2%,P=0.025 4),奥氮平组在全部3个时间段内“无明显恶心”和“无恶心”的发生率更高,患者的生活质量更佳。
奥氮平联合5-HT3 RA及DXM的三联方案在使用高度致吐及中度致吐风险化疗方案的患者中均被证实有较好的疗效,奥氮平总体安全性良好,但可能增加患者的嗜睡等不良反应。关于奥氮平的使用剂量仍有争议,有研究[14-15]显示,5和10 mg奥氮平对于CINV的疗效相似,且低剂量奥氮平的镇静效果也随之降低。另外一项单中心随机对照Ⅲ期临床研究[16]比较了低剂量2.5 mg奥氮平和10 mg奥氮平在高度致吐化疗方案的患者中的止吐效果,结果显示,2.5 mg组与10 mg组的疗效相似,但2.5 mg组患者的白天嗜睡情况明显改善。因此,奥氮平作为CINV预防用药可考虑睡前给药,使用过程中需要注意患者的嗜睡情况。如果患者在奥氮平5 mg剂量下出现过度镇静,则可以考虑减量至2.5 mg。相反,如果既往给予5 mg剂量无效,可以考虑将奥氮平的剂量增加至10 mg[1]。
上海一项多中心前瞻性临床研究[17]结果显示,对于既往接受AC方案或含有顺铂方案并出现延迟性恶心呕吐的乳腺癌患者,米氮平联合阿瑞匹坦、5-HT3 RA和DXM可显著改善延迟性恶心呕吐。此外,一项Ⅲ期临床研究[18]结果显示,沙利度胺联合帕洛诺司琼和DXM可有效预防既往未使用过化疗患者的延迟性恶心呕吐。因此,沙利度胺或米氮平均可考虑用于预防延迟性恶心呕吐。
专家共识2.1:对于高度致吐风险的静脉化疗方案,急性CINV优先推荐5-HT3 RA+DXM+NK-1 RA+奥氮平或5-HT3 RA/NK-1 RA复方制剂+DXM+奥氮平进行预防性止吐。备选方案包括5-HT3 RA+DXM+NK-1 RA或5-HT3 RA+DXM+奥氮平(表2,附录Ⅰ,专家共识度96%)。
专家共识2.2:对于高度致吐风险的静脉化疗方案,延迟性CINV优先推荐DXM+NK-1 RA+奥氮平,备选方案包括DXM+NK-1 RA或DXM+奥氮平进行预防性止吐(表2,附录Ⅰ,专家共识度91%)。
临床问题3:中度致吐风险静脉化疗药物的推荐预防方案是什么?
专家共识3.1:对于中度致吐风险的静脉化疗方案,急性CINV推荐5-HT3 RA+DXM±NK-1 RA或±奥氮平或5-HT3 RA/NK-1 RA复方制剂+ DXM进行预防性止吐(表2,附录Ⅰ,专家共识度96%)。
专家共识3.2:对于中度致吐风险的静脉化疗方案,延迟性CINV推荐DXM±NK-1 RA或±奥氮平进行预防性止吐(表2,附录Ⅰ,专家共识度96%)。
临床问题4:低度致吐风险静脉化疗药物的推荐预防方案是什么?
专家共识4.1:对于低度致吐风险的静脉化疗方案,急性CINV推荐5-HT3 RA或DXM或甲氧氯普胺或丙氯拉嗪进行预防性止吐(表2,附录 Ⅰ,专家共识度91%)。
专家共识4.2:对于低度致吐风险的静脉化疗方案,多数专家认为延迟性CINV无需常规预防(表2,专家共识度91%)。
临床问题5:轻微致吐风险静脉化疗药物的推荐预防方案是什么?
专家共识5:对于轻微致吐风险的静脉化疗方案,急性和延迟性CINV均无需常规预防 (表2)。

临床问题6:口服化疗药物也具有各种致吐风险,推荐预防方案是什么?
专家共识6.1:对于中-高度致吐风险的口服化疗方案,急性CINV推荐给予5-HT3 RA进行预防性止吐,其中5-HT3 RA推荐给予口服剂型,以增加患者给药的便利性和舒适性;延迟性CINV无需常规预防(表3,附录Ⅰ)。
专家共识6.2:轻微-低度致吐风险的口服化疗方案,急性和延迟性CINV均无需常规预防(表3)。

临床问题7:对于接受多日化疗方案的患者,推荐预防方案是什么?
有研究[19]显示,接受5 d顺铂化疗的患者,在第1天使用帕洛诺司琼,1~7 d使用阿瑞匹坦+DXM预防止吐,CR(0~240 h无呕吐且无拯救性治疗)率为62.5%。一项多中心Ⅱa期临床研究[20]纳入自体造血干细胞移植前接受多日、高剂量化疗的非霍奇金淋巴瘤患者,在第1、3、5天服用奈妥匹坦帕洛诺司琼胶囊预防恶心呕吐,全程未使用DXM预防恶心呕吐,研究观察持续到化疗后第15天,全程(第1~8天)的CR率为87.1%,完全控制率为85.7%。近期一项奥氮平四联方案用于多日化疗止吐的随机对照临床研究[21]结果显示,在三联的基础上增加5 mg奥氮平可以显著提高患者的CR率(69% vs 58%,P=0.031)。在几乎所有亚组中,奥氮平组相较于安慰剂组均观察到CR获益。因此建议4~5 d顺铂化疗的患者在5-HT3+NK-1 RA+DXM的基础上增加奥氮平,使用四联方案进行预防性止吐。
专家共识7:对于接受多日化疗方案的患者,化疗期间每天均具有急性或延迟性CINV风险,尤其在第1天化疗后至末次化疗,急性和延迟性CINV重叠,所以很难给出一个特定的止吐方案。建议从化疗的第1天至化疗结束的后两天每天预防给予止吐药物。在设计止吐方案时还需要考虑实际问题,如给药环境(住院患者或门诊患者)、首选给药途径(口服、透皮或注射)、5-HT3 RA的作用持续时间和适当的给药间隔、止吐药(如皮质类固醇)的耐受性、依从性和个体风险等因素[1](专家共识度87%)。
临床问题8:充分的疗前管理需要注意哪些恶心呕吐的高危因素?
CINV相关风险因素主要包括药物因素和患者自身因素两大类。所选择化疗药物本身的致吐等级是影响CINV最为重要的因素。但即便是同一种药物,由于药物剂量强度、剂量密度、输注速度和给药途径等不同,药物的致吐风险也不尽相同。剂量强度大、剂量密度高、输注速度快及静脉给药发生CINV的风险更高。与患者自身相关的风险因素也有很多,一项纳入49篇CINV相关文献的系统综述[22]分析了与患者相关的CINV风险因素,发现了7个与CINV显著相关的风险因素,包括恶心呕吐史[比值比(odds ratio,OR)=3.13,95% CI:2.40~4.07,P<0.05]、女性(OR=2.79,95% CI:2.26~3.44,P<0.05)、预期会发生CINV(OR=2.61,95% CI:1.69~4.02,P<0.05)、年龄较小(OR=2.59,95% CI:2.18~3.07,P<0.05)、焦虑(OR=2.57,95% CI:1.94~3.40,P<0.05)、孕吐史(OR=1.97,95% CI:1.46~2.65,P<0.05)和低乙醇摄入量(OR=1.94,95% CI:1.68~2.24,P<0.05)。其中恶心呕吐史是既往有抗癌药物所致恶心呕吐史,年龄较小是指年龄<60岁,预期会发生CINV是指患者使用化疗药物后认为自身会发生恶心呕吐的心理因素,低乙醇摄入量大多数文献定义为每周饮酒<5次或无酗酒史。除了上述因素外,NCCN指南指出容易晕车也是CINV的高危因素之一。此外还有研究[23-24]认为,肠道微生物菌群和基因多态性也可能是CINV的风险因素。伴有4~6种高危因素的患者即使在使用预防性止吐方案的前提下,仍有76%的患者会发生CINV,显著高于不伴有任何高危因素的患者(仅为20%)。
专家共识8:在使用中-高度致吐风险化疗方案且已行预防性止吐的人群中,可采集性别、年龄、饮酒史、孕吐史、前庭功能障碍、体表面积、化疗致吐风险及止吐方案等信息,尝试利用已有部分国内数据支持的列线图(图1)来个体化预测患者CINV的发生概率[25]。
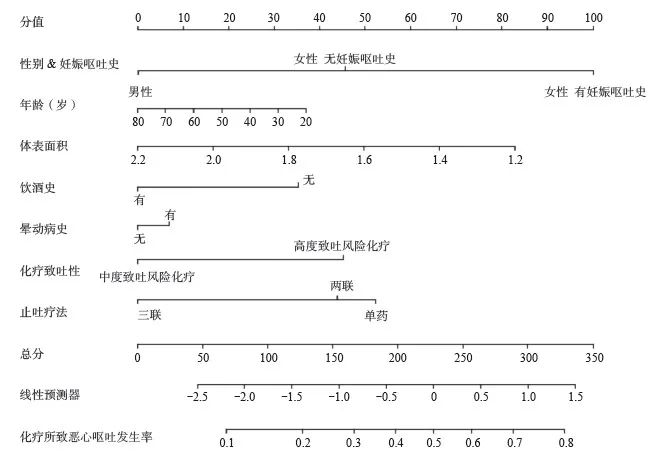
图1 数据列线图
临床问题9:临床医师在疗前与患者沟通恶心呕吐问题时需要包括哪些内容?
专家共识9:① 疗前建议收集和评估患者恶心呕吐高危因素、拟施行化疗方案致吐风险、既往和现存疾病情况(包括存在部分或完全性肠梗阻、前庭功能障碍、脑转移、电解质紊乱及尿毒症等)。目前根据以上信息制订止吐方案暂无统一标准,但建议具有高危因素和伴随疾病的患者止吐方案要适当强化。② 疗前建议责任医师与患者就以下内容进行谈话,5-HT3 RA、DXM、NK-1 RA、奥氮平、米氮平、劳拉西泮、甲氧氯普胺、丙氯拉嗪、异丙嗪、H2受体拮抗剂及质子泵抑制剂等是预防CINV的有效药物,医师会根据患者的高危因素、化疗方案致吐风险以及患者既往和现存疾病情况制订个体化的止吐方案;使用标准的止吐方案会使CINV的发生率大幅下降,但仍有部分患者需要拯救性治疗;止吐方案本身也有不良反应,常见的包括便秘、嗜睡、头晕/头痛、腹泻及失眠等,经对症处理后多可缓解。③ 疗前应与患者充分沟通AINV的危害和预防性给药的必要性,同时需告知患者预防性给药也不能保证100%控制恶心呕吐的发生,但绝大多数情况下可以降低恶心呕吐的发生率及严重程度,若预防给药后仍出现恶心呕吐,需使用拯救性治疗并考虑在下一个治疗周期调整止吐方案。
2.2 致恶心呕吐化疗的疗中管理
在临床实践中,即便使用指南推荐的预防性止吐治疗,仍然会有部分患者未能达到CR。有研究[12]显示,在接受以顺铂为基础化疗的患者中,使用奥氮平+NK-1 RA+5HT RA+DXM四联方案预防CINV,仍有21%的患者未能达到CR。而对于使用中度致吐风险化疗药物的患者,即便遵循指南推荐的CINV预防方案,仍有26.2%的患者未能达到CR[26]。同时止吐药物本身也会产生一系列的不良反应。因此,致恶心呕吐化疗(特别是周期性给药的化疗)的疗中管理也非常重要,主要体现在对于爆发性CINV和难治性CINV的处理以及对止吐药物不良反应的宣教和应对上。疗中产生爆发性CINV时,除了需要重新评估患者CINV风险因素外,还需要特别注意可能导致或加重患者恶心呕吐的其他影响因素,包括但不限于:部分或完全性肠梗阻,前庭功能障碍,脑转移,电解质紊乱(高钙血症、高血糖或低钠血症等),尿毒症,包括阿片类药物的合并用药,肿瘤或化疗药物(如长春新碱)或其他因素如糖尿病引起的胃轻瘫,分泌物过多(如头颈部癌症患者),恶性腹水,心理因素如焦虑或预期性恶心呕吐,大麻素剧吐综合征,快速的阿片类戒断症状,胰腺炎等[1]。
临床问题10:对于已经进行了预防处理但治疗中仍出现的呕吐推荐如何处理?
专家共识10:推荐立即重新审视该次的止吐方案,并重新评估药物致吐风险、疾病状态、并发症和治疗,注意各种非化疗相关性致吐原因,如脑转移、电解质紊乱、肠梗阻、肿瘤侵犯至肠道、其他胃肠道异常及其他合并症等。除对部分非化疗相关性致吐原因进行对因干预外,首先考虑临时增加一种不同类型的止吐药物,其次调整5-HT3 RA的给药强度和频率或换用另一种5-HT3 RA进行拯救性治疗亦可能有效。临床上,除5-HT3 RA外,如果患者之前方案中没有使用奥氮平,建议优先增加奥氮平拯救止吐[11,27]。如已使用了奥氮平建议增加其他拯救药物包括NK-1 RA、异丙嗪、丙氯拉嗪、甲氧氯普胺、劳拉西泮、氟哌啶醇、屈大麻酚、大麻隆、东莨菪碱、奥美拉唑、沙利度胺及针灸等。多数正在呕吐的患者口服给药难以实现,应优先考虑经直肠、局部、皮下或静脉给药方式;必要时选择多种药物联合治疗,同时可以选择不同的方案或不同的途径。当爆发性呕吐控制后,建议持续给药巩固一段时间,而非按需给药;当不能控制时,建议再次评估,并重新开始前述步骤,直至爆发性呕吐得到持续控制。治疗爆发性CINV远比预防CINV困难,更体现了充分疗前管理的重要性。
临床问题11:在疗中如何针对患者出现的止吐药物不良反应进行处理以及有哪些相关注意事项?
专家共识11:使用止吐药物会产生一定的不良反应。NK-1 RA的常见不良反应包括疲乏、无力和嗳气[28],同时需要注意NK-1 RA对DXM代谢的影响。接受5-HT3 RA的患者最常见的不良反应是便秘和头晕,第一代的5-HT3 RA还需要特别关注经校正的Q-T间期(corrected Q-T interval,QTc)延长的问题[29]。使用DXM可能会升高血糖,应考虑在治疗前和有临床指征时进行监测,建议糖尿病患者慎用[10]。使用奥氮平的患者易出现嗜睡、体位性低血压和便秘[30]。对于有摔倒风险的患者(如老年人、虚弱者)或有直立性低血压风险的患者应慎用奥氮平或考虑降低剂量[1]。另外静脉注射药物还需注意注射部位不良反应和静脉炎的发生[31]。以上不良反应,除需疗前宣教外,疗中也要加强与患者的沟通,特别是出现后推荐给予及时的心理疏导和对症处理。总体而言,止吐药物不良反应多数轻微且可控,如症状严重,除加强对症处理外,下个周期化疗时需对预防性止吐药物进行调整。
2.3 致恶心呕吐化疗的疗后管理
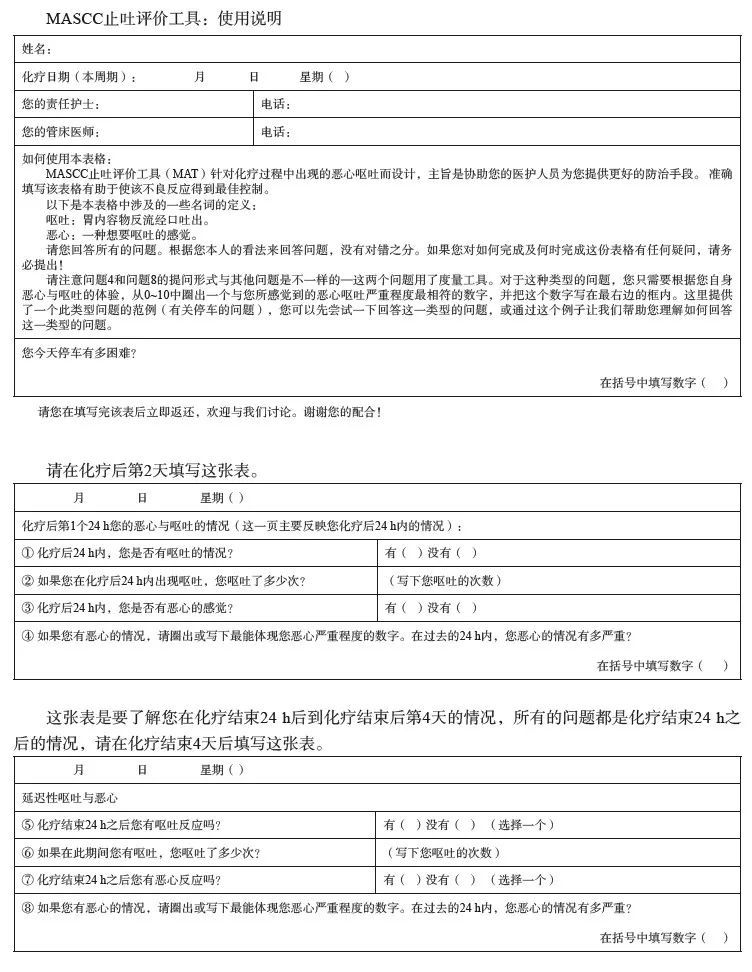
有研究[32]显示,第1个疗程经止吐治疗CR的患者在后续的治疗过程中更不易出现恶心呕吐。因此临床医师应以患者为中心,立足于循证医学,强调化疗第1个疗程第1天预防性给予止吐药物,并根据第1个疗程化疗后患者CINV的情况,进行综合评估指导后续止吐方案的制订。在根据第1个疗程化疗后患者出现CINV的情况调整后续止吐方案前,临床医师需要如实记录患者在第1个疗程进行预防性止吐治疗后的效果,包括恶心呕吐分级、是否达到CR、完全防护、全面控制以及是否需要拯救性治疗。由于恶心呕吐的主观性很强,为减少对患者CINV情况的低估,也可以采用患者自陈式CINV评估工具,如采用视觉模拟评分量表(visual analogue scale,VAS)的MASCC止吐评价工具(MAT),具体可参见附录Ⅱ。
疗后管理中使用的恶心呕吐分级有多种标准,如世界卫生组织(World Health Organization,WHO)、欧洲临床学术会议标准和美国国家癌症研究所-常见不良事件评价标准(National Cancer Institute-Common Terminology Criteria for Adverse Events,NCI-CTCAE)。临床上最常用的是NCI-CTCAE,目前已更新到5.0版本。其中恶心定义为以反胃和(或)急需呕吐为特征的状态,1级:食欲下降,不伴进食习惯改变;2级:经口摄食减少不伴有明显的体重下降、脱水或营养不良;3级:经口摄入能量和水分不足,需要鼻饲、全肠外营养或住院治疗。呕吐定义为胃内容物经口吐出的一种反射性动作,1级:无需进行干预;2级:门诊静脉补液,需进行医学干预;3级:需要鼻饲、全肠外营养或住院治疗;4级:危及生命;5级:死亡[33]。CR一般是指化疗后0~120 h内无呕吐、无拯救性止吐治疗。完全防护一般是指化疗后0~120 h内无呕吐、无拯救性止吐治疗,可能伴有轻微恶心(VAS≤25 mm)。全面控制一般是指化疗后0~120 h内无呕吐、无拯救性止吐治疗、无恶心(VAS≤5 mm)。拯救性治疗是指除化疗前给予预防性止吐药物外,仍需要其他止吐药物对已经出现的恶心呕吐进行治疗。
临床问题12:如何根据前1个疗程的止吐药物使用情况及恶心呕吐的经历制订下1个周期的止吐方案?
专家共识12:共识专家组认为,目前根据前1个疗程止吐治疗的效果如何调整下1个周期止吐方案尚无统一推荐。但前1个疗程出现过爆发性呕吐的患者,推荐下1个周期采用更高级别止吐方案或依据爆发性呕吐有效控制药物调整下1个周期止吐方案。可以尝试Dranitsaris评分系统,即基于患者特征,如年龄、心理预期、睡眠时间、既往孕吐、是否接受蒽环类或铂类药物、是否在家服用止吐药,以及既往是否出现过CINV和化疗周期数等进行评分,≥16分的患者在下一次化疗时≥2级CINV发生率可达60%以上[34]。该评分系统有87.4%的灵敏度,虽然特异度仅为38.4%,但使用该CINV风险评分算法(表4)及在线工具(http://www.riskcinv.org/),仍可有效地针对每例患者的治疗方案及个体情况,更准确便捷、更个体化地预测其CINV发生风险,从而优化患者的CINV管理和后续疗程调整用药(图2)。

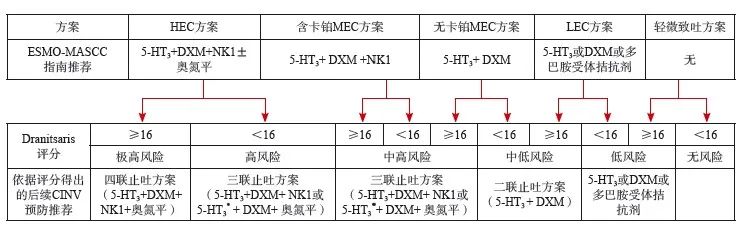
图2 基于Dranitsaris评分系统调整CINV用药[34‑35]
*:当使用奥氮平三联时,5-HT3 RA仅推荐帕洛诺司琼。
临床问题13:因为既往发生过CINV而后续发生预期性恶心呕吐时,如何干预?
一项关于预期性恶心呕吐的随机对照研究[36],观察由肿瘤科护士实施的20 min高强度(正念放松)或低强度(音乐放松)行为干预对预期性恶心呕吐的影响,结果显示,与无干预组相比,接受正念放松(OR=0.44,95% CI:0.20~0.93)和音乐放松(OR=0.40,95% CI:0.20~0.93)的患者化疗过程中出现的预期性恶心均显著减少,与年龄、性别、癌症分期及化疗致吐水平均无关,两个治疗组在预期性恶心呕吐和化疗后的恶心呕吐上无差别。
专家共识13:预期性恶心呕吐的发生多数是因为上一个疗程有过CINV的不良体验。对于发生预期性恶心呕吐的患者,可以为其提供更多关于CINV的知识,使其全面了解治疗过程中可能发生的情况,可以给予相应的措施(如行为干预等)。此外,对于过分焦虑的患者,可以在给药前一晚给予抗焦虑药物如劳拉西泮使之缓解[37]。
3 RINV的全程管理
RINV的病理生理学机制目前尚不明确,一般认为是多因素共同作用的结果。胃肠道(尤其是小肠)富有快速增殖的上皮细胞,对于放疗特别敏感。如果胃肠道在放疗照射野之内,可以直接刺激上消化道传入神经纤维。延髓最后区也可能涉及放疗相关的恶心呕吐,放射线诱导的组织崩解产物也可能刺激化学感受器触发区(chemoreceptor trigger zone,CTZ)。
RINV的风险与照射部位、面积、分割剂量及患者本身有关[38-39]。经全身照射后,90%的患者在30~60 min内发生呕吐;半身大面积照射,在2~3周内呕吐的发生率为80%;全腹腔常规照射(每次1.5 Gy),呕吐的发生率为60%。在头颅放疗时,应注意鉴别和防治放疗性脑水肿导致颅内高压引起的呕吐。另外,放疗的分割剂量越高,总剂量越大,受照射的组织越多,发生恶心呕吐的可能性就越大。
在给予患者预防呕吐治疗前,应充分评估RINV风险,酌情制订不同的个体化方案。与RINV发生相关的重要因素包括照射部位(全身、上腹部放疗恶心呕吐发生风险增加)、照射面积(>400 cm2恶心呕吐发生风险增加)、是否同时合并化疗以及是否既往化疗时出现过恶心呕吐[40-41]。
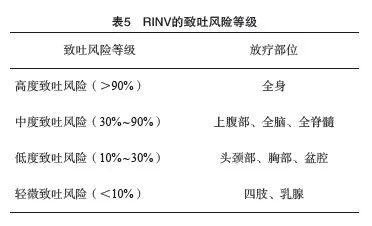
RINV的致吐风险主要根据放疗部位划分(表5[1,10,42]) 。根据具体致吐风险选择合适的止吐策略,ASCO止吐指南[10]中按放疗致吐风险等级划分的止吐药物推荐用法及用量见表6。评估各种止吐药物预防RINV的随机对照临床试验十分有限,这些试验通常都是在高危或中危致吐风险患者中进行的。这些试验结果表明,在随机对照临床试验已评估的药物中,5-HT3 RA是预防RINV最为有效的药物。在一些情况下,其他药物也有一定作用,尤其是对于接受同期放化疗的患者。
5-HT3 RA:一项纳入9项临床试验的meta分析[43]显示,在预防RINV方面,5-HT3 RA相比于安慰剂,可显著地降低呕吐发生率[40% vs 57%,相对危险度(relative risk,RR)=0.7,95% CI:0.57~0.86],并且需要补救性用药的患者也更少(6.5% vs 36%,RR=0.18,95% CI:0.05~0.60)。临床研究[44-49]结果表明,在接受上腹部放疗的患者中,与甲氧氯普胺、吩噻嗪类药物或安慰剂相比,5-HT3 RA预防RINV的效果更好。
皮质类固醇类药物:皮质类固醇类药物应用广泛、费用低廉且具有止吐作用,在临床上也常用于RINV的预防和治疗。一项随机临床试验[50]结果表明,对于接受上腹部放疗的患者,DXM的疗效显著优于安慰剂。皮质类固醇类药物常用于治疗脑转移患者的血管性水肿,也用于治疗RINV。
一项随机对照临床研究[51]评估上腹部放疗患者给予5-HT3 RA联合DXM在预防RINV方面的疗效,共211例患者入选研究,随机分为研究组和对照组,研究组在口服昂丹司琼8 mg(每天2次)的基础上,在放疗前5次联合DXM 4 mg(每天1次)预防治疗,对照组则联合安慰剂治疗。结果显示,在预防阶段,联合DXM组有更好的恶心CR的趋势(50% vs 38%,P=0.06);在整个放疗期间,联合DXM组有更好的呕吐完全控制率(23% vs 12%,P=0.02)、更低的恶心评分(0.28 vs 0.39,P=0.03)及更低比例的挽救性DXM用药的趋势(70% vs 80%,P=0.09),提示在上腹部放疗患者中,联合应用DXM有一定获益。
由于呕吐更常发生在放疗早期,所以预防性应用止吐药没有必要贯穿整个放疗疗程,在放疗第1周使用止吐药可能就已足够。
NK-1 RA:NK-1 RA在CINV治疗中的作用已明确,但NK-1 RA预防RINV的作用尚不明确,在同期放化疗中有一些相关研究。一项针对同时放化疗患者的观察性研究[52]比较了阿瑞匹坦、一种5-HT3 RA和DXM的联合方案与单用5-HT3 RA和DXM的方案,结果显示,三药联合方案相比单用5-HT3 RA和DXM的方案,临床获益更显著。另一项双盲临床试验(GAND止吐研究)中,宫颈癌患者接受分割放疗联合顺铂(每周1次)治疗,并应用帕洛诺司琼和DXM,联用或不联用福沙匹坦来预防RINV[53]。相比于单用帕洛诺司琼和DXM的患者,在帕洛诺司琼和DXM的基础上加用福沙匹坦的患者出现恶心呕吐的可能性更低。
临床问题14:高度致吐风险放疗的推荐预防方案是什么?
专家共识14:对于高度致吐风险的放疗, RINV推荐给予5-HT3 RA+DXM进行预防性止吐(表6)。止吐方案应该在每次接受放疗之前给予;如果当天没有放疗计划,则在放疗之后的第2天给予(专家共识度87%)。
临床问题15:中度致吐风险放疗的推荐预防方案是什么?
专家共识15:对于中度致吐风险的放疗, RINV推荐每次放疗之前给予5-HT3 RA,前5次放疗伴或不伴用DXM进行预防性止吐(表6,专家共识度87%)。
临床问题16:低度和轻微致吐风险放疗的推荐预防方案是什么?
专家共识16:对于低度和轻微致吐风险放疗,RINV均无需常规预防用药(表6,专家共识度87%)。

临床问题17:对于同时接受放疗和抗肿瘤药物治疗的患者,推荐预防方案是什么?
专家共识17:对于同时接受放疗和抗肿瘤药物治疗的患者,应接受适合抗肿瘤药物致吐风险水平的止吐治疗,除非放疗的致吐风险更高。当患者处于抗肿瘤药物的预防性止吐治疗已经结束并且正在进行放疗期间,应该接受适合于放疗致吐风险的止吐治疗,直到下一个抗肿瘤治疗期,而不是根据需要接受抗肿瘤药物的止吐治疗。在抗肿瘤药物的预防性止吐治疗结束后,正在进行的放疗通常会有自己的预防性治疗,患者应接受适合于放疗致吐风险的预防性治疗,直到下一个抗肿瘤治疗期,而不是根据需要接受抗肿瘤药物引起的爆发性CINV治疗(专家共识度87%)。
4 TIINV的全程管理
随着越来越多的靶向治疗和免疫治疗药物上市,肿瘤患者有了更多的治疗选择。与化疗及放疗相比,靶向治疗或免疫治疗导致患者恶心呕吐的风险相对较小。关于靶向治疗药物不良反应的meta分析[54]结果显示,使用靶向药物治疗的患者,恶心呕吐的发生率为10.67%~36.67%。同时靶向治疗或免疫治疗经常与其他治疗方案联合使用,包括化疗和放疗。一篇系统综述[55]分析了程序性死亡蛋白-1(programmed death-1,PD-1)单抗或程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)单抗联合其他治疗方案不良反应的发生率,结果显示,PD-1单抗或PD-L1单抗如果联合化疗,恶心和呕吐的发生率分别为39.6%(30.1%~49.9%)和19.1%(14.6%~24.7%);如果联合放疗,恶心和呕吐的发生率分别为24.9%(11.8%~45.3%)和9.9%(2.3%~34.0%)[55]。
临床问题18:对于靶向治疗药物的推荐预防方案是什么?
专家共识18:靶向治疗药物如果单独使用,可查询常用抗肿瘤治疗药物的致吐风险分级表(表1),参考CINV不同风险等级药物的推荐意见,适当结合患者自身风险因素制订止吐方案。如果联合化疗或放疗,则应评价所接受的全部抗肿瘤治疗手段,按照所接受的致吐等级最高的治疗手段的推荐意见制订止吐方案。
临床问题19:对于免疫治疗药物的推荐TIINV预防方案是什么?
专家共识19:免疫治疗药物的推荐TIINV预防方案与上述靶向治疗药物的推荐预防方案相同。但不建议同期使用糖皮质激素类药物用于止吐,特别是在嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞疗法或免疫检查点抑制剂使用前后,因为糖皮质激素类药物可能会降低免疫治疗效果[56-58],治疗用糖皮质激素类药物或处理其他不良反应需要使用糖皮质激素类药物的情况需另行评估(专家共识度78%)。部分研究[59-62]显示,对接受HEC方案的患者使用奈妥匹坦帕洛诺司琼胶囊(netupitant palonosetron,NEPA)+DXM或阿瑞匹坦+帕洛诺司琼+DXM三联止吐,将本应使用3 d的DXM改为仅使用1 d,止吐效果无显著性差异。另有研究[63]表明,对接受MEC方案的患者,将DXM+帕洛诺司琼二联改为阿瑞匹坦+帕洛诺司琼二联可以显著提升延迟期和总体的CR率(专家共识度87%)。
5 中医中药在AINV管理中的应用
虽然目前已有多种针对不同靶点的药物用于AINV的预防和治疗,但即便按照指南推荐的预防方案给药,仍有部分患者会发生恶心呕吐。中医中药作为中国特色的治疗方案,在AINV的控制中也值得关注。
灸法是以艾叶等可燃材料或其他热源在腧穴或病变部位进行烧灼、温烤,以起到温通经络、调和气血、扶正祛邪作用的医疗保健方法,也是中医常用的治疗方法之一,在恶心呕吐的控制上,灸法也有一定的作用。马紫妍等[64]于2021年发表的一篇meta分析纳入了13项以灸法防止肿瘤放化疗后恶心呕吐的随机对照试验,共计纳入1 167例患者,结果显示,灸法能显著提高肿瘤患者放化疗后恶心呕吐的治疗有效率,差异有统计学意义(OR=3.71,95% CI:2.64~5.22,P <0.05)。除了灸法之外,针刺疗法也是常用的中医治疗手段。邹吉轩等[65]发表的一篇关于针刺防止化疗引起急性和延迟性呕吐的meta分析,纳入了20项随机对照试验及临床对照试验,共计纳入1 458例患者,结果显示,针刺可降低化疗引起的急性和延迟性呕吐的发生,针刺联合西药对比单独使用西药效果更好,可降低急性和延迟性呕吐的发生率,差异有统计学意义(P <0.05)。耳穴按压作为传统中医治疗手段也经常用于CINV的预防和治疗,相关的文献资料也较多,2021年发表的一篇系统综述[66]分析了耳穴按压对于CINV的疗效,纳入19项随机对照试验共1 449例患者。结果显示,相较于单纯药物治疗,耳穴按压联合药物治疗虽对急性恶心呕吐的治疗效果不明显,但可减少延迟性恶心呕吐[延迟性恶心频率:RR=0.68,95% CI:-1.01~-0.35,P <0.001;延迟呕吐频率:RR=0.91,95% CI:-1.22~-0.61,P <0.001]。同时耳穴按压联合止吐药物治疗可降低与止吐药物相关不良反应发生的可能性,便秘、腹泻、疲劳的发生率与对照组相比差异有统计学意义(P <0.05)。另一篇针对乳腺癌患者CINV的随机对照试验[67]将患者分成真耳穴按压组、假耳穴按压组和标准护理组,与标准护理组相比,真耳穴按压组和假耳穴按压组CINV的CR率较高,急性CINV的CR差异有统计学意义(P =0.03)。与标准护理组相比,真耳穴按压组和假耳穴按压组均表现出较低的急性CINV发生率和严重程度,急性恶心的发生率(P =0.04)和严重程度(P =0.001)组间差异有统计学意义。耳穴按压的止吐作用被认为是特异性治疗作用和安慰剂作用的混合,该研究显示安慰剂作用也很明显,甚至有一定的临床意义。
中药在AINV中的使用也有较多的循证医学证据可供参考,研究相对较多的包括小半夏汤、(香砂)六君子汤和生姜等。小半夏汤的配方出自张仲景的《金匮要略》,是以半夏和生姜为主要用药、治疗痰饮呕吐的方剂。多项临床研究[68-70]结果显示,小半夏汤联合西药或针刺疗法对CINV有较好的疗效,可作为CINV标准治疗方案的补充治疗,在提高疗效的同时还能降低5-HT3 RA的不良反应。六君子汤出自《医学正传》卷三引《局方》,主要成分是人参、白术、茯苓、甘草、陈皮和半夏等,而香砂六君子汤是在六君子汤的基础上调整而来,作用与六君子汤相似。一篇关于香砂六君子汤用于CINV的临床研究[71]结果显示,其能够显著地提高疗效,促进恶心呕吐症状的缓解,同时对患者的生活质量也有明显的改善效果,但研究样本量较小(仅30例),有待进一步研究确认。另一篇使用六君子汤联合司琼及DXM的临床研究[72]显示,虽然数值上使用六君子汤的研究组相较于对照组疗效有一定提升,但差异无统计学意义(P>0.05)。关于生姜用于化疗后恶心呕吐,近年有多篇系统综述及meta分析,2022年的一篇系统综述[73]纳入有14项随机试验共1 506例患者,结果显示,生姜可显著地减轻患者术后恶心,但在术后呕吐发生率方面差异无统计学意义。另一篇19年发表的meta分析[74]探讨了生姜制剂或生姜提取物对CINV的疗效,共纳入10项研究。结果显示,生姜可以降低患者的急性CINV的发生率(OR=0.60,95% CI:0.42~0.86,P =0.006),特别是急性呕吐的发生率(OR=0.58,95% CI:0.37~0.94,P =0.025)。
除了上述中医及中药治疗之外,足部按摩、腹部按摩等其他中医疗法以及大半夏汤、小柴胡汤等其他中药配方也可用于CINV,但相关研究和数据较少,有待更多高质量研究的验证。
6 AINV全程管理的规范化
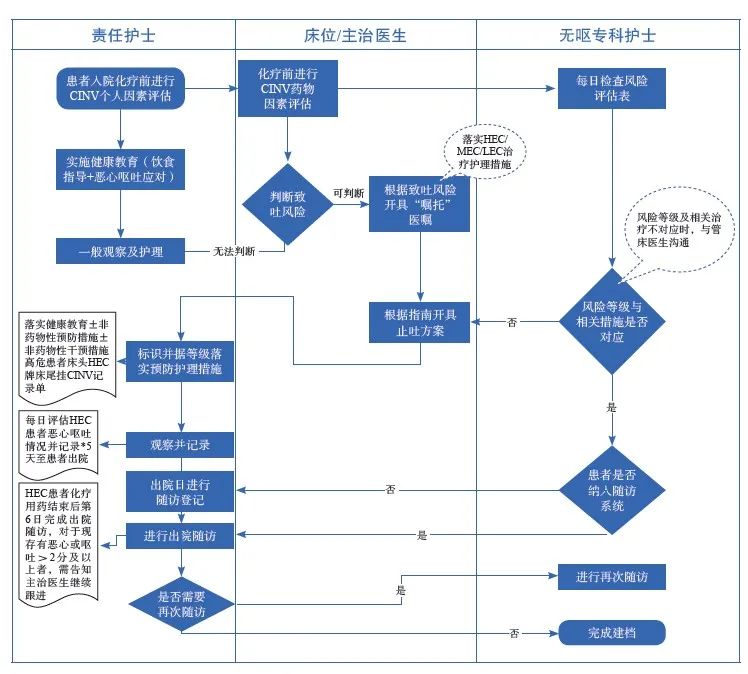
在抗肿瘤治疗全程进行恶心呕吐管理可有效地减少和控制患者恶心呕吐的发生,规范化流程见附录Ⅲ。在AINV全程管理中,多次随访、完整记录、动态评估的制度建立非常重要,目前对离院状态的患者以电话和微信随访为主,今后可尝试使用界面友好的APP建立患者个体和群体的随访档案并定期总结,有利于动态调整上海地区乃至全国AINV全程管理的策略。AINV随访时间推荐从化疗开始至化疗后第5天或放疗后第10天,随访内容推荐包括恶心呕吐频次和程度、体力状况、服药情况。AINV全程管理的规范化可考虑纳入上海市化疗质控中心的督查范围,并通过试点无呕病房的建立、发牌和定期复核促进规范化诊疗的进程(附录Ⅲ)。
7 总结
《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》是依据上海地区的临床调研数据,在国际、国内循证医学证据的基础上,结合上海临床一线医师的工作经验和共识专家组的投票结果(附录Ⅳ)而形成的,对临床实践有着积极的指导意义。现阶段有必要继续加强在上海地区乃至全国的共识推广,进一步强化AINV全程管理的理念,全方位、全过程更有效地控制AINV的发生,以保障和改善患者在治疗期间的生活质量并提升抗肿瘤治疗效果。
致谢:感谢《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》编写组所有专家对本共识的大力支持。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: antiemesis[EB/OL] 2024, Version 1. [2023-11-15]. https://www.nccn.org/ professionals/physician_gls/pdf/antiemesis.pdf.
[2] AAPRO M, SCOTTÉ F, ESCOBAR Y, et al. Practice patterns for prevention of chemotherapy-induced nausea and vomiting and antiemetic guideline adherence based on real-world prescribing data[J]. Oncologist, 2021, 26(6): e1073-e1082.
[3] 徐永华, 周佳琦, 周莎莎, 等. 化疗止吐方案的指南依从性分析[J]. 中国药业, 2021, 30(24): 125-127.
XU Y H, ZHOU J Q, ZHOU S S, et al. Adherence analysis of the antiemetic guidelines for chemotherapy-induced nausea and vomiting[J]. China Pharm, 2021, 30(24): 125-127.
[4] 曾 铖, 金奕滋, 李 婷, 等. 上海市癌症患者化疗所致恶心呕吐的横断面研究[J]. 中国癌症杂志, 2023, 33(11): 1009-1017.
ZENG C, JIN Y Z, LI T, et al. Chemotherapy-induced nausea and vomiting among cancer patients in Shanghai: a crosspal study[J]. China Oncol, 2023, 33(11): 1009-1017.
[5] FEYER P, JAHN F, JORDAN K. Prophylactic management of radiation-induced nausea and vomiting[J]. Biomed Res Int, 2015, 2015: 893013.
[6] ALDEN-BENNETT V, BALL B, NIGHTINGALE H, et al. Radiation-induced nausea and vomiting: a clinical audit of prophylactic antiemetic use[J]. J Radiother Pract, 2022, 21(4): 462-465.
[7] 上海市抗癌协会癌症康复与姑息专业委员会. 化疗所致恶心呕吐全程管理上海专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(12): 946-960.
Cancer Rehabilitation and Palliative Care Committee of Shanghai Anti-Cancer Association. Shanghai Consensus Guidelines for the Management of chemotherapy-induced nausea and vomiting (2018 edition)[J]. Chin Oncol, 2018, 28(11): 946-960.
[8]SINGH P, YOON S S, KUO B. Nause a: a review of pathophysiology and therapeutics[J]. Therap Adv Gastroenterol, 2016, 9(1): 98-112.
[9] DENNIS K, NGUYEN J, PRESUTTI R, et al. Prophylaxis of radiotherapy-induced nausea and vomiting in the palliative treatment of bone metastases[J]. Support Care Cancer, 2012, 20(8): 1673-1678.
[10] HESKETH P J, KRIS M G, BASCH E, et al. Antiemetics: ASCO guideline update[J]. J Clin Oncol, 2020, 38(24): 2782-2797.
[11] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)抗肿瘤治疗相关恶心呕吐预防和治疗指南(2019.V1.0)[M]. 北京: 人民卫生出版社, 2019.
Guidelines Working Committee of Chinese Society of Clinical Oncology. Guidelines of Chinese Society of Clinical Oncology (CSCO) prevention & treatment of nausea and vomiting caused (2019.V1.0)[M]. Beijing: People’s Health Publishing House, 2019.
[12] HASHIMOTO H, ABE M, TOKUYAMA O, et al. Olanzapine 5 mg plus standard antiemetic therapy for the prevention of chemotherapy-induced nausea and vomiting (J-FORCE): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2020, 21(2): 242-249.
[13] YEO W, LAU T K, LI L, et al. A randomized study of olanzapine-containing versus standard antiemetic regimens for the prevention of chemotherapy-induced nausea and vomiting in Chinese breast cancer patients[J]. Breast, 2020, 50: 30-38.
[14] WANG D Y, CHEN Y, ZHANG Y, et al. The balance between the effectiveness and safety for chemotherapy-induced nausea and vomiting of different doses of olanzapine (10 mg versus 5 mg): a systematic review and meta-analysis[J]. Front Oncol, 2021, 11: 705866.
[15] CHOW R, NAVARI R M, TERRY B, et al. Olanzapine 5 mg vs 10 mg for the prophylaxis of chemotherapy-induced nausea and vomiting: a network meta-analysis[J]. Support Care Cancer, 2022, 30(2): 1015-1018.
[16] JYOTI BAJPAI, KAPU V, RATH S, et al. A randomized, open-label phase Ⅲ trial evaluating low-dose vs standarddose olanzapine with triple antiemetic therapy for prevention of highly emetogenic chemotherapy-induced nausea and vomiting in solid tumors (OLAnzaPiNE)[C]. SABCS, 2023: RF01-08.
[17] CAO J, WANG B Y, WANG Z H, et al. Efficacy of mirtazapine in preventing delayed nausea and vomiting induced by highly emetogenic chemotherapy: an open-label, randomized, multicenter phase Ⅲ trial[J]. J Clin Oncol, 2018, 36(15_suppl): 1078.
[18] ZHANG L Y, QU X J, TENG Y E, et al. Efficacy of thalidomide in preventing delayed nausea and vomiting induced by highly emetogenic chemotherapy: a randomized, multicenter, doubleblind, placebo-controlled phase Ⅲ trial (CLOG1302 study)[J]. J Clin Oncol, 2017, 35(31): 3558-3565.
[19] IOROI T, FURUKAWA J, KUME M, et al. Phase Ⅱ study of palonosetron, aprepitant and dexamethasone to prevent nausea and vomiting induced by multiple-day emetogenic chemotherapy[J]. Support Care Cancer, 2018, 26(5): 1419-1423.
[20] RENZO N D, MUSSO M, SCIMÈ R, et al. Efficacy and safety of multiple doses of NEPA without dexamethasone in preventing nausea and vomiting induced by multiple-day and high-dose chemotherapy in patients with non-Hodgkin’s lymphoma undergoing autologous hematopoietic stem cell transplantation: a phase Ⅱa, multicenter study[J]. Bone Marrow Transplant, 2020, 55(11): 2114-2120.
[21] ZHAO Y Y, YANG Y P, GAO F F, et al. A multicenter, randomized, double-blind, placebo-controlled, phase 3 trial of olanzapine plus triple antiemetic regimen for the prevention of multiday highly emetogenic chemotherapy-induced nausea and vomiting (OFFER study)[J]. EClinicalMedicine, 2022, 55: 101771.
[22] MOSA A S M, HOSSAIN A M, LAVOIE B J, et al. Patientrelated risk factors for chemotherapy-induced nausea and vomiting: a systematic review[J]. Front Pharmacol, 2020, 11: 329.
[23] CROWDER S L, HOOGLAND A I, WELNIAK T L, et al. Metagenomics and chemotherapy-induced nausea: a roadmap for future research[J]. Cancer, 2022, 128(3): 461-470.
[24] JIN Y L, LI X R, JIANG C H, et al. An update in our understanding of the relationships between gene polymorphisms and chemotherapy-induced nausea and vomiting[J]. Int J Gen Med, 2021, 14: 5879-5892.
[25] HU Z H, LIANG W H, YANG Y P, et al. Personalized estimate of chemotherapy-induced nausea and vomiting: development and external validation of a nomogram in cancer patients receiving highly/moderately emetogenic chemotherapy[J]. Medicine, 2016, 95(2): e2476.
[26] AAPRO M, CAPRARIU Z, CHILINGIROV P, et al. Assessing the impact of antiemetic guideline compliance on prevention of chemotherapy-induced nausea and vomiting: results of the nausea/emesis registry in oncology (NERO)[J]. Eur J Cancer, 2022, 166: 126-133.
[27] RADHAKRISHNAN V, PAI V, RAJARAMAN S, et al. Olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced vomiting in children: an open-label, randomized phase 3 trial[J]. Pediatr Blood Cancer, 2020, 67(9): e28532.
[28] HESKETH P J, GRUNBERG S M, GRALLA R J, et al. The oral neurokinin-1 antagonist aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a multinational, randomized, double-blind, placebo-controlled trial in patients receiving high-dose cisplatin--the aprepitant protocol 052 study group[J]. J Clin Oncol, 2003, 21(22): 4112-4119.
[29] SCHWARTZBERG L, BARBOUR S Y, MORROW G R, et al. Pooled analysis of phase Ⅲ clinical studies of palonosetron versus ondansetron, dolasetron, and granisetron in the prevention of chemotherapy-induced nausea and vomiting (CINV)[J]. Support Care Cancer, 2014, 22(2): 469-477.
[30] NAVARI R M, NAGY C K, GRAY S E. The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy[J]. Support Care Cancer, 2013, 21(6): 1655-1663.
[31] GRUNBERG S, CHUA D, MARU A, et al. Single-dose fosaprepitant for the prevention of chemotherapy-induced nausea and vomiting associated with cisplatin therapy: randomized, double-blind study protocol--EASE[J]. J Clin Oncol, 2011, 29(11): 1495-1501.
[32] KIM H K, HSIEH R, CHAN A, et al. Impact of CINV in earlier cycles on CINV and chemotherapy regimen modification in subsequent cycles in Asia Pacific clinical practice[J]. Support Care Cancer, 2015, 23(1): 293-300.
[33] National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE)[EB/OL]. 2017, Version 5.0. (2017-11-27)[2023-09-22]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/CTCAE_v5_
Quick_Reference_8.5x11.pdf.
[34] DRANITSARIS G, MOLASSIOTIS A, CLEMONS M, et al. The development of a prediction tool to identify cancer patients at high risk for chemotherapy-induced nausea and vomiting[J]. Ann Oncol, 2017, 28(6): 1260-1267.
[35] MASCC/ESMO. MASCC/ESMO antiemetic guideline 2016 with updates in 2019[EB/OL]. 2019. (2019-09-29)[2023-09-22]. https://mascc.memberclicks.net/assets/GuidelinesTools/Antiemetics/mascc_antiemetic_guidelines_english_v.1.5SEPT29.2019.pdf.
[36] HUNTER J J, MAUNDER R G, SUI D W, et al. A randomized trial of nurse-administered behavioral interventions to manage anticipatory nausea and vomiting in chemotherapy[J]. Cancer Med, 2020, 9(5): 1733-1740.
[37] JAMES A, NAIR M M, ABRAHAM D S, et al. Effect of lorazepam in reducing psychological distress and anticipatory nausea and vomiting in patients undergoing chemotherapy[J]. J Pharmacol Pharmacother, 2017, 8(3): 112-115.
[38] HESKETH P J, KRIS M G, BASCH E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol, 2017, 35(28): 3240-3261.
[39] FEYER P C, MARANZANO E, MOLASSIOTIS A, et al. Radiotherapy-induced nausea and vomiting (RINV): MASCC/ESMO guideline for antiemetics in radiotherapy: update 2009[J]. Support Care Cancer, 2011, 19(Suppl 1): S5-S14.
[40] Radiation-induced emesis: a prospective observational multicenter Italian trial. The Italian Group for Antiemetic Research in Radiotherapy[J]. Int J Radiat Oncol Biol Phys, 1999, 44(3): 619-625.
[41] MARANZANO E, ANGELIS V D, PERGOLIZZI S, et al. A prospective observational trial on emesis in radiotherapy: analysis of 1 020 patients recruited in 45 Italian Radiation Oncology Centres[J]. Radiother Oncol, 2010, 94(1): 36-41.
[42] RUHLMANN C H, JAHN F, JORDAN K, et al. 2016 updated MASCC/ESMO consensus recommendations: prevention of radiotherapy-induced nausea and vomiting[J]. Support Care Cancer, 2017, 25(1): 309-316.
[43] SALVO N, DOBLE B, KHAN L, et al. Prophylaxis of radiationinduced nausea and vomiting using 5-hydroxytryptamine-3 serotonin receptor antagonists: a systematic review of randomized trials[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 408-417.
[44] AASS N, HÅTUN D E, THORESEN M, et al. Prophylactic use of tropisetron or metoclopramide during adjuvant abdominal radiotherapy of seminoma stage Ⅰ: a randomised, open trial in 23 patients[J]. Radiother Oncol, 1997, 45(2): 125-128.
[45] BEY P, WILKINSON P M, RESBEUT M, et al. A doubleblind, placebo-controlled trial of i.v. dolasetron mesilate in the prevention of radiotherapy-induced nausea and vomiting in cancer patients[J]. Support Care Cancer, 1996, 4(5): 378-383.
[46] FRANZÉN L, NYMAN J, HAGBERG H, et al. A randomised placebo controlled study with ondansetron in patients undergoing fractionated radiotherapy[J]. Ann Oncol, 1996, 7(6): 587-592.
[47] LANCIANO R, SHERMAN D M, MICHALSKI J, et al. The efficacy and safety of once-daily Kytril (granisetron hydrochloride) tablets in the prophylaxis of nausea and emesis following fractionated upper abdominal radiotherapy[J]. Cancer Invest, 2001, 19(8): 763-772.
[48] PRIESTMAN T J, ROBERTS J T, LUCRAFT H, et al. Results of a randomized, double-blind comparative study of ondansetron and metoclopramide in the prevention of nausea and vomiting following high-dose upper abdominal irradiation[J]. Clin Oncol, 1990, 2(2): 71-75.
[49] PRIESTMAN T J, ROBERTS J T, UPADHYAYA B K. A prospective randomized double-blind trial comparing ondansetron versus prochlorperazine for the prevention of nausea and vomiting in patients undergoing fractionated radiotherapy[J]. Clin Oncol (R Coll Radiol), 1993, 5(6): 358-363.
[50] KIRKBRIDE P, BEZJAK A, PATER J, et al. Dexamethasone for the prophylaxis of radiation-induced emesis: a National Cancer Institute of Canada Clinical Trials Group phase Ⅲ study[J]. J Clin Oncol, 2000, 18(9): 1960-1966.
[51] National Cancer Institute of Canada Clinical Trials Group, WONG R K S, PAUL N, et al. 5-hydroxytryptamine-3 receptor antagonist with or without short-course dexamethasone in the prophylaxis of radiation induced emesis: a placebo controlled randomized trial of the National Cancer Institute of Canada Clinical Trials Group (SC19)[J]. J Clin Oncol, 2006, 24(21): 3458-3464.
[52] JAHN F, RIESNER A, JAHN P, et al. Addition of the neurokinin-1-receptor antagonist (RA) aprepitant to a 5-hydroxytryptamine-RA and dexamethasone in the prophylaxis of nausea and vomiting due to radiation therapy with concomitant cisplatin[J]. Int J Radiat Oncol Biol Phys, 2015, 92(5): 1101-1107.
[53] RUHLMANN C H, CHRISTENSEN T B, DOHN L H, et al. Efficacy and safety of fosaprepitant for the prevention of nausea and emesis during 5 weeks of chemoradiotherapy for cervical cancer (the GAND-emesis study): a multinational, randomised, placebo-controlled, double-blind, phase 3 trial[J]. Lancet Oncol, 2016, 17(4): 509-518.
[54] 崔 明, 欧志莲, 詹剑玲. 肿瘤靶向药物不良反应发生率的meta分析[J]. 中国药物经济学, 2021, 16(3): 50-54.
CUI M, OU Z L, ZHAN J L. Meta-analysis of the incidence of adverse reactions to tumor-targeted drugs[J]. China J Pharm Econ, 2021, 16(3): 50-54.
[55] ZHOU X X, YAO Z R, BAI H, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitor-based combination therapies in clinical trials: a systematic review and metaanalysis[J]. Lancet Oncol, 2021, 22(9): 1265-1274.
[56] BONIFANT C L, JACKSON H J, BRENTJENS R J, et al. Toxicity and management in CAR T-cell therapy[J]. Mol Ther Oncolytics, 2016, 3: 16011.
[57] DAVILA M L, RIVIERE I, WANG X Y, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J]. Sci Transl Med, 2014, 6(224): 224ra25.
[58] KALFEIST L, GALLAND L, LEDYS F, et al. Impact of glucocorticoid use in oncology in the immunotherapy era[J]. Cells, 2022, 11(5): 770.
[59] CELIO L, CORTINOVIS D, COGONI A A, et al. Exploratory analysis of the effect of a dexamethasone-sparing regimen for prophylaxis of cisplatin-induced emesis on food intake (LUNGNEPA study)[J]. Sci Rep, 2023, 13(1): 1257.
[60] KOSAKA Y, TANINO H, SENGOKU N, et al. Phase Ⅱ randomized, controlled trial of 1 day versus 3 days of dexamethasone combined with palonosetron and aprepitant to prevent nausea and vomiting in Japanese breast cancer patients receiving anthracycline-based chemotherapy[J]. Support Care Cancer, 2016, 24(3): 1405-1411.
[61] ITO Y, TSUDA T, MINATOGAWA H, et al. Placebo-controlled, double-blinded phase Ⅲ study comparing dexamethasone on day 1 with dexamethasone on days 1 to 3 with combined neurokinin-1 receptor antagonist and palonosetron in highemetogenic chemotherapy[J]. J Clin Oncol, 2018, 36(10): 1000-1006.
[62] CELIO L, CORTINOVIS D, COGONI A A, et al. Evaluating the impact of chemotherapy-induced nausea and vomiting on daily functioning in patients receiving dexamethasone-sparing antiemetic regimens with NEPA (netupitant/palonosetron) in the cisplatin setting: results from a randomized phase 3 study[J]. BMC Cancer, 2022, 22(1): 915.
[63] CHENG Y, WU Z H, SHI L S, et al. Aprepitant plus palonosetron versus dexamethasone plus palonosetron in preventing chemotherapy-induced nausea and vomiting in patients with moderate-emetogenic chemotherapy: a randomized, open-label, phase 3 trial[J]. EClinicalMedicine, 2022, 49: 101480.
[64] 马紫妍, 陈芳芳, 程茜茜, 等. 灸法防治肿瘤放化疗后恶心呕吐的meta分析[J]. 中国中医药现代远程教育, 2021,
19(17): 58-62.
MA Z Y, CHEN F F, CHENG X X, et al. Meta-analysis of moxibustion in the prevention and treatment of nausea and vomiting after radiotherapy and chemotherapy of tumors[J]. Chin Med Mod Distance Educ China, 2021, 19(17): 58-62.
[65] 邹吉轩, 孙 妍, 宋 英, 等. 针刺防治化疗引起急性和延迟性呕吐的meta分析[J]. 世界中医药, 2021, 16(18): 2735-
2741.
ZOU J X, SUN Y, SONG Y, et al. Meta-analysis of acupuncture prevention and treatment of acute and delayed vomiting caused by chemotherapy[J]. World Chin Med, 2021, 16(18): 2735-2741.
[66] CHEN L C, WU X H, CHEN X S, et al. Efficacy of auricular acupressure in prevention and treatment of chemotherapyinduced nausea and vomiting in patients with cancer: a systematic review and meta-analysis[J]. Evid Based Complement Alternat Med, 2021, 2021: 8868720.
[67] TAN J Y, MOLASSIOTIS A, SUEN L K P, et al. Effects of auricular acupressure on chemotherapy-induced nausea and vomiting in breast cancer patients: a preliminary randomized controlled trial[J]. BMC Complement Med Ther, 2022, 22(1): 87.
[68] 刘述梅, 许 玲, 周益凡, 等. 小半夏汤加味治疗NSCLC化疗所致恶心呕吐的临床研究[J]. 新疆中医药, 2019, 37(1): 17-19.
LIU S M, XU L, ZHOU Y F, et al. Clinical study of modified XiaoBanXia Decoction in treating nausea and vomiting caused by NSCLC chemotherapy[J]. Xinjiang J Tradit Chin Med, 2019, 37(1): 17-19.
[69] 陶文婷, 许培箴, 沈建峰, 等. 小半夏汤协同防治妇科肿瘤化疗性恶心呕吐临床研究[J]. 现代中医药, 2021, 41(5): 76-80.
TAO W T, XU P Z, SHEN J F, et al. Clinical study of xiaobanxia decoction in the prevention and treatment of chemotherapyinduced nausea and vomiting in gynecological tumors[J]. Mod Tradit Chin Med, 2021, 41(5): 76-80.
[70] 崔艺馨, 米继伟, 唐潇然, 等. 小半夏汤联合穴位针刺治疗乳腺癌术后化疗相关性恶心呕吐的临床研究[J]. 中国医药, 2021, 16(8): 1231-1235.
CUI Y X, MI J W, TANG X R, et al. Clinical study of Xiaobanxia Decoction combined with acupuncture at acupoint on the treatment of chemotherapy-induced nausea and vomiting after breast cancer surgery[J]. China Med, 2021, 16(8): 1231-1235.
[71] 王晋秋, 陈海燕, 翟长云. 香砂六君子汤加味治疗化疗后迟发性恶心呕吐的临床研究[J]. 世界最新医学信息文摘, 2018, 18(49): 25-26.
WANG J Q, CHEN H Y, ZHAI C Y. Clinical study on delayed nausea and vomiting after chemotherapy with Xiangsha Liujunzi Decoction[J]. World Latest Med Inf, 2018, 18(49): 25-26.
[72] HARADA T, AMANO T, IKARI T, et al. Rikkunshito for preventing chemotherapy-induced nausea and vomiting in lung cancer patients: results from 2 prospective, randomized phase 2 trials[J]. Front Pharmacol, 2017, 8: 972.
[73] LU C X, CHEN X W, YAN X C, et al. The preventive and relieving effects of ginger on postoperative nausea and vomiting: a systematic review and meta-analysis of randomized controlled trials[J]. Int J Nurs Stud, 2022, 125: 104094.
[74] CHANG W P, PENG Y X. Does the oral administration of ginger reduce chemotherapy-induced nausea and vomiting: a metaanalysis of 10 randomized controlled trials[J]. Cancer Nurs, 2019, 42(6): E14-E23.
附录Ⅰ 常用止吐药物和方案剂量
1 急性恶心呕吐(均为第1天用药)
⑴ 5-HT3 RA(建议常备药物:至少1种)
昂丹司琼8~16 mg qd iv或16~24 mg qd po格拉司琼3 mg qd iv或1 mg bid po
托烷司琼5 mg qd iv
雷莫司琼0.3 mg qd iv
阿扎司琼10 mg qd iv
帕洛诺司琼0.25 mg qd iv或0.5 mg qd po
⑵ NK-1 RA(建议常备药物:至少1种)
阿瑞匹坦125 mg qd po
福沙匹坦150 mg qd iv
⑶ 5-HT3 RA/NK-1 RA复方制剂(建议常备药物)
奈妥匹坦300 mg/帕洛诺司琼0.5 mg 1粒qd po
⑷ 糖皮质激素(建议常备药物)
DXM
高度致吐风险:20 mg qd po/iv(与阿瑞匹坦或福沙匹坦联用时,12 mg qd po/iv)
中度致吐风险:12 mg qd po/iv(无论是否与NK-1 RA合用)
低度致吐风险:7.5~12.0 mg qd po/iv
⑸ 多巴胺受体阻滞药(建议备选药物)
甲氧氯普胺10~20 mg qd po/iv
⑹ 精神类药物(建议备选药物)
奥氮平5~10 mg qd po,在特定情况下可减量至2.5 mg
⑺ 吩噻嗪类药物(建议备选药物)
丙氯拉嗪10 mg qd po/iv
异丙嗪12.5~25.0 mg qd im/iv
⑻ 质子泵抑制剂(建议备选药物)
奥美拉唑20 mg qd po/40 mg qd iv
兰索拉唑15~30 mg qd po/30 mg bid iv
泮托拉唑40 mg qd po/40 mg qd或bid iv
雷贝拉唑20 mg qd po/20 mg qd iv
埃索美拉唑40 mg qd po/20 ~ 40 mg qd iv
⑼ H2受体拮抗剂(建议备选药物)
西咪替丁0.2 g bid po/0.2~0.4 qd iv
雷尼替丁0.4 g bid po/50 mg bid iv
法莫替丁20 mg bid po/20 mg bid iv
2 延迟性恶心呕吐
⑴ 5-HT3 RA(建议常备药物:至少1种;仅用于中度致吐药物的化疗)
昂丹司琼8~16 mg qd iv或16~24 mg qd po,第2~3天
格拉司琼3 mg qd iv或1 mg BID/2 mg qd po,第2~3天
托烷司琼5 mg qd iv,第2~3天
雷莫司琼0.3 mg qd iv,第2~3天
阿扎司琼10 mg qd iv,第2~3天
帕洛诺司琼0.25 mg qd iv或0.5 mg qd po,第3天(如第1天已使用)
⑵ NK-1 RA(建议常备药物)
阿瑞匹坦80 mg qd po,第2~3天
⑶ 5-HT3 RA/NK-1 RA复方制剂(建议常备药物)
奈妥匹坦300 mg/帕洛诺司琼0.5 mg 1粒qd po
⑷ 糖皮质激素(建议常备药物)
DXM
高度致吐风险:7.5~8.0 mg qd po/iv,第2~4天(无论是否与NK-1 RA合用)
中度致吐风险:7.5 ~ 8.0 mg qd po/iv,第2~3天(无论是否与NK-1 RA合用)
低度致吐风险(仅用于多日化疗):7.5~12.0 mg qd po/iv至化疗结束当天
⑸ 精神类药物(建议备选药物)
奥氮平
高度致吐风险:5~10 mg qd po,第2~4天
中度致吐风险:5~10 mg qd po,第2~3天,在特定情况下可减量至2.5 mg 米氮平
高度致吐风险:15 mg qd po,第2~4天
⑹ 吩噻嗪类药物(建议备选药物)
丙氯拉嗪(仅用于低度致吐药物的多日化疗)10 mg qd po/iv至化疗结束当天
异丙嗪(仅用于低度致吐药物的多日化疗)12.5~25.0 mg qd im/iv至化疗结束当天
⑺ 质子泵抑制剂(建议备选药物)
奥美拉唑20 mg qd po/40 mg qd iv
兰索拉唑15~30 mg qd po/30 mg bid iv
泮托拉唑40 mg qd po/40 mg qd或bid iv
雷贝拉唑20 mg qd po/20 mg qd iv
埃索美拉唑40 mg qd po/20~40 mg qd iv
⑻ H2受体拮抗剂(建议备选药物)
西咪替丁0.2 g bid po/0.2~0.4 qd iv
雷尼替丁0.4 g bid po/50 mg bid iv
法莫替丁20 mg bid po/20 mg bid iv
特定延迟性恶心呕吐控制方案:沙利度胺100 mg bid po,第1~5天
3 爆发性恶心呕吐
昂丹司琼8~16 mg qd iv或16~24 mg qd po
格拉司琼1 mg bid/2 mg qd po
DXM 12 mg qd po/iv
异丙嗪12.5~25.0 mg q 4~6 h im/iv
丙氯拉嗪10 mg q 6 h po/iv
甲氧氯普胺10~20 mg q 4~6 h po/iv
奥氮平5~10 mg qd po,在特定情况下可减量至2.5 mg
劳拉西泮0.5~2.0 mg q 6 h po/iv
氟哌啶醇0.5~2.0 mg q 4~6 h po/iv
附录Ⅱ 患者自陈式CINV评估:MASCC止吐评价工具(MAT)
患者填写说明:
在以下的问卷里,请您评估恶心与呕吐对您生活质量影响的程度。第一组的9条问题是有关您恶心的情况,而第二组的9条问题是有关您呕吐的情况。这份问卷应需要大约10 min或更短时间来完成。请在开始作答前先阅读这份说明。请仔细思考每条问题,因为您的答案可以在以后协助研发提高患者生活质量的治疗方法。
对于每一条问题,您将会评估在化疗后第2~5天中您的恶心(或呕吐)曾影响您生活质量任何一方面的程度。请针对您在那个时间段的经验作答。我们有兴趣的是您个人的观点,而不是您的家庭成员或朋友的观点。您的答案将会保密。
您必须回答每一条问题。请用黑色圆珠笔用力书写以使您的标示清晰易辨。
假如您不确定您的答案或不明白问题,请将问题再仔细阅读一次,尽量按照您对问题的理解来划上垂直标记(|)。如果您要更改您的答案,请在问卷周边空白的地方对所选的正确答案做出注释,在更改处签署您的姓名并注明日期。
每一条问题皆使用视觉模拟评分量表(VAS)。想一想您的恶心(或呕吐)状况曾影响您生活质量的某一方面的程度,然后在横线相应的某一点划一个垂直标记(|),以显示您对自己感受的评估。请仔细阅读问题,因为在某些问题中,“1”代表您对生活质量并无影响,而在其他问题中,“1”则代表您对生活质量有很大的影响。您可在横线上任何一点划下您的垂直标记(|)。请确保您把您的垂直标记(|)与横线相交。请勿把号码圈起来。请使用单独一条垂直标记(|),如图附录Ⅱ-1所示。
问卷分为恶心和呕吐两类问卷,您在填写问卷后,需确认本表上的信息是准确的,并签名。其中,化疗后24 h内评估量表内容与化疗后第2~5天相同。


附录Ⅳ 《抗肿瘤治疗所致恶心呕吐全程管理上海专家共识(2024年版)》相关问题投票
⑴ 一项治疗中国乳腺癌患者CINV的临床研究中,观察奥氮平组(奥氮平+NK-1 RA+5-HT3 RA+DXM)和标准治疗组(NK-1 RA+5-HT3 RA+DXM)在第1个周期使用EC方案时的CR( 无呕吐且无拯救性治疗)率, 奥氮平组显著高于标准组(总体期:65.0% vs 38.3%,P=0.003 5;急性期:70.0% vs 51.7%,P=0.039 7,生活质量更好。鉴于奥氮平预防HEC静脉化疗药物急性CINV的临床研究结果,2024年版共识更新为急性CINV优先推荐5-HT3 RA+DXM+NK-1 RA+奥氮平,备选方案为5-HT3 RA+DXM+NK-1 RA或5-HT3 RA+DXM+奥氮平,具体更新见下表。您是否同意?

专家组投票结果:22人次(95.65%)选择是;0人次选择否;1人次(4.35%)放弃投票。
⑵ 有国外研究结果显示,奥氮平组(阿瑞匹坦+帕洛诺司琼+DXM+5 mg奥氮平)患者在接受顺铂时的延迟期CR率为79%(95% CI:75%~83%),而安慰剂组(阿瑞匹坦+ 帕洛诺司琼+DXM)患者的CR 率为66%(P<0.000 1)。一项中国乳腺癌患者CINV的临床研究结果显示,奥氮平组(奥氮平+ NK-1 RA+5-HT3 RA+DXM)和标准治疗组(NK-1 RA+5-HT3 RA+DXM)在第1个周期使用EC方案时,奥氮平组的CR(无呕吐且无拯救性治疗)率显著高于标准组(总体期:65.0% vs 38.3%,P=0.003 5;延迟期:92.9% vs 74.2%,P=0.025 4),患者生活质量更好。鉴于奥氮平预防HEC静脉化疗药物延迟期CINV的临床研究结果,2024年版共识更新为延迟CINV优先推荐DXM+NK-1 RA+奥氮平,备选方案有DXM+NK-1 RA、DXM+奥氮平,具体更新见下表,您是否同意?

专家组投票结果:21人次(91.30%)选择是;0人次选择否;2人次(8.70%)放弃投票。
⑶ 有meta分析结果显示,与5-HT3 RA+DXM相比,5-HT3 RA+DXM+奥氮平可以显著地降低HEC方案和MEC方案的急性期和延迟期CINV。一项随机、双盲、安慰剂对照研究结果显示,奥氮平联合帕洛诺司琼和DXM可显著地改善MEC患者的生活质量和呕吐控制。因此在中度致吐风险静脉化疗药物的推荐预防方案中,2024年版共识将劳拉西泮更改为奥氮平,具体更新见下表,您是否同意?

专家组投票结果:22人次(95.65%)选择是;0人次选择否;1人次(4.35%)放弃投票。
有研究结果显示,劳拉西泮的主要作用在于缓解焦虑,对预期性恶心呕吐有效,目前暂未有充分循证医学证据表明其对急性期、延迟期恶心呕吐有效,因此NCCN指南中删除了劳拉西泮。2024年版共识急性、延迟期CINV预防性止吐方案中均删除了劳拉西泮,具体更新见下表,您是否同意?

专家组投票结果:21人次(91.30%)选择是;0人次选择否;2人次(8.70%)放弃投票。
⑸ 近期一项奥氮平四联用药方案用于多日化疗止吐的随机对照研究显示,在三联用药的基础上增加5 mg奥氮平可以显著地提高患者的CR率(69% vs 58%,P=0.031)。在几乎所有亚组中,奥氮平组相较于安慰剂组均观察到CR获益,对于高度及中度致吐风险的多日化疗方案推荐5-HT3 RA+DXM+NK-1 RA±奥氮平作为预防方案,同时推荐连续使用至化疗结束后再持续2~3 d,您是否同意?
专家组投票结果:20人次(86.96%)选择是;0人次选择否;3人次(13.04%)放弃投票。
⑹ 2024年版共识新增了的RINV全程管理,具体见下表,您对RINV全程管理中的RINV的止吐风险等级是否同意?

专家组投票结果:21人次(91.30%)选择是;1人次(4.35%)选择否;1人次(4.35%)放弃投票。
⑺ 2024年版共识新增了的RINV全程管理,具体见下表,您对RINV全程管理中的预防方案是否同意?


专家组投票结果:20人次(86.96%)选择是;1人次(4.35%)选择否;2人次(8.7%)放弃投票。
⑻ 您认为对于两药/三药化疗药物联合治疗、化疗联合免疫治疗或化疗联合放疗等治疗方案中,按照所接受的致吐风险等级最高的治疗手段的推荐意见制订止吐方案,是否合理?
专家组投票结果:20人次(86.96%)选择是;2人次(8.70%)选择否;1人次(4.35%)放弃投票。
⑼ 部分研究结果显示,对接受HEC方案的患者使用NEPA+DXM或阿瑞匹坦+帕洛诺司琼+DXM三联止吐,将本应使用3 d的DXM改为仅使用1 d,止吐效果无显著差异,因此在免疫治疗联合HEC方案时,为了避免糖皮质激素类药物可能会降低免疫治疗效果,可考虑将本应使用3 d的DXM改为仅使用1 d的预防方案,您是否同意?
专家组投票结果:20人次(86.96%)选择是;1人次(4.35%)选择否;2人次(8.70%)放弃投票。
⑽ 有研究结果表明,对接受MEC方案的患者,将DXM+帕洛诺司琼二联改为阿瑞匹坦+帕洛诺司琼二联可以显著提升延迟期和总体的CR率,因此为了避免糖皮质激素类药物可能会降低免疫治疗效果,在接受免疫联合MEC方案时,可考虑将DXM+帕洛诺司琼二联改为阿瑞匹坦+帕洛诺司琼二联预防方案,您是否同意?
专家组投票结果:20人次(86.96%)选择是;2人次(8.70%)选择否;1人次(4.35%)放弃投票。
⑾ 为了避免糖皮质激素可能会降低免疫治疗效果,在使用免疫治疗药物时,不建议同期使用糖皮质激素类药物用于止吐,特别是在CAR-T细胞疗法或免疫检查点抑制剂使用前后,但如果是治疗用糖皮质激素类药物或处理其他不良反应需要使用糖皮质激素类药物的情况需另行评估,您是否同意?
专家组投票结果:18人次(78.26%)选择是;2人次(8.70%)选择否;3人次(13.04%)放弃投票。
⑿ 在系统综述、随机对照研究等研究结果显示中医(如艾灸、针刺、耳穴指压)中药[如小半夏汤、(香砂)六君子汤、生姜]在恶心呕吐的预防和治疗方案具有一定效果,但中医中药在临床实践中难以标准化和量化,并缺乏高质量研究,对于中医中药在AINV管理中的作用,您更认可哪一个?
专家组投票结果:13人次(56.52%)选择预防治疗当中有部分临床研究数据/实践支持,仍亟待更高质量的研究提供实践指导;4人次(17.39%)选择中医中药在AINV管理中作用重要,应当在AINV管理策略中添加中医中药的方式作为重要的手段;6人次(26.09%)选择弃权。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#呕吐# #恶心# #全程管理# #抗肿瘤治疗#
128