谷氨酰胺是人体内最丰富的一种游离氨基酸。它是很多免疫细胞和小肠黏膜上皮细胞的重要能源物质,也是蛋白合成的重要调节剂,还是机体内氮和碳的重要运载工具,它具有很广泛的生理作用。
癌细胞就好比是贪吃蛇,大量摄入对它们的生存和增殖至关重要的分子,但是这种狼吞虎咽也将它们的周围环境——肿瘤微环境——变成酸性的、低氧的和营养物缺乏的,从而使得浸润到肿瘤微环境中的T细胞遭受功能衰竭而无法杀死癌细胞。许多肿瘤大量需要的营养物之一就是谷氨酰胺。
从20世纪50年代开始,人们就试图利用肿瘤对谷氨酰胺的依赖性,开发阻断谷氨酰胺代谢的药物。
比如,一种称为DON(6-diazo-5-oxo-L-norleucine)的细菌衍生性化合物就是一种常用的谷氨酰胺拮抗剂,它通过抑制几种允许癌细胞使用谷氨酰胺的酶来杀死肿瘤。
然而,在临床试验中,这种药物引起了严重的恶心和呕吐,因此从未被批准。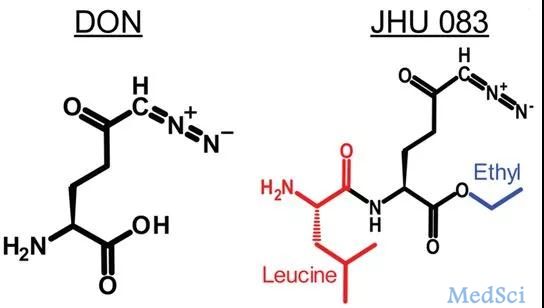
谷氨酰胺拮抗剂DON及其前体药物JHU-083的化学结构,图片来自Translational Oncology, 2019, doi:10.1016/j.tranon.2019.05.013。
为此,约翰霍普金斯大学基梅尔癌症中心癌症免疫治疗研究所副所长Jonathan Powell及其团队通过给DON添加化学基团,封闭它的羧基和氨基,制备出它的前体药物JHU-083。
在给药后,当它到达肿瘤附近时,在肿瘤周围游荡的酶会移除这些化学基团,将JHU-083变成DON,从而直接将DON释放到癌细胞上,可以延缓肿瘤生长,改变肿瘤微环境,并促进持久性的高活性抗肿瘤T细胞的产生。相关研究结果于2019年11月7日在线发表在Science 期刊上。
在此之前,Brittany Riggle等人发现JHU-083可逆转脑型疟疾(cerebral malaria)小鼠模型中的脑水肿、血脑屏障功能障碍和出血,并指出JHU-083可作为一种潜在的辅助治疗药物,用于治疗患有致命性脑型疟疾的儿童和成年人患者。
Allison Hanaford等人在细胞和动物模型中发现JHU-083降低癌细胞生长和促进细胞凋亡,有潜力用于治疗表达MYC的成神经管细胞瘤。但是,JHU-083的作用机制到底是什么仍然有待深入研究。
如今,Powell团队证实在多种不同的小鼠癌症模型(结直肠癌、淋巴瘤、以及黑色素瘤)中,利用JHU-083阻断谷氨酰胺代谢可抑制癌细胞的氧化代谢和糖酵解代谢,逆转肿瘤微环境中的低氧、酸中毒和营养物缺乏,这就使得T细胞在肿瘤微环境中处于活跃状态,而不会发生功能衰竭。
再者,效应T细胞对谷氨酰阻断的反应是显著上调氧化代谢,并呈现出长寿命、高度活化的表型。
这也是他们在世界上首次证实谷氨酰胺抑制剂对T细胞和癌细胞的作用不同,就相当于一边使肿瘤“挨饿”一边“投喂”效应T细胞。
这些细胞代谢的不同变化构成了通过产生强有力的抗肿瘤反应来治疗癌症的基础。
毫无疑问,这种药物治疗的结果就是显著降低肿瘤生长,并提高了这些小鼠的生存率。
在许多小鼠中,仅使用JHU-083进行治疗就可导致持久性治愈。这种治愈是由于这种代谢疗法激活的天然抗肿瘤免疫反应所导致的。
当向这些因成功治愈而没有癌症的小鼠体内重新注入新的肿瘤时,他们发现几乎所有小鼠都对新肿瘤产生免疫排斥,这就提示着JHU-083治疗产生了强大的免疫记忆力,从而能够识别和攻击新的癌症。
他们还用JHU-083和抗PD-1免疫检查点抑制剂对这些小鼠进行了治疗,其中免疫检查点抑制剂是一类免疫治疗药物,可解除癌细胞对T细胞的抑制。
Powell说:“起初,我们认为我们需要依次给予这种两种药物,以避免代谢疗法对免疫疗法带来任何潜在影响。但是,值得注意的是,事实证明,当我们同时给予它们时,这种联合治疗的效果最好。”相比于仅使用抗PD-1免疫检查点抑制剂,同时使用这种两种药物可增强它们的抗肿瘤作用。
鉴于JHU-083对T细胞产生非常积极的非常直接的作用,Powell团队探究了其中的原因。在利用JHU-083阻断谷氨酰胺代谢后,通过分析和比较肿瘤细胞和效应T细胞的基因表达,Powell及其同事们发现这两种细胞中的代谢相关基因表达存在较大的差异,这就表明它们的代谢途径是非常不同的。这些差异可能用作评估肿瘤免疫疗法的“代谢检查点(metabolic checkpoint)”。
此外,鉴于很多肿瘤对谷氨酰胺的需求都很迫切,这就意味着JHU-083可能能够用于治疗一系列癌症类型。这也意味着JHU-083有潜力成为一种广谱抗癌药物。
不过,虽然这项研究表明鉴于癌细胞对谷氨酰胺的需求要比正常细胞更为迫切,因此JHU-083选择性地靶向癌细胞,但是谷氨酰胺代谢几乎是身体中所有细胞所必需的,当利用JHU-083治疗癌症时,如何在最大程度地杀死癌细胞的同时,尽可能地减少对正常细胞的影响,还需开展进一步的研究。
此外,迄今为止,针对JHU-083开展的实验都是在细胞和动物模型中开展的,尚未开展人体临床试验,因此,它在人体中是否安全有效还有待进一步验证。毕竟已经有好多例子表明针对小鼠有效的药物通常对人体无效,DON就是如此。
当然,如果人体临床试验最终证实JHU-083确实安全有效的话,那么它的前景一定非常光明。这一光明的未来有可能在明年开始,届时,Powell将在人体中开展这种药物的安全性测试。
参考文献:
1.Brittany Riggle et al. MRI demonstrates glutamine antagonist-mediated reversal of cerebral malaria pathology in mice. PNAS, 2018, doi:10.1073/pnas.1812909115.
2.Allison Hanaford et al. Orally bioavailable glutamine antagonist prodrug JHU-083 penetrates mouse brain and suppresses the growth of MYC-driven medulloblastoma. Translational Oncology, 2019, doi:10.1016/j.tranon.2019.05.013.
3. Robert D. Leone et al. Glutamine blockade induces divergent metabolic programs to overcome tumor immune evasion. Science, 2019, doi:10.1126/science.aav2588.
4. Revamped cancer drug starves tumors in mice
https://www.sciencemag.org/news/2019/11/revamped-cancer-drug-starves-tumors-mice
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#阻断#
55
已学习
89
机制研究离临床仍然有距离,不过与临床结合思考,仍然有帮助的,不能仅仅是纯临床思维,转化思维同样重要
54