Lancet:CAR T治疗R/R CLL/SLL的初步探索结果喜人
2023-06-24 聊聊血液 聊聊血液 发表于上海
本研究证实,在复发或难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤患者中,单次输注 liso-cel 可诱导持久的CR/Cri,且安全性特征可控。
CAR-T与CLL/SLL
对于慢性淋巴细胞白血病和小淋巴细胞淋巴瘤(CLL/SLL),靶向治疗(包括BTK抑制剂、PI3K抑制剂和BCL2抑制剂)单用或与联合 CD20 单克隆抗体均显示疗效。然而在 BTK 抑制剂和 BCL2 抑制剂治疗后出现不耐受或疾病进展的复发或难治性(R/R)CLL/SLL患者中,尚无确定的标准治疗且结局较差,表明存在严重未满足的需求。
Lisocabtagene maraleucel (liso-cel) 是一种自体CD19 CAR T 细胞产品,以相等的CD8+和CD4+ CAR+ T细胞目标剂量给药。TRANSCEND CLL 004研究是一项liso-cel治疗复发或难治性CLL/SLL的多中心、开放标签、单臂、1-2期研究,其1期剂量递增部分确定 100 × 106 CAR+ T细胞的目标剂量为推荐的2期剂量。近日《The Lancet》报告了 TRANSCEND CLL 004 研究单药治疗部分的主要分析结果。

研究设计
该研究入组既往 BTK 抑制剂治疗失败(最佳缓解为疾病稳定或疾病进展,既往缓解后疾病进展,或因 BTK 抑制剂不耐受而停药)或不适合 BTK 抑制剂治疗的复发或难治性CLL/SLL成人患者(年龄≥18岁),所有患者均接受白细胞单采以生成liso-cel。在生产 liso-cel 期间,研究者可酌情决定使用桥接疗法控制疾病。在接受清淋化疗(氟达拉滨30 mg/m²和环磷酰胺300 mg/m²静脉给药,每日一次,持续3天)前,重新评估患者的可测量疾病;2-7天后给予由等剂量CD8+ 和CD4+ CAR+ T细胞组成的 liso-cel 静脉输注,1期的总目标剂量水平 (DL) 为50 × 10 CAR+ T细胞 (DL1) 或100 × 10 CAR+ T细胞 (DL2),2期剂量为DL2。
主要疗效终点为独立审查委员会(IRC)根据iwCLL 2018评估的安全缓解(CR)率或缓解伴骨髓不完全恢复(CRi)(complete response or remission with incomplete marrow recovery),包括DL2剂量下的既往BTK抑制剂进展和BCL-2失败患者中(作为主要疗效分析集)。
研究结果
患者
137例入组患者接受了白细胞单采,其中131例 (96%) 患者成功生产了liso-cel,并输注至117例患者(全安全性分析集),包括 DL2剂量下主要疗效分析集中的49例患者(图1)。
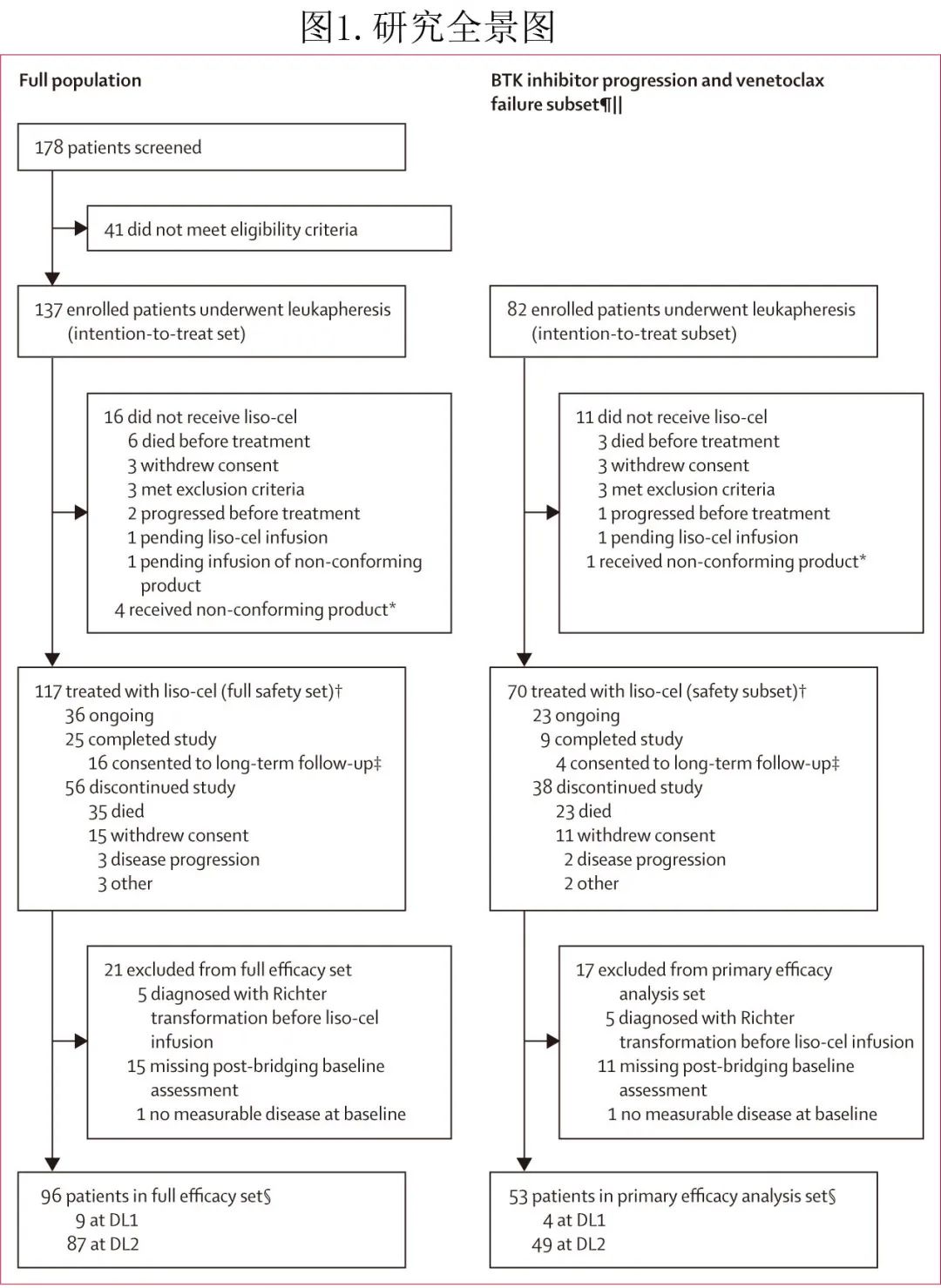
6例患者在治疗前死亡,死因包括疾病进展 (n=1)、未明不良事件 (n=1)、脓毒性休克 (n=1)、桥接治疗引起的速发过敏反应 (n=1) 和未知原因 (n=2)。从白细胞单采至 liso-cel 输注的中位时间为36天。9例患者接受DL1 治疗,中位剂量为43.8 × 10 CAR+ T细胞,108例患者接受 DL2 治疗,中位剂量为100.0 × 10 CAR+ T细胞。数据截止时,全安全性分析集的中位研究期间随访时间为21.1个。14例患者在门诊接受治疗。
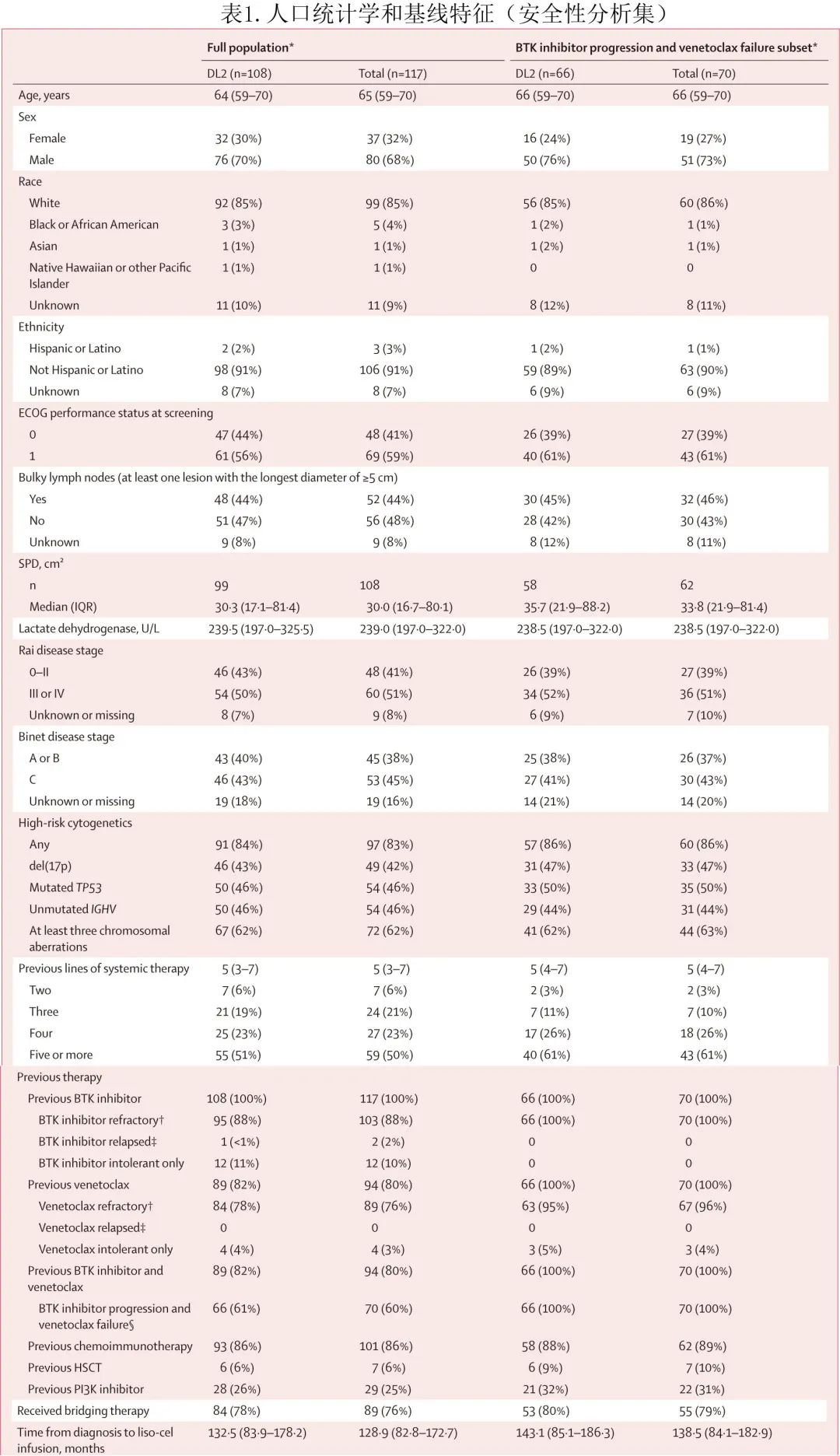
在全安全性集中 (n=117),中位年龄为65岁,52例 (44%) 患者伴巨大 (≥5cm) 淋巴结,97例 (83%) 有高危细胞遗传学(表1)。患者既往接受过中位5线治疗,包括 BTK 抑制剂 (117,100%)、化学免疫治疗 (101,86%) 和 PI3K 抑制剂 (29,25%);103例 (88%) 为 BTK 抑制剂难治,89例 (76%) 为维奈克拉难治,70例 (60%) 发生 BTK 抑制剂进展和维奈克拉治疗失败。89例 (76%) 患者在 liso-cel 生产期间接受了桥接治疗,主要是维奈克拉(39例,44%)和奥妥珠单抗(25例,28%)。全安全性分析集与 BTK 抑制剂进展和维奈克拉治疗失败子集之间的人口统计学和基线特征相似。
疗效
在DL2剂量下主要疗效分析集(n=49)中,IRC 评估的CR/CRi率为18%(n=9;p=0.0006;表2;主要终点),关键次要终点总缓解率为43%(n=21),与无效假设相比无统计学显著性 (p=0.39)。基于研究者根据 iwCLL 2018 进行的评估,CR/CRi率为24%(n=12),总缓解率为57%(n=28)。
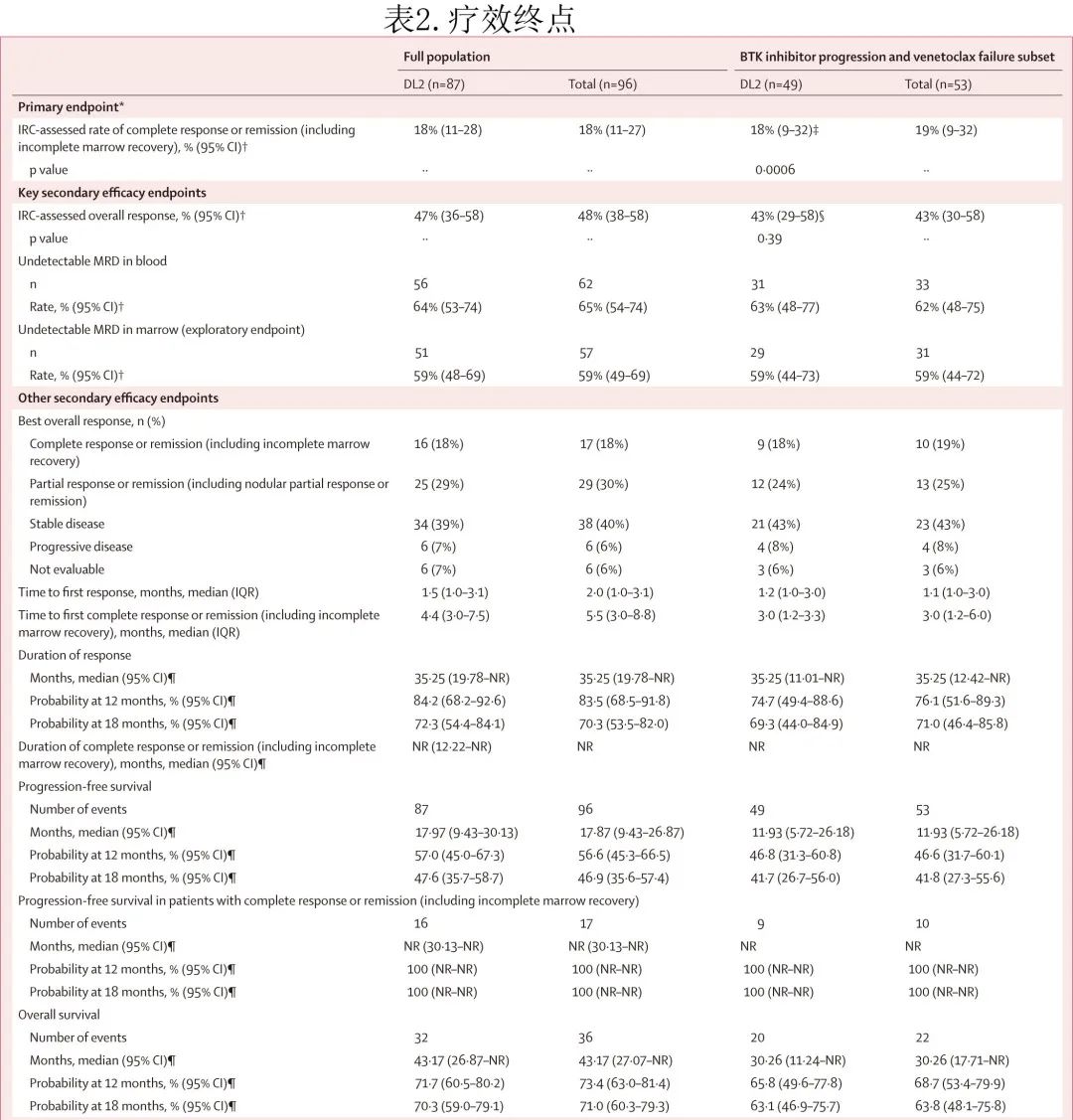
在30例del(17p)、TP53突变或两者兼有的患者中,CR/Cri率为23%(n=7),总缓解率为47%(n=14)。在 DL2剂量下的主要疗效分析集中,血液MRD(10-4)阴性率为63%(n=31),骨髓MRD阴性率为59%(n=29)。至首次缓解的中位时间为1.2个月,至首次CR/CRi的中位时间为3.0个月;中位缓解持续时间为35.3个月,中位CR/CRi持续时间未达到(表2,图2A)。中位无进展生存期(PFS)为11.9个月(图2B);中位总生存期(OS)为30.3个月(图2C)。
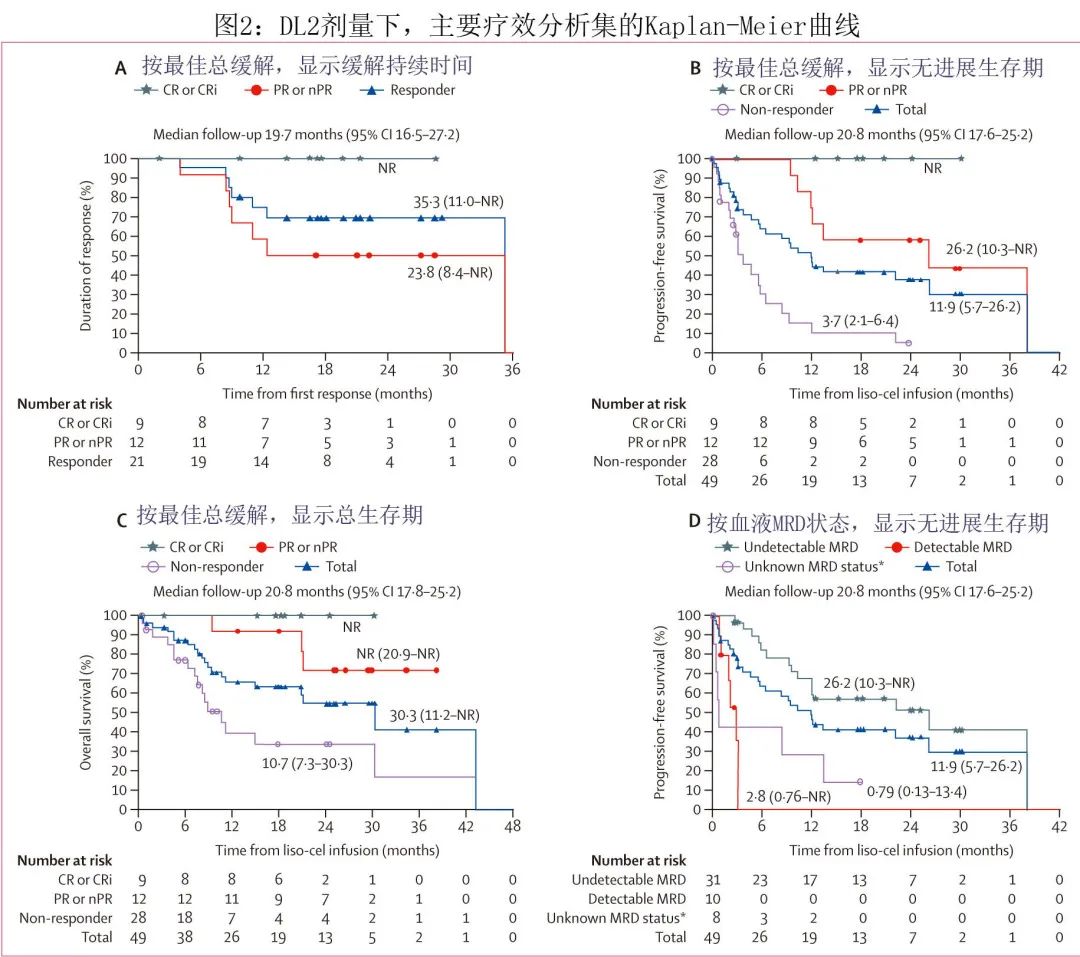
在主要疗效分析集中,MRD 可评估患者的 DL2 事后分析中,所有CR/CRi或部分缓解或部分缓解伴结节性部分缓解患者的血液和骨髓均达到MRD阴性。20例病情稳定的患者中,12例达到血液MRD阴性状态,10例达到骨髓MRD阴性状态。MRD阴性患者的中位PFS为26.2个月,MRD阳性患者为2.8个月(图2D)。在事后分析中,疾病稳定且MRD阴性患者的中位PFS为6.4个月,疾病稳定且MRD阳性患者为2.8个月。
在 DL2 全疗效集中 (n=87),IRC评估的疗效结果与 DL2 主要疗效分析集中的结果一致(表2)。此外意向治疗人群的缓解率也与疗效分析集相似。
安全性
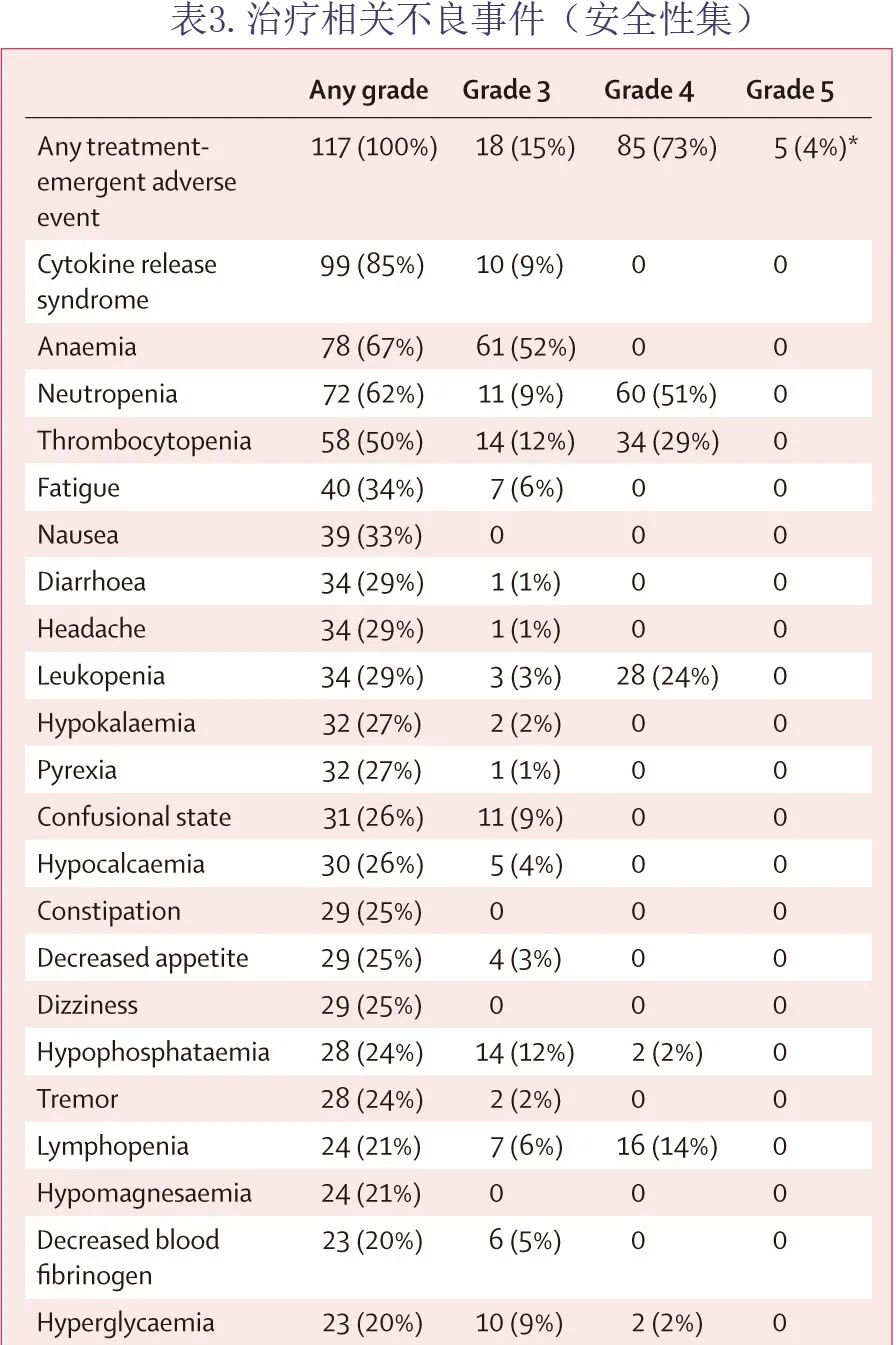
在全安全性集 (n=117) 中,108(92%) 例患者发生≥3级治疗中出现的不良事件(表3),最常见的是血细胞减少症:中性粒细胞减少症 (71,61%)、贫血 (61,52%) 和血小板减少症 (48,41%)。研究期间发生51例死亡,其中8例发生在 CAR T 细胞输注前,43例发生在 CAR T 细胞输注后;CAR T 细胞输注前8例死亡中的3例和输注后43例死亡中的27例(包括6例 Richter 转化)是由于疾病进展;在 CAR T 细胞输注后未发生进展的16例死亡中,5例死于不良事件(均在90天内),11例死于其他原因(均>90天)。在5例因不良事件导致的死亡中,研究者认为1例与 liso-cel 相关,该患者在输注 liso-cel 后第14天死于巨噬细胞活化综合征-噬血细胞性淋巴组织细胞增生症。
99例 (85%) 患者发生任何级别的细胞因子释放综合征(表4),其中10例 (9%) 患者发生3级细胞因子释放综合征,未发生4级或5级细胞因子释放综合征。53例 (45%) 患者发生任何级别的神经系统事件,其中21例 (18%) 患者发生3级神经系统事件,1例 (1%) 患者发生4级神经系统事件,无5级神经系统事件。发生3级神经系统事件的21例患者(个别患者发生1次以上神经系统事件)中意识模糊状态9例,脑病7例,躁动4例,失语3例,谵妄2例,嗜睡2例,头痛、不宁腿综合征、乏力、肌无力、震颤、精神状态改变和认知障碍各1例;1例患者出现4级脑病和4级嗜睡。不考虑因果关系,最常见的治疗后出现的神经系统不良事件为头痛 (34,29%)、意识模糊状态 (31,26%) 和头晕(29,25%)。
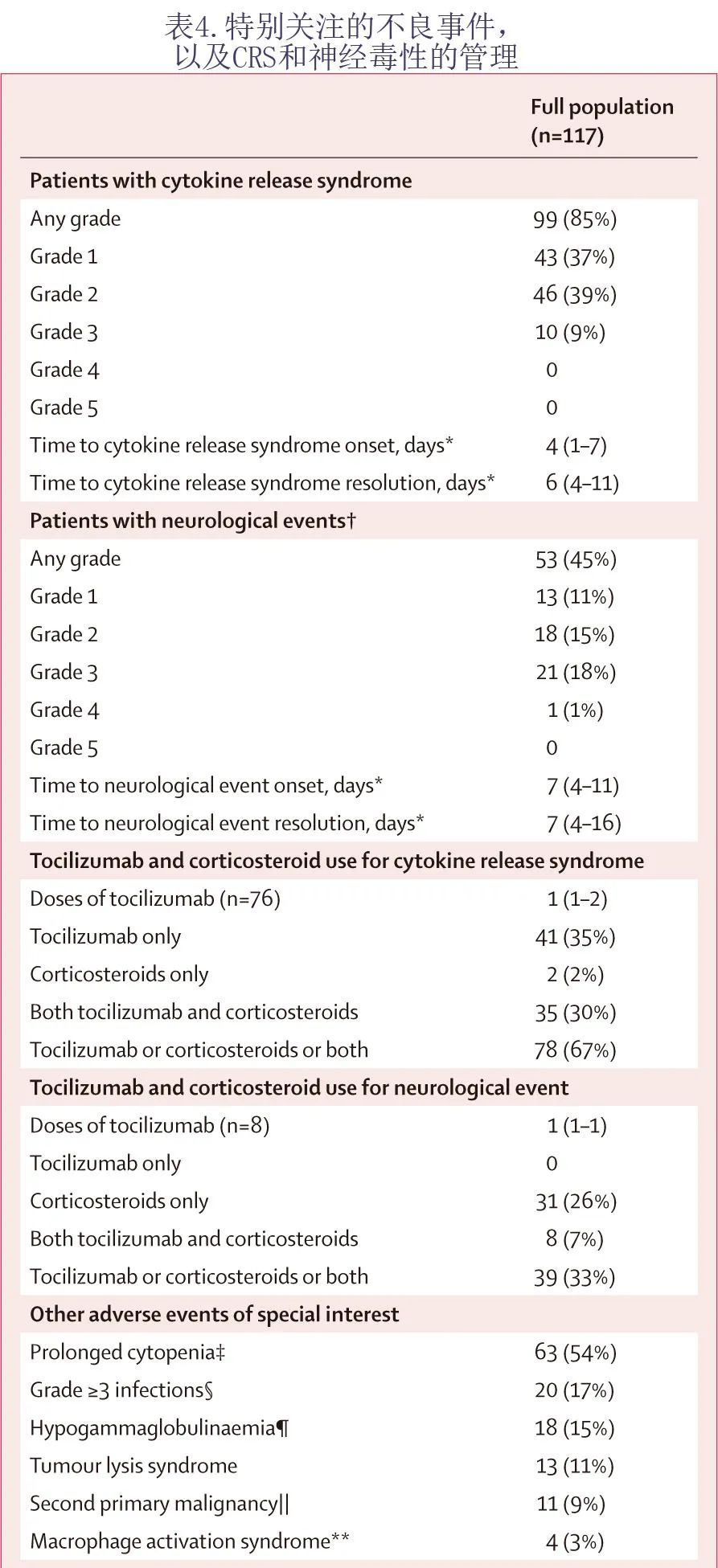
20例 (17%) 患者发生≥3级感染。63例 (54%) 患者报告了长期血细胞减少(第30天≥3级);在第30天后发生长期血细胞减少和实验室检查结果的患者中,15例 (100%) 患者发生贫血,36例 (80%) 患者发生中性粒细胞减少,37例血小板减少患者中的27例 (73%) 在 liso-cel 输注后90天内恢复至≤2级。在第90天仍存在中性粒细胞减少症的9例患者中,在研究结束时3例消退至≤2级,6例未消退。在第90天持续存在中性粒细胞减少症的9例患者中,1例患者发生≥3级感染,该患者在 liso-cel 输注前有中性粒细胞减少症和低丙种球蛋白血症病史,并死于5级曲霉菌感染。
11例 (9%) 患者报告了第二原发恶性肿瘤,均与 liso-cel 无关。
DL2 剂量下以及 BTK 抑制剂进展和维奈克拉治疗失败子集的安全性结局与整个人群一致。
总结
本研究纳入的117例R/R CLL/SLL患者均接受过既往 BTK 抑制剂治疗且治疗失败,其中部分患者也发生了维奈克拉失败 (n=70)。在 DL2剂量下 的主要疗效分析集中 (n=49),CR/CRi率为18%,具有统计学显著性 (n=9;p=0.0006),总缓解率为43%;中位缓解持续时间为35.3个月,CR/CRi中位持续时间未达到。117例患者中的10例 (9%) 报告了3级细胞因子释放综合征(无4级或5级事件),21例(18%;1例 [1%]4级,无5级事件)报告了3级神经系统事件。在研究期间的51例死亡中,43例发生在 liso-cel 输注后,其中5例死于治疗后出现的不良事件(liso-cel输注后90天内);1例死亡与 lisocel 相关(巨噬细胞活化综合征-噬血细胞性淋巴组织细胞增生症)
本研究证实,在复发或难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤患者(包括既往 BTK 抑制剂治疗后疾病进展和维奈克拉治疗失败的患者)中,单次输注 liso-cel 可诱导持久的CR/Cri,且安全性特征可控。这些结果支持一次性输注 liso-cel 作为复发或难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤的潜在新治疗方式。
参考文献
Siddiqi T,et al. Lisocabtagene maraleucel in chronic lymphocytic leukaemia and small lymphocytic lymphoma (TRANSCEND CLL 004): a multicentre, open-label, single-arm, phase 1–2 study.Lancet . 2023 Jun 5;S0140-6736(23)01052-8. doi: 10.1016/S0140-6736(23)01052-8.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言