丙肝病毒(HCV)研究进展
2016-08-31 佚名 生物谷
丙型肝炎由丙型肝炎病毒(HCV)感染所致,主要由血液/体液传播。据世界卫生组织估计,全球有1.7亿人感染HCV。在我国健康人群抗HCV阳性率为0.7%~3.1%,约3800万人。由于病毒生物学特点和宿主免疫功能等多方面因素,机体免疫往往难以有效清除病毒,致使约50%~80%HCV感染者发展为慢性肝炎,其中20%~30%将发展成肝硬化。肝硬化患者中每年有1%~4%发展成为肝细胞癌症。
丙型肝炎由丙型肝炎病毒(HCV)感染所致,主要由血液/体液传播。据世界卫生组织估计,全球有1.7亿人感染HCV。在我国健康人群抗HCV阳性率为0.7%~3.1%,约3800万人。由于病毒生物学特点和宿主免疫功能等多方面因素,机体免疫往往难以有效清除病毒,致使约50%~80%HCV感染者发展为慢性肝炎,其中20%~30%将发展成肝硬化。肝硬化患者中每年有1%~4%发展成为肝细胞癌症。
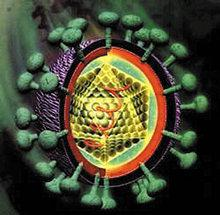
丙型肝炎病毒(HCV)可缓慢发展多年,通常无症状,但可引起严重的肝损伤和肝癌。目前还没有针对该疾病的疫苗。小编针对HCV研究最近取得的进展,作了一番盘点,希望有助于读者。
1、PLoS Biol:HCV利用Netrin-1劫持宿主肝细胞
doi:10.1371/journal.pbio.1002421
丙型肝炎病毒(HCV)是一种小型的包膜病毒:单股正链RNA病毒,包被在蛋白衣壳中,含有两种糖蛋白的脂质双层包膜包绕着这种蛋白衣壳,而且包膜上有剌突。急性HCV感染能够导致肝炎,但是这种病毒通常是以在肝脏中慢性感染的形式持续存在,并且这种持续存在能够导致肝脏炎症,以及最终导致肝细胞癌。HCV如何破坏肝细胞将它们变成病毒制造工厂仍然是个谜。
在一项新的研究中,来自法国里昂的Romain Parent和他的合作者发现一种小分子量分泌蛋白,Netrin-1,密切地参与HCV的生命周期。他们报道HCV增加肝细胞中的Netrin-1表达,接着,Netrin-1增加病毒RNA基因组数量和产生的病毒颗粒的传染性。更为重要的是,他们提供证据证实Netrin-1也促进HCV病毒被未感染的肝细胞摄取,这很可能是通过阻断表皮生长因子受体(EGFR)内化因而增加这种用于病毒摄取的辅因子在肝细胞表面上的数量来实现的。相关研究结果于2016年3月31日发表在PLoS Biology期刊上,论文标题为“Epidermal Growth Factor Receptor-Dependent Mutual Amplification between Netrin-1 and the Hepatitis C Virus”。
HCV主要在肝脏的肝细胞(hepatocyte, 也译作肝实质细胞)中进行复制。它通过与几种细胞表面蛋白的复杂相互作用而侵入这些肝细胞,并在细胞内膜上进行复制,特别是在内质网膜上。研究人员之所以研究Netrin-1在HCV感染中发挥的可能性作用,是因为之前的研究已证实它参与几种类型的癌症以及与癌症相关联的炎症性疾病。
研究人员首先研究从HCV患者体内获取的肝脏活组织样品中的Netrin-1 mRNA数量,然后将这种数量与来自未感染HCV的病人的类似样品进行比较。他们发现在被HCV感染的样品中Netrin-1 mRNA数量显著增加,增加了23倍,对HCV感染病人进行抗病毒药物治疗能够逆转这种增加。类似地,HCV感染原代人肝细胞和在体外培养的肝细胞系会导致这些细胞中的Netrin-1 mRNA数量大量增加,因而也会导致新翻译的Netrin-1蛋白数量显著增加。
已知Netrin-1 mRNA结合到La相关蛋白LARP1上,但是这种相互作用的功能重要性是不清楚的。研究人员发现LARP1也在促进Netrin-1翻译的内质网膜上特异性地与非结构性HCV蛋白NS5A发生相互作用。再者,在过量表达和基因敲除研究中,Netrin-1水平直接与被HCV感染的肝细胞中HCV RNA数量和所产生的病毒颗粒的传染性相关联,而且Netrin-1很可能是通过直接结合到HCV病毒颗粒上来实现的。因此,研究人员作出结论,HCV感染促进Netrin-1产生,接着,Netrin-1促进HCV产生。
但是这不是Netrin-1对HCV生命周期的唯一影响。研究人员也提供证据证实表达的Netrin-1通过阻止EGFR内化,增加肝细胞表面上的EGFR蛋白水平---以及活化的(磷酸化的)EGFR水平,而且这似乎促进HCV病毒侵入肝细胞。
2、PNAS:不同HCV变异体相互合作逃避免疫系统攻击
doi:10.1073/pnas.1422942112
研究人员指出,在感染人体之后,HCV进化出很多变异体,而且作为这种HCV群体中的病毒成员,其行为并不像独立个体,不同的病毒变异体会共同合作。它们有明确的职责分工,如利他性的病毒变异体会为了整个病毒群体的利益,引发宿主免疫系统攻击自己,从而保护其他变异体免遭攻击。
HCV在每个人体内的进化是不同的,随着时间推移会产生不同的遗传相关变异体。最终,病毒变异体和抗体会形成一种复杂的网络,在这个网络中,针对一种病毒变异体的抗体也能够与另一个变异体发生反应,这种现象称为交叉免疫反应性。
但是,病毒缺乏大脑,也没有神经细胞,如何会产生人类往往也很难实现的团队合作精神呢?研究人员解释说,病毒变异体并不直接互相沟通,但在这个病毒-抗体网络中,它们通过抗体相互作用。当一个抗体产生细胞对一种变异体作出反应并随后对另一种变异体作出反应时,这种相互作用会影响这两种变异体。当这两种病毒变异体与这个网络中的相同抗体相互作用时,就会发生一种间接的相互作用。”
与人免疫缺陷病毒(HIV)不同,HCV不能抑制机体的免疫系统。许多科学家认为,病毒感染的进化就像一场“军备竞赛”,病毒一直发生变异,以保持比身体免疫系统领先一步。为了验证这一观点,研究人员采用新一代基因测序数据,对HCV病毒群体进行了详细的分析。他们研究了HCV病毒群体的遗传组成,甚至观察了同一人所采集血液样本所含有的HCV随时间发生的进化。结果发现,不HCV变异体群体的数量或上升或下降,有一些会少量存留下来,而还有一些在貌似被免疫系统清除之后再次出现。在持续感染发展的后期阶段,尽管免疫系统保持强劲,但是新的HCV变异体的进化几乎停止。研究人员认为,“军备竞赛”理论无法解释这些观察结果。
研究人员通过他们的模型跟踪HCV变异体和抗体,发现某些变异体促使宿主免疫系统攻击自己以保护其他变异体。他们将这个新发现的现象称为“抗原合作(antigenic cooperation)”。抗体只抑制利他性的HCV变异体,从而使得其他病毒成员安然无恙。换言之,利他性的HCV变异体允许抗体来攻击它们,从而牺牲自己,这样其他的变异体就可得以生存,通过这种方式,利他性HCV变异体会欺骗免疫系统,致使免疫系统不能够有效地响应其他的变异体。本质上,幸存的HCV变异体把利他性变异体当作一把保护伞来保护自己。
这些研究结果可能会改变HCV疫苗的开发战略。研究人员还希望监测其他病毒的活动,以探讨这种复杂的相互作用,是否也可能存在于其他病毒性群体网络中。
3、BBA:发现HCV复制的关键组分
当HCV感染细胞时,HCV会通过跨膜蛋白NS4B来形成一个富含脂质的“膜网结构(membranous web)”。这种结构含有反应中心,HCV在反应中心进行复制时可以免受宿主细胞抗病毒防御机制的攻击。AH2肽位于NS4B内部,是一种两性螺旋片段,在重塑脂膜以形成膜网结构中发挥着至关重要的作用,不过其具体作用机制还不完全清楚。
在一项新的研究中,来自英国南安普敦大学的研究人员组合使用核磁共振谱和分子动力学技术,发现AH2与细胞中带负电荷的脂双层膜相互作用而使得脂双层膜更具延展性。AH2促进脂双层膜内负电荷磷脂分子聚集,减少脂双层膜压力,有利于脂双层膜重构,对反应中心的形成十分重要。进一步研究发现脂双层膜中负电荷磷脂分子的出现似乎能促进AH2解离,揭示磷脂分子聚集对调节NS蛋白相互作用关系具有潜在作用。当研究人员给细胞膜导入无电荷脂质时,AH2有不一样的表现:形成更大复合体,减少细胞膜变形。
研究人员认为,在分子水平上破解HCV如何劫持宿主细胞膜来帮助自身复制的机制,将有助人们发现HCV及类似病毒靶向治疗的新位点,并开发出潜在的HCV治疗药物。
4、Mol Cell Proteomics:研究揭示HCV病毒蛋白与人体细胞互作网络
doi:10.1074/mcp.M113.036301

病毒利用人体细胞以繁殖和传播,这个过程涉及细胞宿主因素以及病毒相互作用。丙型肝炎病毒(HCV)形成前体蛋白,它被加工成10种病毒蛋白。现在, Helmholtz Zentrum病毒学研究所科学家们发现这些蛋白质如何彼此互动。这种相互作用网络的揭示有助更好地了解病毒复制和发病机制,并为设计新的抗病毒治疗铺平了道路。
Michael Schindler教授领导的工作小组应用FACS-FRET(流式细胞仪-荧光共振能量转移)技术,表征活细胞中的蛋白相互作用。研究结果显示了病毒蛋白如何与人体细胞相互作用,这为寻找新的抗病毒物质提供了基础。
HCV感染导致肝脏炎症,并且多达80%的情况下炎症会变成慢性炎症,而丙型肝炎是肝硬化和肝癌发展的风险因素。
5、Cell Research:中科院建立世界首个丙型肝炎病毒持续感染的动物模型
doi: 10.1038/cr.2014.116
中国科学院武汉病毒所和生物物理所研究人员在《Cell Research》上发表封面文章,报道了世界上首个反映HCV感染自然史和慢性病毒性肝炎进展的动物模型。自从40年前美国NIH研究人员首次发现丙型肝炎后,全球目前已经有约2亿人感染或携带HCV,我国则有超过4000万患者。丙肝可以导致肝硬化和肝癌等可怕后果,同时也给世界各国医疗卫生体系带来巨大压力。
由于HCV变异性极强,很容易产生抗药性。在过去很长时间中,许多科学家都在探索一种合适的动物模型以用作HCV的深入研究。然而HCV只感染人类和黑猩猩,因此开发这种实验小鼠模型在实践上遇到了极大困难。本研究主要是由中科院病毒所和生物物理所的陈新文和唐宏等人完成,他们表示这一研究的成功为揭示丙肝的致病机制提供了迄今最先进的材料,还能从根本上推动丙肝防治的疫苗和药物研究。研究人员在小鼠肝脏细胞上通过转基因技术表达了HCV进入肝细胞的两个受体分子,CD81和OCLN。HCV能够识别并侵入小鼠的肝脏细胞并进行高度复制。同时80%受感染的小鼠在随后都出现了典型的HCV急性感染和慢性病理进展,包括出现脂肪肝、肝纤维化和肝硬化等症状。目前该实验室的研究人员已经利用这一模型观察到HCV如何逃逸免疫系统以及抗病毒药物是如何降低病毒滴度的。
6、Hepatology:新方法允许一步法诊断HCV感染
doi:10.1002/hep.28663
当前诊断丙型肝炎病毒(HCV)感染的标准方法需要两个连续的步骤:用于筛选的HCV抗体测试,随后进行HCV RNA RT-PCR测试来验证病毒血症性HCV(viremic HCV, V-HCV)感染(编者注:即导致病毒血症的HCV感染)。这使得它未最优化、成本高、不方便、耗时和不能够在全球广泛使用或负担得起。
在一项新的研究中,来自美国加州大学欧文分校的研究人员开发出一种新的HCV抗原酶免疫测定法(HCV-Ags EIA),并利用365种血清样品(其中,176种未发生V-HCV感染,189种发生V-HCV感染)评估了这种一步法诊断V-HCV感染的灵敏度、特异性和实用性。相关研究结果于2016年6月6日在线发表在Hepatology期刊上,论文标题为“A Highly Specific and Sensitive Hepatitis C Virus Antigens Enzyme Immunoassay for One-step Diagnosis of Viremic HCV Infection”。
首先,研究人员证实在HCV感染期间,除了HCV核心抗原之外,还存在HCV NS3、NS4b和NS5a蛋白。基于此,他们开发出这种新的同时检测这四种HCV蛋白的HCV-Ags EIA方法。
这项研究首次证实血清样品变性导致释放出的HCV抗原以HCV免疫复合物的形式存在,从而降低测试特异性,因此应当不能够用于任何HCV抗原测试,包括所有当前的HCV核心抗原测试。
另一方面,与血清HCV抗体测试和HCV RNA RT-PCR测试的结果相比较,利用未变性的血清样品,这种HCV-Ags EIA测试结果的特异性为99%,灵敏度为100%。
利用未变性的进行过稀释的血清样品进行测试,这种HCV-Ags EIA方法的最低检测限相当于大约150~250 IU/mL的血清HCV RNA水平。
研究人员开发出的这种HCV-Ags EIA方法是高度特异性的和高度灵敏的。利用未变性的血清样品,这种HCV-Ags EIA方法能够可靠地区分V-HCV感染和已得到控制的HCV感染,而且是一步法实现对V-HCV感染的筛选和诊断。
7、JCI:预测丙型肝炎病毒复发的标志物
doi:10.1172/JCI75938
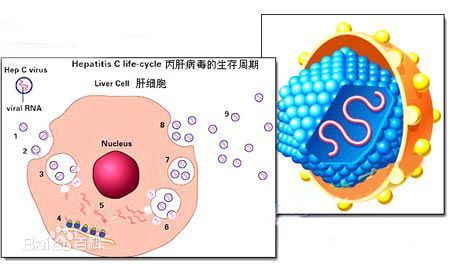
不幸的是,抗病毒治疗在一些患者中失败,导致丙型肝炎病毒复发。
发表在Journal of Clinical Investigation杂志的一项研究确定了一种标记,它可以识别患者在抗病毒治疗后是否可能有HCV复发。主要研究人员Shyamasundaran Kottilil和美国国家卫生研究院的同事评价抗病毒药物治疗丙型肝炎病毒感染者的免疫反应。
结果发现那些I型干扰素表达增加的治疗患者更有可能免于复发。无法维持I型干扰素的患者更可能有HCV复发。这项研究提供了一个潜在的标记,以确定患者是否易发生HCV复发。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











新知识了分享了
107
很好的,不错,学习了
93
不错的知识点学到了很多
98
不错的知识点学到了很多
97
不错的知识点学到了很多
51
不错的知识点学到了很多
74
不错的知识点学到了很多
57
不错的知识点学到了很多
74
不错的知识点学到了很多
49
不错的知识点学到了很多'
51